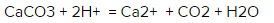Какое ионное уравнение реакции CaCO3 + 2HCl?
Каким будет ионное уравнение реакции CaCO3 + 2HCl = CaCl2 + CO2 + H20?
Объясните как составить ионное уравнение этой реакции?
Как составить ионное уравнение реакции CaCO3 (карбоната кальция) и 2HCl (хлорной кислоты)?
Тип реакции: кислотно-основный.
В результате реакции карбонат кальция и 2 молекул хлорной кислоты, HCl нейтрализуется с образованием слабой неустойчивой кислоты H2CO3, которая не может оставаться в таком виде, потому распадается на углекислый газ CO2 и воду H2O.
Чтобы составить ионную реакцию, нужно сделать следующее:
- Проанализировать компоненты молекулярной реакции.
- Разложить на ионы газы, жидкости и растворы, а твердые вещества не трогать.
- Убрать с обоих сторон одинаковые ионы, записать конечный вид ионной реакции CaCO3 и 2HCl.
Итак, вот молекулярное уравнение:
Теперь нужно разобрать каждую составляющую этого уравнения, чтобы составить правильное ионное уравнение:
- CaCO3 не растворяется (ведь это обычный мел);
- HCl — кислота, растворяющаяся в воде;
- CaCl2 — хлорид кальция, растворяющийся в воде.
- H20 — это вода, в ионной реакции она не участвует;
- CO2 — газ, в данной ионной реакции он не участвует.
Теперь можно разложить составляющие на ионы (раскладывается только 2HCL и CaCl2):
CaCO3 (твердый элемент) + 2Cl- + 2H+ = Ca2+ + 2Cl- + CO2 + H2O
Что мы имеем? В обеих частях уравнения есть ионы хлора, потому их можно сократить. И вот что мы получаем в итоге:
Если вы любознательны и хотите знать больше, читайте также вопросы:
Хлорид кальция: способы получения и химические свойства
Хлорид кальция CaCl2 — соль щелочноземельного металла кальция и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 110,98; относительная плотность для тв. и ж. состояния d = 2,51; tпл = 782º C; tкип = 1960º C;
Способ получения
1. Хлорид кальция можно получить путем взаимодействия кальция и хлора :
2. В результате взаимодействия карбоната кальция и соляной кислоты образуется хлорид кальция, углекислый газ и вода:
Качественная реакция
Качественная реакция на хлорид кальция — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид кальция образует нитрат кальция и осадок хлорид серебра:
Химические свойства
1. Хлорид кальция реагирует с простыми веществами:
1.1. В результате реакции между хлоридом кальция и водородом при 600 — 700º С и катализаторах Pt, Fe, Ni образуется гидрид кальция и соляная кислота:
1.2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С и образует на выходе кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
2. Хлорид кальция вступает в реакцию со многими сложными веществами :
2.1. Хлорид кальция вступает в реакции с основаниями :
2.1.1. Хлорид кальция взаимодействует с концентрированным раствором гидроксида натрия . При этом образуются гидроксид кальция и хлорид натрия:
CaCl2 + 2NaOH = Ca(OH)2↓ + 2NaCl
2.2. Хлорид кальция реагирует с кислотами:
2.2.1. Твердый хлорид кальция реагирует с концентрированной серной кислотой при кипении , образуя сульфат кальция и газ хлороводород :
2.3. Хлорид кальция вступает в взаимодействие с солями:
2.3.1. В результате реакции между хлоридом кальция и карбонатом натрия образуется карбонат кальция и хлорид натрия:
2.3.2. Хлорид кальция реагирует с фторидом аммония и образует фторид кальция и хлорид аммония:
2.3.3. Хлорид кальция может реагировать с сульфатом калия при 800º С с образованием сульфата кальция и хлорида калия:
Практическая работа № 6 Получение оксида углерода (IV) и получение его свойств. Распознавание карбонатов. химия 9 класс
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Химия 9 класс Практическая работа № 6
«Получение оксида углерода ( IV ) и изучение его свойств. Распознавание карбонатов»
Цель: научить получать углекислый газ реакцией обмена; продолжить ознакомление с химическими свойствами углекислого газа; познакомить с методами распознавания карбонатов.
Планируемые результаты: уметь получать и собирать углекислый газ в лаборатории, описывать наблюдаемые явления, доказывать наличие оксида углерода ( IV ), распознавать соли угольной кислоты в растворе.
Техника безопасности: осторожное обращение с химреактивами и стеклянной посудой.
Оборудование и реактивы: кусочки мрамора или мела, фенолфталеин, лакмус,
растворы: соляной кислоты , гидроксида натрия, нитрата серебра( I ), хлорида бария; вода, известковая вода, в пронумерованных пробирках кристаллические вещества( сульфат натрия, хлорид цинка, карбонат калия, силикат натрия), пробирки, газоотводная трубка с пробкой, стакан.
1.Получение оксида углерода ( IV ) и определение его свойств
1.Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты
При воздействии соляной кислоты на мрамор выделяется углекислый газ
2. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2-3 мл известковой воды
Образуется нерастворимое вещество карбонат кальция
3. Пропускаем углекислый газ еще некоторое время
Раствор становится прозрачным
При пропускании углекислого газа через известковую воду образуется карбонат кальция, который затем растворяется, превращаясь в гидрокарбонат
4. Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Затем поместите трубку в пробирку с 2-3 мл дистиллированной воды и пропустите через неё газ. Через несколько минут выньте трубку из раствора, внесите в полученный раствор универсальную индикаторную бумагу (синий лакмус)
В воде образуется слабая угольная кислота
5.В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия и добавьте к нему несколько капель фенолфталеина. Затем через раствор пропустите газ
Малиновая окраска исчезает, раствор становится прозрачным
Идет реакция между CO 2 и NaOH
Это еще раз подтверждает кислотные свойства
CO 2
В четырёх пронумерованных пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке. Na 2 SO 4 , ZnCl 2 , K 2 CO 3, Na 2 SiO 3
В каждую из пробирок добавляем раствор соляной кислоты
В двух пробирках ничего не изменилось, в одной из пробирок выделился газ, в другой студенистый осадок
Выделение газа при действии кислоты — признак карбонатов
Студенистый осадок – образовалась нерастворимая кремниевая кислота
Два оставшихся вещества растворяем водой и добавляем раствор хлорида бария
1) Выпал белый осадок
Это качественная реакция на сульфат-ион, значит, в данной пробирке находится сульфат натрия
В оставшийся раствор добавляем раствор нитрата серебра (I)
2) Выпал белый осадок
Реакция является качественной на хлорид-ион, в данной пробирке — хлорид цинка
Вывод: качественной реакцией на карбонат-ион является действие сильной кислоты, которая вытесняет слабую кислоту из раствора ее соли, происходит выделение углекислого газа.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 956 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 51 человек из 29 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 573 072 материала в базе
Материал подходит для УМК
«Химия», Рудзитис Г.Е., Фельдман Ф.Г.
§ 36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов
Другие материалы
- 14.02.2022
- 25
- 0
- 14.02.2022
- 32
- 0
- 14.02.2022
- 25
- 0
- 14.02.2022
- 35
- 0
- 14.02.2022
- 21
- 0
- 14.02.2022
- 55
- 0
- 14.02.2022
- 28
- 0
- 14.02.2022
- 26
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.02.2022 1928
- DOCX 209.5 кбайт
- 24 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Хубазова Анжелла Мовлдиевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 10 месяцев
- Подписчики: 3
- Всего просмотров: 19989
- Всего материалов: 47
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В школах Хабаровского края введут уроки спортивной борьбы
Время чтения: 1 минута
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
http://chemege.ru/xlorid-kalciya/
http://infourok.ru/prakticheskaya-rabota-6-poluchenie-oksida-ugleroda-iv-i-poluchenie-ego-svojstv-raspoznavanie-karbonatov-himiya-9-klass-5778812.html