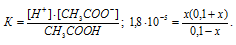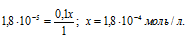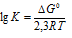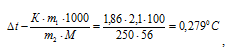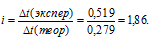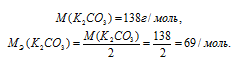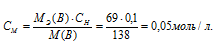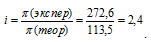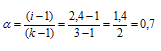Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df431646f169009 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Уксусная кислота диссоциирует по уравнению CH3COOH CH3COO + H+ Степень диссоциации уксусной кислоты очень низкая: в 0,1-молярном растворе при н.у. только. — презентация
Презентация была опубликована 6 лет назад пользователемЕвгений Лабунский
Похожие презентации
Презентация на тему: » Уксусная кислота диссоциирует по уравнению CH3COOH CH3COO + H+ Степень диссоциации уксусной кислоты очень низкая: в 0,1-молярном растворе при н.у. только.» — Транскрипт:
2 Уксусная кислота диссоциирует по уравнению CH3COOH CH3COO + H+ Степень диссоциации уксусной кислоты очень низкая: в 0,1-молярном растворе при н.у. только три молекулы из ста миллионов распадаются на ионы Н + и ацетат-ионы СН 3 СОО- Значит, уксусная кислота – слабый электролит, поэтому в ионных уравнениях реакций её формула записывается в молекулярном виде.
3 Уксусная кислота проявляет кислотные свойства. Она взаимодействует с активными металлами,образуя соли — ацетаты: MgMg(тв) + 2CH3COOH (CH3COO)2Mg + H2H2
4 Водородные атомы у α-углерода более подвижны, чем другие атомы водорода в цепи, что приводит к возможности их замещения, например, на атом галогена: CH3COOH + Cl2 CH2ClCOOH + HCl
Задачи по химии на расчеты концентрации ионо и изотонических коэффициентов электролитов
Задача 514.
Рассчитать концентрацию ионов CH3COO — в растворе, 1 л которого содержит 1 моль CH3COOH и 0,1 моля НСI, считая диссоциацию последнего полной.
Решение:
KD(CH3COOH) = 1.8 . 10 -5 .
Уравнения диссоциаций кислот имеют вид:
CH3COOH ⇔ CH3COO — + H + ;
HCl⇔ Cl — + H + .
При введении в раствор слабого электролита CH3COOH раствора сильного электролита НСI (т.е. ионов H + ), одинаковых ионов, образующихся при диссоциации уксусной кислот, равновесие диссоциации последней нарушается и смещается в направлении образования недиссоциированных молекул, так что степень диссоциации слабого электролита уменьшится.
Таким образом, при прибавлении 0,1 М раствора НСI к 1 М раствору CH3COOH приведёт к повышению концентрации ионов водорода и, согласно правилу Ле Шателье, равновесие диссоциации сместится влево, в сторону увеличения концентрации молекул уксусной кислоты. Концентрацию ионов H + и CH3COO — при диссоциации CH3COOH обозначим через x моль/л. Тогда концентрация недиссоциированных молекул CH3COOH будет равна (1 – x)моль/л. Общая концентрация ионов H + будет слагаться из двух величин: из концентрации, создаваемой при диссоциации CH3COOH, и из концентрации, создаваемой при диссоциации НСI, т.е. (0,1 + x). Подставим полученные значения концентраций в выражение константы диссоциации CH3COOH, рассчитаем значение x, получим:
Поскольку в присутствии одноимённых ионов H + диссоциация уксусной кислоты подавляется, то степень её диссоциации будет ничтожно мала и поэтому значением (x) в множителях (1 – x) и (1 + x) можно пренебречь. Тогда получим выражение:
Ответ: 1,8 . 10 -4 моль/л.
Задача 515.
Исходя из значений последовательных констант диссоциации ортофосфорной кислоты, определить знак изменения энергии Гиббса для каждой из трех ступеней диссоциации. Для какой из них 
Решение:
Диссоциация трёхосновной ортофосфорной кислоты протекает в три ступени, поэтому для каждой ступени будет отвечать определённое значение константы диссоциации. Константы ступенчатых диссоциаций H3PO4 имеют следующие значения:
К1 = 7,5 . 10 -3 ; К2 = 6,3 . 10 -8 ; К3 = 1,3 . 10 -12 , т.е. К1 > K2 > K3.
Тогда из уравнения:

Все значения констант меньше единицы, значит, все значения
Ответ: Для третьей ступени.
Задача 516.
Раствор, содержащий 2,1г КОН в 250г воды, замерзает при -0,519°С. Найти для этого раствора изотонический коэффициент.
Решение:
Теперь определим понижение температуры кристаллизации 
где
m1 — масса растворённого вещества, m2 — масса раствора, М – молярная масса растворённого вещества, К – криоскопическая константа.
Сравнивая найденное значение 

Ответ: 1,86.
Задача 517.
При 0°С осмотическое давление 0,1 н. раствора карбоната калия равно 272,6 кПа. Определить кажущуюся степень диссоциации в растворе.
Решение:
Найдём молярность 0,1 н раствора К2СО3 по формуле:
По уравнению 

Теперь рассчитаем изотонический коэффициент (i) раствора, сравнив экспериментальное значение осмотического давления с теоретическим значением, получим:
Рассчитаем кажущуюся степень диссоциации (
здесь K — общее число ионов, образующихся при диссоциации электролита.
http://www.myshared.ru/slide/1141497/
http://buzani.ru/zadachi/khimiya-glinka/1176-dissotsiatsiya-kislot-zadachi-514-517