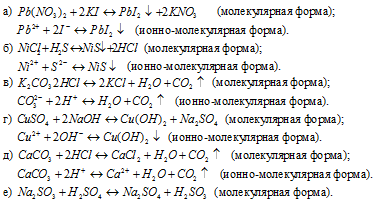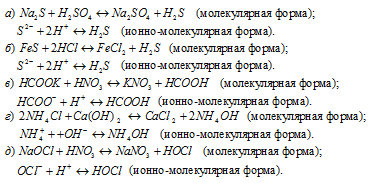Задачи 30, 31 ЕГЭ по химии-2020
Задачи 30 и 31 из реального ЕГЭ по химии-2020, все задачи на окислительно-восстановительные реакции из реального экзамена ЕГЭ по химии, задания 30 и 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.
| Выдержка из формулировки каждого варианта 30 задания: «В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.» Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.» Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания. 1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества. 2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации. 3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту. |
1. Нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II).
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
Ch3coonh4 hno3 ионное уравнение полное и сокращенное
Вопрос по химии:
Напишите молекулярные,полные и сокращенные ионно молекулярные уравнения реакций нейтрализации азотной и уксусной кислот
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
HNO3 + KOH = KNO3 + H2O
H(+) + NO3(-) + K(+) + OH(-) = K(+) + NO3(-) + H2O
H(+) + OH(-) = H2O
CH3COOH + NaOH = CH3COONa + H2O
CH3COO(-) + H(+) + Na(+) + OH(-) = CH3COO(-) + Na(+) + H2O
H(+) + OH(-) = H2O
1.Молекулярное:KOH+HNO3=KNO3+H2O
Ионное полное:K[+]+OH[-]+H[+]+NO3[-]=K[+]+NO3[-]+H2O.
Ионное сокращенное:H[+]+OH[-]=H2O
2.Молекулярное:NaOH+CH3COOH=CH3COONa+H2O
Ионное полное:Na[+]+OH[-]+CH3COO[-]+H[+]=CH3COO[-]+Na[+]+H2O
Ионное сокращенное:H[+]+OH[-]=H2O.
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-580-582
http://online-otvet.ru/himia/5cea822196f4e19a2918b5c4