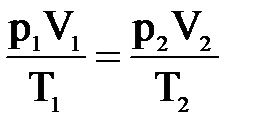Частный случай уравнения менделеева клапейрона
Встречаются процессы, когда какой-либо параметр газа остаетcя в процессе изменения его состояния постоянным. Эти процессы называются изопроцессами . Линии, изображающие на каком-либо из графиков зависимость параметров газа друг от друга: называются изотерма ( = const), изохорой ( = const), изобарой ( = const).
Для изопроцессов уравнение Менделеева–Клапейрона преобразуется следующим образом (предполагается, что масса газа и его состав неизменны):
1. Если = const, то = const (изотермический процесс) или
2. Если = const, то (изохорический процесс) или:
3. Если = const, то (изобарический процесс) или:
Выражения, полученные как следствия уравнения Менделеева–Клапейрона, были выведены на основе обобщения большого количества экспериментальных данных раньше, чем записано это уравнение и независимо от проведенных выше рассуждений, поэтому, в силу исторических традиций, называются не логическими следствиями, а законами ( Бойля–Мариотта, Шарля, Гей–Люссака , соответственно, по именам открывших их ученых).
Поскольку зависимости, предсказанные нами находят свое экспериментальное подтверждение, у нас есть основания полагать, что и исходные, и промежуточные рассуждения также верны.
Существенно, что в опытах найденные зависимости выполняются с весьма высокой точностью не для какого-то абстрактного идеального газа, а для обычных, всем нам известных воздуха, кислорода, водорода и других газов, если только газы не слишком охлаждены и давления их не слишком высоки. Критерии здесь весьма расплывчаты. По крайней мере, для условий, не очень отличающихся от нормальных, эти зависимости имеют место.
Полученные зависимости, в конечном счете, имеют простой вид. Но обратите внимание на одно странное обстоятельство. В самом начале рассуждений мы приняли ряд допущений. Напомним их суть.
Мы договорились применять к газам законы классической механики, в частности, второй закон Ньютона. Но еще в первом разделе, когда речь шла о броуновском движении, позволяющем судить о характере движения молекул, было сказано, что в микромире работают статистические законы, принципиально отличающиеся от законов классической механики.
Еще одно допущение касалось скоростей молекул. Мы договорились считать их одинаковыми для всех молекул. Но ведь нам же известно распределение молекул по скоростям. По крайней мере, мы знаем, что скорости молекул различны.
Удары молекул о стенки сосуда мы считали абсолютно упругими. Но разве абсолютно упругие удары существуют в природе?
Сами молекулы мы представили в виде шариков. Мало того, что речь шла об одноатомном газе, а на практике мы имеем дело, как правило, с газами двухатомными, так ведь шарик – это уж очень простая и далекая от истины модель молекулы.
Получается интересная вещь. Практически все наши допущения были неверными, созданная нами модель оказалась весьма грубой и примитивной. Но на основе этой модели нам удалось получить замечательные по своей простоте следствия. И самое поразительное, что следствия оказались правильными, отлично согласованными с экспериментом!
Сказанное означает, что наша модель имеет право на существование, ею можно пользоваться и в дальнейшем, возможно она позволит нам получить еще какие-то следствия, которые также потом подтвердятся на опыте .
У наших выводов есть еще одна сторона. То, что найденные зависимости совершенно одинаково выполняются для разных газов, характеризует саму природу газообразного состояния . Подобных зависимостей нет ни для жидкостей, ни для твердых тел, свойства которых существенно зависят от типа частиц, из которых они состоят. В газах же расстояния между частицами настолько велики по сравнению с размерами самих частиц, что эти частицы друг на друга не влияют. Таким образом, газы обладают свойствами, которые не зависят от сил взаимодействия частиц между собой . Именно поэтому все газы и ведут себя одинаково. Вместе с тем, когда давление и температура газа становятся такими, что вероятность столкновения частиц, притяжения их друг к другу, возрастают, сходство в поведении газов исчезает.
Частные случаи уравнения Менделеева-Клапейрона
Если в уравнении Менделеева-Клапейрона принимать некоторые из параметров за постоянные величины, то получим ряд частных уравнений.
1. Допустим, что m = const, тогда из уравнения pV=mRT/M следует, что 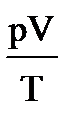
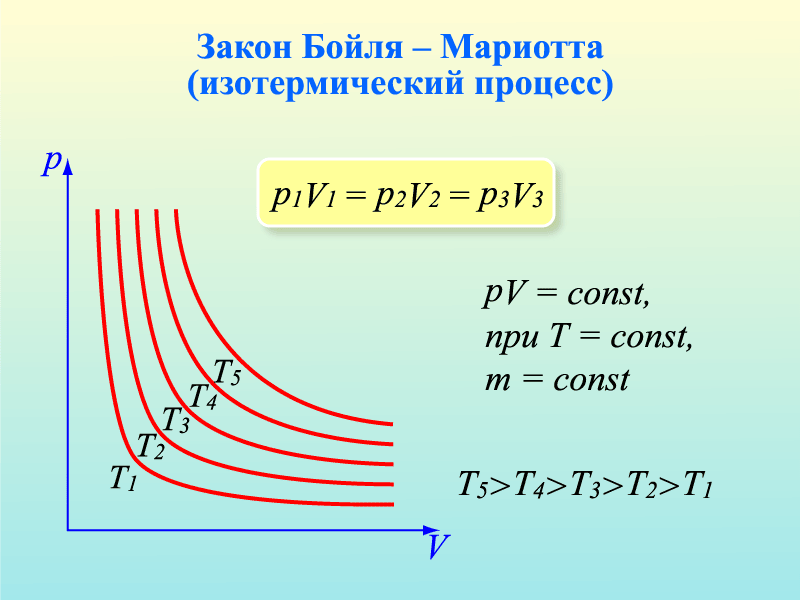
2. Допустим, что m = const и Т = const. Такие процессы называют изотермическими. Учитывая это, нетрудно заметить, что в уравнении pV=mRT/M правая часть будет постоянной при любых изменениях давления и объема, т.е. pV=const или же p1V1=p2V2
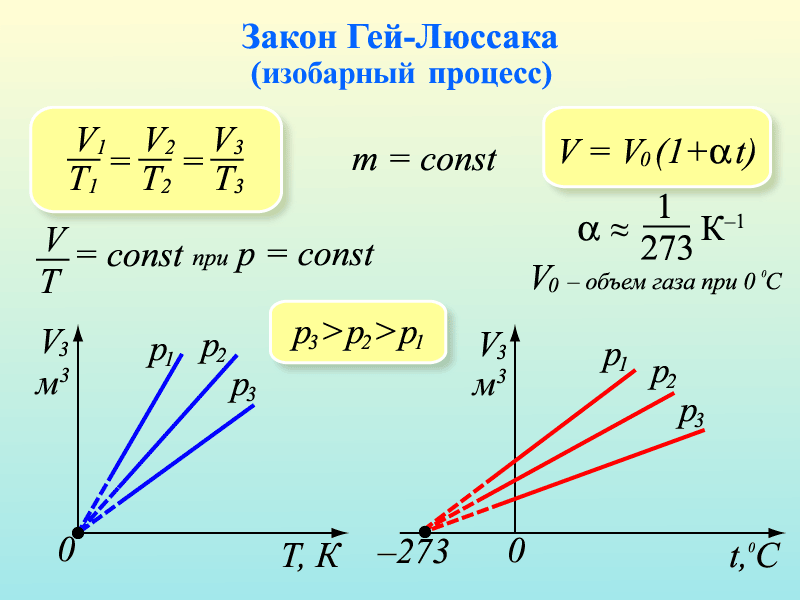
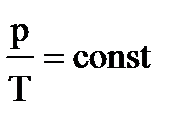
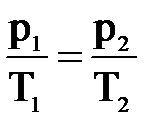
4. Примем m=const и p=const. Процесс с постоянным давлением называется изобарным. Используя уравнение Менделеева-Клапейрона, установим связь между объёмом и абсолютной температурой. Она находится как 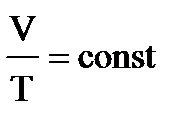
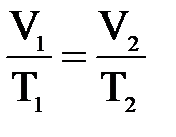
При изобарическом процессе объём идеального газа прямо пропорционален его абсолютной температуре. Связь между объемом и абсолютной температурой была установлена французским физиком Гей-Люссаком. График процесса называется изобарой.
1. Запишите уравнение Менделеева-Клапейрона.
2. Запишите объединённый газовый закон.
3. Сформулируйте закон Бойля-Мариотта.
4. Какой вид имеет изотерма в координатах Р,V?
5. Сформулируйте закон Шарля.
6. Как выглядит изохора в координатах Р,Т?
7. Сформулируйте закон Гей-Люссака?
8. Как выглядит изобара в координатах V,Т?
1. Сосуд емкостью 32×10 -3 м 3 наполнен азотом под давлением 9×10 5 Па при температуре 27°С. Определите массу азота в сосуде, если его молярная масса 0,028 кг/моль.
2. Какова температура 160×10 -2 кг кислорода, находящегося под давлением 5∙10 6 Па и занимающего объем 16×10 -3 м 3 ? Молярная масса кислорода 0,032 кг/моль.
3. Определите давление воздуха в сосуде объемом 55×10 -3 м3, если его масса 4,2×10 -2 кг, температура 27°С, а молярная масса 0,029 кг/моль.
4. Определите плотность водорода при температуре 47°С и давлении 400 кПа.
5. Объем водорода при температуре 150°С и давлении 4,98×105 Па равен 2,5×10 -3 м3. Каков объем той же массы водорода при 0°С и давлении 8∙10 5 Па?
6. При давлении 10 5 Па и температуре 65°С воздух имеет объем 24×10 -3 м3. При каком давлении данная масса воздуха займет объем 4×10 -3 м3, если температура его станет 40°С?
7. Воздух, содержащийся в резиновом шаре, при температуре 30°С и давлении 120 кПа имеет объем 3,5 л. При погружении шара в воду, температура которой 5°С, давление воздуха увеличилось до 20×10 5 Па. На сколько изменился объем воздуха в шаре?
8. Какова разница в массе воздуха, заполняющего помещение объемом 150 м 3 , зимой и летом, если летом температура помещения достигает 30°С, а зимой падает до 0°С?
9. В баллоне при 27°С и давлении 3 МПа находится ацетилен. Каким станет давление в баллоне после расхода половины массы газа, если температура при этом понизится до 10°С?
10. Сколько молекул воздуха выходит из комнаты объемом 150 м 3 при повышении температуры от 10 до 35°С? Атмосферное давление 10 5 Па.
ДОМАШНЕЕ ЗАДАНИЕ 7
1. Сосуд емкостью 42×10 -3 м 3 наполнен азотом под давлением 8×10 5 Па при температуре 27°С. Определите массу азота в сосуде, если его молярная масса 0,028 кг/моль.
2. Какова температура 320×10 -2 кг кислорода, находящегося под давлением 5∙10 6 Па и занимающего объем 32×10 -3 м 3 ? Молярная масса кислорода 0,032 кг/моль.
3. Определите давление воздуха в сосуде объемом 35×10 -3 м 3 , если его масса 2×10 -2 кг, температура 27°С, а молярная масса 0,029 кг/моль.
4. Определите плотность водорода при температуре 7°С и давлении 200 кПа.
5. Объем водорода при температуре 250°С и давлении 6×10 5 Па равен 8,5×10 -3 м 3 . Каков объем той же массы водорода при 0°С и давлении 9∙10 5 Па?
6. При давлении 2∙10 5 Па и температуре 95°С воздух имеет объем 40×10 -3 м 3 . При каком давлении данная масса воздуха займет объем 4×10 -3 м3, если температура его станет 40°С?
7. Воздух, содержащийся в резиновом шаре, при температуре 35°С и давлении 120 кПа имеет объем 4,5 л. При погружении шара в воду, температура которой 5°С, давление воздуха увеличилось до 10×10 5 Па. На сколько изменился объем воздуха в шаре?
8. Какова разница в массе воздуха, заполняющего помещение объемом 450 м 3 , зимой и летом, если летом температура помещения достигает 25°С, а зимой падает до 0°С?
9. В баллоне при 27°С и давлении 1,2 МПа находится ацетилен. Каким станет давление в баллоне после расхода половины массы газа, если температура при этом понизится до 5°С?
10. Сколько молекул воздуха выходит из комнаты объемом 250 м 3 при повышении температуры от 0 до 35°С? Атмосферное давление 10 5 Па.
11. В цилиндре дизельного двигателя автомобиля температура воздуха в начале такта сжатия была 30 о С. Найти температуру воздуха в конце такта, если его объём уменьшился в 20 раз, а давление возрастает в 50 раз.
12. Во фляжке вместимостью 1,5 л находится 1л воды. Турист пьёт из неё воду, плотно прижав губы к горлышку так, что во фляжку не попадает наружный воздух. Сколько воды удастся выпить туристу, если он может понизить давление оставшегося во фляжке воздуха до 80 кПа?
11. Какова была начальная температура воздуха, если при нагревании его на 5К объём увеличился на 2% от первоначального?
12. В закрытом цилиндре по одну сторону легкоподвижного поршня имеется некоторая масса газа при температуре -70°С, по другую — такая же масса этого газа при температуре 25°С. Поршень находится в равновесии. Общий объем газа 4×10-4 м3. Определите объем газа в каждой из частей цилиндра.
V1=1.6×10 -4 м 3 V2=2,4×10 -4 м 3
13. Закрытый с обоих концов цилиндр наполнен газом и разделен легкоподвижным поршнем на две равные части длиной по 0,34 м каждая. Температура газа 27°С. На сколько градусов надо нагреть газ в одной половине цилиндра, чтобы поршень сместился на 0,1 м?
Частный случай уравнения менделеева клапейрона
Уравнение Менделеева-Клапейрона — уравнение состояния для идеального газа, отнесенное к 1 молю газа. В 1874 г. Д. И. Менделеев на основе уравнения Клапейрона объединив его с законом Авогадро, используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT , где R — универсальная газовая постоянная,
R = 8,31 Дж/(моль . К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа. Для произвольной массы газа М, молярная масса которого m: pV = (М/m) . RT. или pV = NАkT,
где NА — число Авогадро, k — постоянная Больцмана.
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров — давление, объем или температура — остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа.
Изотермический процесс — процесс изменения состояния системы при постоянной температуре. Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля — Мариотта.
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой — термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: P1V1=P2V2=const. Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.
Изобарный процесс — процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака. Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: V/T=const. Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
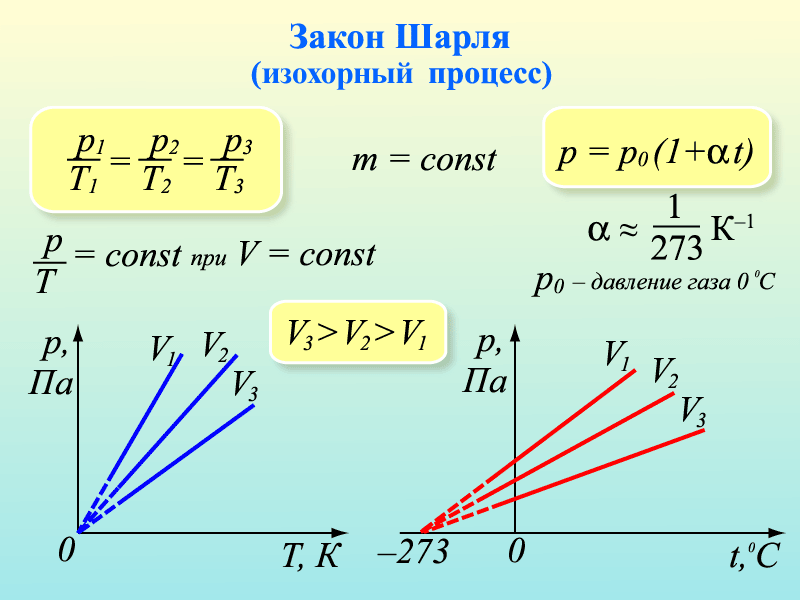
Изохорный процесс — процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля. Согласно закону Шарля, давление газа прямо пропорционально его температуре: P/T=const. Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.
Итак, из закона pV = (М/m) . RT выводятся следующие законы:
p = const => V/T = const — закон Гей — Люссака .
V= const => p/T = const — закон Шарля
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление — это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.
Некоторых, возможно, интересует вопрос, каким образом удалось определить постоянную Авогадро NA = 6,02·10 23 ? Значение числа Авогадро было экспериментально установлено только в конце XIX – начале XX века. Опишем один из таких экспериментов.
В откачанный до глубокого вакуума сосуд объемом V = 30 мл поместили навеску элемента радия массой 0,5 г и выдержали там в течение одного года. Было известно, что за секунду 1 г радия испускает 3,7·10 10 альфа-частиц. Эти частицы представляют собой ядра гелия, которые тут же принимают электроны из стенок сосуда и превращаются в атомы гелия. За год давление в сосуде выросло до 7,95·10 -4 атм (при температуре 27 о С). Изменением массы радия за год можно пренебречь. Итак, чему равна NA?
Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов:
N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда:
NA = NRT = 5,83 . 10 17 . 0,0821 . 300 = 6,02 . 10 23
PV 7,95 . 10 -4 . 3 . 10 -2
В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время.
http://megaobuchalka.ru/11/58897.html
http://www.sites.google.com/site/opatpofizike/uravnenie-mendeleeva-klapejrona