Закон Авогадро в химии
Содержание:
Открытие закона
Закон Авогадро был сформулирован итальянским химиком Амадео Авогадро в 1811 году и имел большое значение для развития химии того времени. Впрочем, и сегодня он не потерял своей актуальности и значимости. Попробуем же сформулировать закон Авогадро, звучать он будет примерно так.
Формулировка закона
Итак, закон Авогадро гласит, что при одинаковых температурах и давлении в равных объемах газов будет содержаться одинаковое число молекул, независимо, как от их химической природы, так и физических свойств. Данное число является некой физической константой, равной количеству атомов, молекул, ионов содержащихся в одном моле.
Первоначально закон Авогадро был лишь гипотезой ученого, но позже эта гипотеза была подтверждена большим количеством экспериментов, после чего она и вошла в науку под названием «закон Авогадро», которому суждено было стать основным законом для идеальных газов.
Формула
Сам первооткрыватель закона полагал, что физическая константа является большой величиной, но какой именно не знал. Уже после его смерти в ходе многочисленных экспериментов было установлено точное число атомов, содержащихся в 12 г углерода (именно 12 г – атомная единица массы углерода) или же в молярном объеме газа равному 22,41 л. Константу эту на честь ученого назвали «числом Авогадро», обозначают его как NA, реже L и она равна 6.022*10 23 . Иными словами число молекул любого газа в объеме 22,41 л будет одинаковым как для легких, так и тяжелых газов.
Математическую формулу закона Авогадро можно написать так:
Где, V — объем газа; n — количество вещества, которое является отношением массы вещества к его молярной массе; VM — константа пропорциональности или молярный объем.
Практическое применение
Дальнейшее практическое применение закона Авогадро очень сильно помогло химикам определить химические формулы многих соединений.
Видео
И в завершение образовательное видео по теме нашей статьи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Avogadro’s Law.
Формулировка и определение закона Авогадро
Закон Авогадро в химии — история открытия
Известно, что вещества бывают в твердом, жидком и газообразном состоянии. Частицы жидкости и твердого вещества расположены близко по отношению друг к другу. Это объясняется взаимным притяжением молекул. Можно сделать вывод о существовании сил, удерживающих молекулы жидкости или твердого вещества вместе. Такие силы носят название сил межмолекулярного взаимодействия.
Молекулы газов существенно удалены друг от друга, что отличает подобные вещества от жидкостей и твердых. На таком расстоянии взаимодействие между молекулами почти отсутствует. В связи с этим, для трансформации вещества из жидкого или твердого агрегатного состояния в газообразное требуется преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние реализуется в результате повышения температуры веществ, которые находятся в виде жидкости или твердого:
- кипение жидкостей;
- возгонка твердых веществ (переход из твердого состояния в газообразное).
Исходя из того, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, — это, по существу, объем свободного пространства между хаотично перемещающимися молекулами газа. Величина данного пространства определяется условиями, при которых находится газ:
Такая величина приблизительно одинакова для всех газообразных веществ при одинаковых температуре и давлении. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Отсюда вытекает закон Авогадро.
Согласно закону Авогадро, если объемы различных газов равны и взяты при одинаковых температурах и давлении, то они содержат одинаковое число молекул. Гипотезу выдвинул в 1811 году в Турине профессор физики Амедео Авогадро. Данная закономерность нашла подтверждение в многочисленных экспериментальных исследованиях и в дальнейшем получила название закона Авогадро.
Спустя полвека после открытия, на съезде химиков в Карлсруэ признали значение этого закона и приняли его за количественную основу современной химии (стехиометрии). Закон Авогадро в точности выполняется в случае идеального газа. Точность расчетов повышается с увеличением степени разреженности газообразного вещества.
Впервые количественные исследования взаимодействия газов между собой провел французский ученый Гей-Люссак. Ученому принадлежит авторство законов о тепловом расширении газов и закона объемных отношений. Теоретическое объяснение данных постулатов было представлено в 1811 году итальянским физиком Амедео Авогадро.
Интересным является тот факт, что при жизни открытие Авогадро осталось незамеченным по причине критических отзывов со стороны авторитетных химиков той эпохи — Йенса Якоба Берцелиуса и Джона Дальтона, которые утверждали, что возможность существования двухатомных молекул простых веществ отсутствует. Лишь в 1858 году труды Авогадро были по случайному стечению обстоятельств обнаружены итальянским химиком Станислао Канниццаро и обнародованы в 1860 году на Первом международном химическом конгрессе в Карлсруэ (Германия).
Формулировка закона, основная формула
Закон Авогадро: в равных объемах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул.
В химии можно встретить другую формулировку, которая следует из закона: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,4 л.
Нормальные условия предполагают температурный режим в 273,15 К (0 °C). Давление при этом составляет 1 атм.
В формулировке закона речь идет о равных объемах. При наличии, к примеру, 1 м³ кислорода и 2 м³ азота соотношение Авогадро выполняться не будет. Закон выполняется точно в случае сравнения идеальных газов. Чем сильнее газ отличается от идеального, тем больше отклонение от закона Авогадро.
Идеальными называют газы, частицы которых не взаимодействуют, а их размеры пренебрежимо малы.
Для выполнения закона давление и температура должны быть одинаковы. В противном случае — при разных температурах и давлениях — плотности газов будет отличаться и равенство выполняться не будет.
Пусть температура и давление газа постоянны T=const, p=const, объем не меняется V=const, тогда N — число частиц (молекул) любого идеального газа, является величиной неизменной. Данное утверждение является формулировкой закона Авогадро.
В равных объемах газов V при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул. Предпосылкой к открытию закона стало правило кратных отношений: при одинаковых условиях объемы газов, которые взаимодействуют между собой, находятся в простых соотношениях, к примеру, 1:1, 1:2, 1:3.
Закон объемных отношений: объемы газов, которые участвуют в химической реакции, при одинаковых условиях (температуре и давлении) относятся друг к другу, как простые целые числа.
В качестве примера можно привести следующие реакции:
- 1 л хлора соединяется с 1 л водорода, что приводит к образованию 2 л хлороводорода;
- 2 л оксида серы (IV) при соединении с 1 л кислорода образует 2 л оксида серы (VI).
Реальные газообразные системы в распространенных случаях представляют собой смесь чистых газов, в том числе, кислорода, водорода, азота, гелия и других. К примеру, в состав воздуха входят (в % по объему):
- 77 % азота;
- 21 % кислорода;
- 1 % водорода;
- инертные и прочие газы.
Каждый из перечисленных газов оказывает давление на стенки сосуда, в котором он заключен. Исходя из этого, можно ввести еще одно важное определение.
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
- p = 760 мм рт. ст. или 101 325 Па;
- t = 0 °С или 273 К.
Закон Авогадро, с другой стороны, является следствием основного уравнения молекулярно-кинетической теории:
С учетом концентрации:
Последняя запись позволяет сделать вывод о количестве молекул газа:
Таким образом, можно заключить, что при одинаковых условиях (одинаковых давлении и температуре) в равных объемах различных газов число молекул будет одинаковым.
Первое и второе следствия из закона Авогадро
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
В частности, при нормальных условиях объем одного моля идеального газа равен 22,4 л. Данную величину называют молярным объемом V μ .
где V μ — является молярным объемом газообразного вещества (размерность л/моль);
V — объем вещества системы;
n — определяет количество вещества системы.
Можно записать следующее справедливое равенство:
V μ газа (н.у.) = 22,4 л/моль.
Второе следствие из закона Авогадро: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов.
Величина, описанная во втором следствии закона Авогадро, то есть отношение масс одинаковых объемов двух газов, является относительной плотностью D.
D = m 1 m 2 = μ 1 μ 2
где μ 1 и μ 2 — молярные массы двух газов.
Параметр D рассчитывается по результатам экспериментальных опытов как отношение масс одинаковых объемов рассматриваемого газообразного вещества m 1 и эталонного газа, молекулярная масса которого известна ( m 2 ). В зависимости от величины D и μ 2 определяют молярную массу исследуемого газа:
Относительную плотность в распространенных случаях определяют по отношению к воздуху или водороду, зная, что молярные массы водорода и воздуха известны и равны, соответственно:
μ H 2 = 2 · 10 — 3 к г м о л ь
μ v o z d = 29 · 10 — 3 к г м о л ь
В процессе решения многих задач используют тот факт, что при нормальных условиях (н.у.) (давлении в одну атмосферу или p = 10 5 П а = 760 м м р т . с т , t = 0 o C ) молярный объем любого идеального газа:
R T p = V μ = 22 , 4 · 10 — 3 м 3 м о л ь = 22 , 4 л м о л ь
Концентрация молекул идеального газа при нормальных условиях:
n L = N A V μ = 2 , 686754 · 10 25 м — 3
Данная величина носит название числа Лошмидта.
Особенности применения, примеры решения задач
Простейший анализ одно ( С Н 2 ) n го из углеводородов, который провел А. М. Бутлеров, демонстрирует отношение количественного содержания атомов углерода и водорода, равное 1 к 2. В связи с этим, его относительный состав допустимо записать, как формулу С Н 2 или C 2 H 4 , C 4 H 8 и в общем виде ( С Н 2 ) n . Молекулярная масса данного углеводорода рассчитывается согласно закону Авогадро.
При этом учитывается плотность его пара, которая в 5,85 раз превышает плотность воздуха. Таким образом, молекулярная масса рассматриваемого вещества равна:
ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м.
Формуле C 11 H 22 отвечает молекулярная масса 154 а.е.м., формуле C 12 H 24 — 168 а.е.м., а C 13 H 26 — 182 а.е.м. Молекулярная масса C 12 H 24 (циклододекана) приближена к наблюдаемой величине. По этой причине формула, выражающая состав молекулы рассматриваемого углеводорода, — C 12 H 24 .
Газообразные вещества, молярная масса которых меньше 29, легче, чем воздух. В том случае, когда молекулярная масса газа больше 29, вещество тяжелее воздуха.
В задачах по химии можно встретить заданные относительные плотности неизвестного газа по азоту, кислороду и другим газам. Тогда, чтобы найти молярную массу неизвестного газообразного вещества, следует умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро нашел широкое применение в расчетах в химии. В связи с тем, что для газов объемы пропорциональны количествам (моль) веществ, коэффициенты в уравнении реакции между газообразными веществами, которые отражают количественное соотношение реагирующих веществ, пропорциональны объемам взаимодействующих газов. Измерения объемов проводят при одинаковых условиях.
Имеется газообразное вещество с относительной плотностью по водороду, равной 8. Нужно найти молярную массу этого газа.
М ( Х ) = М ( Н 2 ) ∙ D = 2 ∙ 8 = 16 г/моль
Газ с соответствующей молярной массой является метаном C H 4
Некий газообразный углеводород обладает относительной плотностью по воздуху, равной 2. Требуется рассчитать молярную массу этого углеводорода.
Средняя молярная масса воздуха составляет 29 г/моль
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль
Углеводородом с полученной молярной массой является бутан С 4 Н 10 .
Необходимо вычислить объем кислорода, который нужен, чтобы сжечь 2 дм³ пропана. Измерения объемов проводились при нормальных условиях.
Следует записать уравнение химической реакции:
С 3 Н 8 + 5 О 2 → 3 С О 2 + 4 Н 2 О
Согласно закону Авогадро, одинаковые объемы различных газов содержат равное количество (моль) веществ. Предположим, что объем пропана равен 1 дм 3 . В таком случае, по записанному уравнению реакции, чтобы сжечь 1 дм 3 пропана необходимо взять 5 дм 3 кислорода. В результате для сжигания 2 дм 3 пропана нужно:
1 дм 3 С 3 Н 8 — 5 дм 3 O 2
2 дм 3 С 3 Н 8 — 10 дм 3 O 2
Ответ: V ( О 2 ) = 10 дм 3
Требуется вычислить объем, занимаемый 0,5 моль C l 2 при нормальных условиях, и объем, который займут 142 гр хлора при нормальных условиях.
Согласно закону Авогадро один моль какого-либо газообразного вещества при н.у. занимает: V μ = 22 , 4 · 10 — 3 м 3 м о л ь
V C l 2 = ν · V μ
По условиям задачи величины представлены в СИ, поэтому можно выполнить расчеты:
V C l 2 = 0 , 5 · 22 , 4 · 10 — 3 = 11 , 2 · 10 — 3 ( м 3 )
Вторая часть задания решается с помощью уравнения для количества вещества:
Определить молярную массу хлора можно по таблице Менделеева:
μ C l 2 = 71 · 10 — 3 к г м о л ь
Путем подстановки первого выражения во второе, получим:
V C l 2 = m μ V μ
Зная, что m = 142 гр = 140 · 10 — 3 кг, запишем:
V C l 2 = 140 · 10 — 3 71 · 10 — 3 · 22 , 4 · 10 — 3 = 44 , 8 · 10 — 3 ( м 3 )
Ответ: Объем 0,5 молей хлора займут объем 11,2 л. Объем 142 гр хлора — 44,8 л.
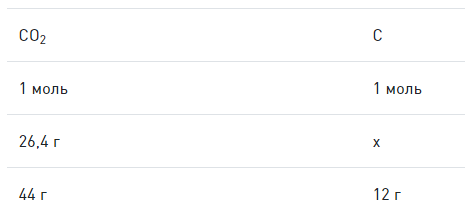
Дано 13,8 грамма вещества, которые сгорают полностью. По итогам химической реакции горения получается 26,4 г C O 2 и 16,2 г H 2 O . Величина относительной плотности паров искомого газа по водороду равна 23. Необходимо записать молекулярную формулу вещества
Известно, что μ H 2 = 2 г м о л ь . Тогда молекулярная масса искомого вещества составит:
D = m 1 m 2 = μ x μ H 2 → μ x = 23 · 2 = 46 г м о л ь
Далее необходимо вычислить массу углерода путем составления пропорции:
m C = x = 26 , 4 · 12 44 = 7 , 2 ( г р . )
Аналогичным способом можно определить массу водорода:
m H = 16 , 2 · 2 18 = 1 , 8 ( г р . )
Согласно закону сохранения массы, масса кислорода составит:
m O = 13 , 8 — 7 , 2 — 1 , 8 = 4 , 8 г р
Далее нужно определить количество молей атомов элементов:
ν C = 7 , 2 12 = 0 , 6 м о л ь ν Н = 1 , 8 1 = 1 , 8 м о л ь ν O = 4 , 8 16 = 0 , 3 м о л ь
Согласно закону отношений:
ν C : ν Н : ν O = 0 , 6 : 1 , 8 : 0 , 3
После деления чисел из последнего выражения на 0,3, получим:
Таким образом, получается простейшая формула:
μ C 2 H 6 O = 24 + 6 + 16 = 46 г м о л ь
Рассчитанная молярная масса также 46 г м о л ь , следовательно, простейшая и истинная формулы искомого вещества совпадают.
Ответ: формула сгоревшего вещества C 2 H 6 O .
Необходимо вычислить, какой объем занимает 0,2 моль N 2 при нормальных условиях.
ν ( N 2 ) = 0,2 моль
ν ( N 2 ) = V ( N 2 ) / V m
V ( N 2 ) = ν ( N 2 ) · V m = 0,2 моль · 22,4 л / моль = 4,48 л
Нужно определить объем, занимаемый 56 г газа СО при н.у.
ν ( C O ) = V ( C O ) / V m
V ( C O ) = ν ( C O ) · V m
Неизвестное количество вещества можно рассчитать по формуле:
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
ν (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO ) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Требуется рассчитать объем, занимаемый 8 г газа O 2 при нормальных условиях.
В первую очередь следует определить количество молей в заданной массе кислорода:
Объем газа составит:
V = ν V μ = m μ V μ
Молярная масса кислорода O 2 :
μ = 2 · 16 · 10 — 3 = 32 · 10 — 3 k g / m o l
V μ = 22 , 4 l / m o l = 2 , 24 · 10 — 2 m 3 / m o l
Таким образом, можно определить:
V = 8 · 10 — 3 32 · 10 — 3 · 2 , 24 · 10 — 2 = 5 , 6 · 10 — 3 m 3 = 5 , 6 л
Газообразное вещество массой 1 г при нормальных условиях занимает объем 1,32 л. Необходимо вычислить, какова относительная плотность этого газа по хлору.
Количество вещества данного газа составляет:
Можно записать другую формулу для расчета количества вещества:
В результате, правые части уравнений допустимо приравнять и определить молярную массу газа:
Относительная плотность газа по хлору:
D = μ μ C l = m V μ μ C l V
V μ = 22 , 4 л / m o l = 2 , 24 · 10 — 2 m 3 / m o l
Молярная масса хлора:
μ C l 2 = 2 · 35 , 5 · 10 — 3 = 7 , 1 · 10 — 2 k g / m o l
После перевода единиц в систему СИ получим:
масса газа m = 1 g = 10 — 3 кг,
объем газа V = 1 , 32 l = 1 , 32 · 10 — 3 m 3
Далее можно рассчитать относительную плотность:
D = 10 — 3 · 2 , 24 · 10 — 2 7 , 1 · 10 — 2 · 1 , 32 · 10 — 3 = 0 , 24
Нужно вычислить объем, в котором содержится 12 , 04 · 10 23 молекул углекислого газа при нормальных условиях.
Один моль вещества содержит число Авогадро молекул:
N A = 6 , 02 · 10 23 m o l — 1
Количество молей углекислого газа:
Объем, который занимает газообразное вещество, составит:
V = ν V μ = N N A V μ
V μ = 22 , 4 l / m o l = 2 , 24 · 10 — 2 m 3 / m o l
V = 12 , 04 · 10 23 6 , 02 · 10 23 · 2 , 24 · 10 — 2 = 4 , 68 · 10 — 2 m 3 = 46 , 8 л
Требуется рассчитать количество молекул, которое содержится в 60 г фтористого водорода HF. Нужно определить объем газообразного фтора F 2 , который при нормальных условиях содержит аналогичное число молекул.
Количество молекул, содержащееся в массе m вещества, можно найти с помощью следующего отношения:
N = ν N A = m μ N A
Молярная масса фтористого водорода:
μ = 1 + 19 · 10 — 3 = 2 · 10 — 2 k g / m o l
N A = 6 , 02 · 10 23 m o l — 1
После перевода в СИ, получим, что масса фтористого водорода:
m = 60 г = 6 · 10 — 2 кг
N = 6 · 10 — 2 2 · 10 — 2 · 6 , 02 · 10 23 = 1 , 81 · 10 24
Объем, который занимает газообразный фтор с аналогичным количеством молекул, равен:
V = ν V μ = N N A V μ
V μ = 22 , 4 l / m o l = 2 , 24 · 10 — 2 m 3 / m o l
V = 1 , 81 · 10 24 6 , 02 · 10 23 · 2 , 24 · 10 — 2 = 6 , 72 · 10 — 2 m 3 = 67 , 2 л
Урок №40. Закон Авогадро. Молярный объем газов
итальянский учёный-химик, первооткрыватель фундаментального физико-химического закона, названного его именем.
Закон Авогадро : в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро :
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 10 23 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается V m
Молярный объём V m – это постоянная величина для веществ – газов при нормальных условиях (н.у.) V m = 22,4 л/моль
Нормальными условиями (н.у.) для газов считаются:
P 0 = 1 атм. = 101325 Па = 760 мм. рт. ст.
T 0 = 273,15 К = 0°С
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
ν = V/V m = N/N a = m/M
M = ρ‧V m
http://wika.tutoronline.ru/himiya/class/8/formulirovka-i-opredelenie-zakona-avogadro
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-40-%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD-%D0%B0%D0%B2%D0%BE%D0%B3%D0%B0%D0%B4%D1%80%D0%BE-%D0%BC%D0%BE%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B9-%D0%BE%D0%B1%D1%8A%D0%B5%D0%BC-%D0%B3%D0%B0%D0%B7%D0%BE%D0%B2