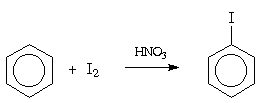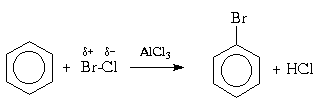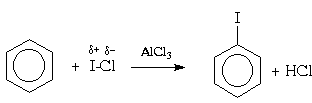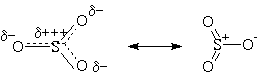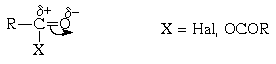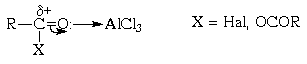Бензольные реакции — галогенирование, нитрование и сульфирование бензола
Бензол — бесцветная жидкость, которая была впервые обнаружена Майклом Фарадеем в 1825 году. Молекулярная формула бензола — C 6 H 6 . Из молекулярной формулы видно, что органическое соединение сильно ненасыщено. Из-за высокой степени ненасыщенности он очень реакционноспособен. В отличие от алкенов, он никогда не участвует в реакциях присоединения, окисления и восстановления. Например, бензол не будет реагировать с Br, HCl или другими реагентами, приводя к образованию двойных связей углерод-углерод. В большей части своей реакции бензол подвергается реакции замещения, при которой один или несколько атомов водорода заменяются другим атомом или радикалом.
Бензол относится к категории ароматических соединений. Фактически, термин «ароматический» был предварительно использован для описания бензола и его производных из-за его разнообразного аромата или запаха. Позже классификация бензола была сделана на основе их структуры и химической активности, а не на основе их аромата. Итак, теперь термин ароматические соединения используется для классификации тех соединений, которые являются чрезвычайно ненасыщенными и особенно стабильными по отношению к реагентам, которые активно взаимодействуют с алкенами.
В настоящее время термин арен используется для обозначения ароматических углеводородов по аналогии с алканом и алкеном. Бензол считается исходным ареном. Подобные соединения алкильной группы обозначаются символом RJ, аналогично, если один водород удаляется из арена, тогда комбинация арильной группы с новым атомом или группой обозначается как ArJ.
Структура бензола
Реакции замещения являются характерными реакциями бензола и почти не подвергаются реакции присоединения. Бензол обрабатывают бромом в присутствии хлорида железа в качестве катализатора, после чего образуется соединение, называемое бромбензолом, и это соединение, полученное из этого продукта. Реакция следующая:
Таким образом, из реакций вышеупомянутого типа был сделан вывод, что все шесть атомов углерода и все шесть атомов водорода в бензоле должны быть эквивалентны. Точно так же, если бромбензол обрабатывают бромом с хлоридом железа в качестве катализатора, образуются три изомерных дибромбензола:
Но в течение этих лет химики не были уверены в структуре бензола и в том, как эта структура может повлиять на химическую активность. Только в 1930-х годах химики постепенно пришли к общему пониманию уникальной структуры и химических свойств бензола и его производных.
Различные химические реакции бензола
Галогенирование бензола
Посредством реакции электрофильного ароматического замещения один атом водорода арена замещается одним атомом галогена. Вышеупомянутые реакции относятся к категории реакций галогенирования. Здесь мы попытаемся разобраться в механизме реакции. Эту реакцию проводят в присутствии катализатора кислоты Льюиса. Кислота Льюиса — не что иное, как акцептор электронной пары, а электроны по существу не связывают.
Нитрование бензола.
В реакции нитрования бензола бензол обрабатывают смесью концентрированной азотной кислоты и концентрированной серной кислоты при температуре не выше 50 ° C. С повышением температуры увеличивается вероятность образования более одной нитрогруппы, -NO₂, которая замещается на кольце и приводит к образованию нитробензола. Концентрированная серная кислота действует как катализатор в этой реакции. «Ион нитрония» или «катион нитрила», NO + 2, здесь является электрофилом. Это происходит в результате реакции между азотной кислотой и серной кислотой.
Сульфирование бензола
Сульфирование бензола включает реакцию электрофильного замещения, которая происходит между бензолом и серной кислотой. Есть два эквивалентных способа сульфирования бензола:
Первый способ включает нагрев бензола с обратным холодильником концентрированной дымящей серной кислоты в течение нескольких часов при 40 ° C. Образующийся продукт представляет собой бензолсульфоновую кислоту. Электрофилом здесь является триоксид серы, SO₃. Электрофил на основе триоксида серы может быть получен одним из двух способов в зависимости от того, какой вид кислоты используется. Его можно получить при небольшой диссоциации концентрированной серной кислоты, содержащей следы SO₃.
Дымящаяся серная кислота, H₂S₂O₇, может рассматриваться как раствор SO₃ в серной кислоте, и, таким образом, это гораздо более богатый источник SO₃. Триоксид серы является электрофильным по своей природе, потому что это высокополярная молекула с изрядным количеством положительного заряда на атоме серы. Именно это привлекает кольцевые электроны. Происходящая реакция может быть представлена как:
Алкилирование и ацилирование бензола.
Эта реакция широко известна как реакция Фриделя-Крафтса. Реакционная способность галогеналканов постепенно увеличивается по мере продвижения вверх по таблице Менделеева, а также увеличивается полярность. Это означает, что реакционная способность галогеналкана RF максимальна, за ней следует реактивность RCl, затем RBr и, наконец, RI. Это означает, что кислоты Льюиса, используемые в качестве катализаторов в реакциях алкилирования Фриделя-Крафтса, имеют тенденцию иметь аналогичные комбинации галогенов, такие как BF3, SbCl2, AlCl4, SbCl2 и AlBr2, которые обычно используются в этих реакциях.
В 1877 году для получения алкилгалогенида использовалась описанная ниже процедура, но она сопровождалась нежелательной дополнительной активностью, которая снижала ее эффективность.
В качестве средства устранения этих ограничений была разработана новая улучшенная реакция: ацилирование Фриделя-Крафтса, также известное как алканоилирование Фриделя-Крафтса.
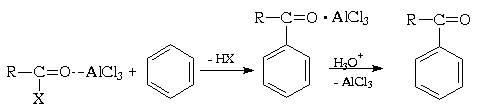
Самый первый шаг начинается с образования иона ацилия, который вступает в реакцию с бензолом на последующей стадии. Второй шаг касается атаки иона ацилия на бензол как нового электрофила, что приводит к одной сложной структуре. Третий шаг включает удаление протона, чтобы гарантировать, что ароматичность вернется к бензолу. На третьем этапе AlCl₄ возвращается, чтобы удалить протон из бензольного кольца, тем самым позволяя кольцу вернуться к своей ароматичности. При этом исходный AlCl2 регенерируется для повторного использования вместе с HCl. Кетон образуется как первый конечный продукт реакции. Эта первая часть продукта является сложной с хлоридом алюминия. Заключительный этап включает добавление воды для высвобождения конечного продукта в виде ацилбензола:
Поскольку ион ацилия (как было показано на первом этапе) стабилизируется из-за резонанса, перегруппировка здесь не происходит (ограничение этой реакции). Кроме того, из-за дезактивации продукта он больше не подвержен электрофильным атакам и, следовательно, больше не будут инициироваться дальнейшие реакции (еще одно ограничение). Однако ацилирование Фриделя-Крафтса может потерпеть неудачу из-за сильных дезактивирующих колец.
Но у этого алкилирования есть пара недостатков. К этим недостаткам можно отнести:
- Есть шансы на перестановки
- Нельзя также игнорировать вероятность многократного добавления
- Это не применимо к бензолам с несколькими электроноакцепторными группами.
Чтобы решить эти проблемы, было введено ацилирование Friedel Craft. Этот метод ацилирования решает первые две проблемы.
Нуклеофильное ароматическое замещение.
Нуклеофильное ароматическое замещение включает реакцию замещения, при которой нуклеофил перемещает сильную уходящую группу, такую как галогенид, на ароматическое кольцо. Эта реакция в основном происходит по одному из двух механизмов:
а) реакция присоединения-элиминирования или
б) Реакция элиминирования-присоединения
Основной принцип этой реакции может быть сформулирован в виде, когда замещенные атомы H «уходят» в виде протона, а формально электроны в связи CH «остаются позади», и существует необходимость завершить связывание с помощью электронодефицитный электрофил.
Когда нуклеофил заменяет водород, не может произвести замену, поскольку предполагается, что электроны также «уходят» (нуклеофил приносит свои собственные электроны в форме гидрид-аниона H-), возникает потребность в более уходящей группе. которые могут «забирать» электроны, нуждаются в обычной уходящей группе, такой как галогенид. Электроны — очень плохие уходящие группы.
Бензильное положение и его влияние на реакционную способность бензола
Ароматичность бензола обуславливает его устойчивость ко многим реакциям, в которых обычно могут принимать участие алкены. Однако химики нашли способы реагировать на бензол, следуя различным другим методикам. Мы начнем обсуждение бензольных реакций с процессов, которые происходят не непосредственно в кольце, а на атоме углерода, непосредственно связанном с бензольным кольцом, точнее называемом бензольным углеродом.
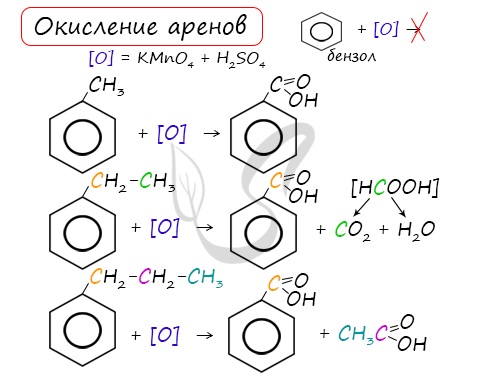
Сильные окислители, такие как H₂CrO₄ и KMnO₄, не могут даже повлиять на бензол. Когда толуол обрабатывают этими окислителями в экстремальных условиях, метильная группа боковой цепи окисляется до карбоксильной группы с образованием основного побочного продукта бензойной кислоты.
Окисление метильной группы, сохраняющее ароматическое кольцо незатронутым, делает очевидным, что ароматическое кольцо чрезвычайно стабильно. Галоген и нитрозаместители в ароматическом кольце даже остаются незатронутыми этими окислениями. Например, хромовая кислота окисляет 2-хлор-4-нитротолуол с образованием 2-хлор-4-нитробензойной кислоты. Но и здесь нитро- и хлор-группы остаются неизменными.
Эти условия также позволяют окислять этилбензол и изопропилбензол до бензойной кислоты. Опять же, боковая цепь трет-бутилбензола, лишенная бензилового водорода, не подвержена влиянию этих окислительных условий.
Если бензиловый водород существует, то бензильный углерод окисляется до карбоксильной группы, и происходит удаление всех других углеродов боковой цепи. Если бензиловый водород отсутствует, как в случае трет-бутилбензола, окисление боковой цепи также не происходит.
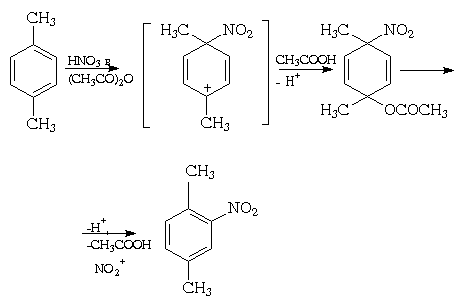
Что образуется при реакции нитрования бензола напишите уравнение
Реакция нитрования является одной из наиболее изученных реакций ароматического замещения. Для препаративных целей нитрование, как правило, проводят смесью концентрированных азотной и серной кислот, так называемой нитрующей смесью . На первой стадии реакции происходит образование иона нитрония + NO2, который и является электрофильным агентом:
HO-NO2 + H2SO4 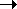
H2O + -NO2 + H2SO4 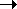
Наличие иона нитрония в этом растворе подтверждено спектроскопически. Азотная кислота в концентрированной серной кислоте практически нацело превращается в нитроний-катион. Незначительная эффективность самой азотной кислоты в реакции нитрования бензола объясняется низким содержанием иона + NO2.
B качестве нитрующих агентов используются также другие системы, в которых генерируется либо катион + NO2, либо соединение общей формулы NO2-Y где Y — хорошая уходящая группа. Некоторые из таких систем, нашедшие наибольшее применение, представлены в таблице 1 в порядке увеличения их активности.
Таблица 1. Нитрующие реагенты.
| Нитрующий реагент | Метод генерации | Арены, подвергающиеся нитрованию |
| Азотная кислота HO-NO2 | Фенолы, эфиры фенолов, бифенил | |
| Ацетилнитрат CH3C(O)-O-NO2 | СН3СООН + HNO3 (СН3СО)2О + HNO3 | Бензол, алкилбензолы |
| Диоксид азота N2O4 (O=N-O-NO2) | Бензол, алкилбензолы | |
| Нитрующая смесь | H2SO4 конц + HNO3 | Бензол, алкилбензолы, галогенбензолы, бензойная кислота, нитробензол, нафталин |
| Хлорид нитрония Сl-NO2 | Бензол, алкилбензолы, нитробензол, | |
| Тетрафторборат нитрония BF4 -+ NO2 | HF . 2BF3 + HNO3 | Динитробензол |
На примере реакции нитрования алкилбензолов отчетливо прослеживается влияние пространственных факторов на направление электрофильного замещения. Так, при нитровании толуола (метилбензола) орто-изомер образуется в качестве основного продукта, а при переходе к этил-, изо-пропил- и особенно к трет-бутил-бензолу его выход существенно уменьшается (см. табл. 2).
Таблица 2. Влияние пространственых факторов на соотношение орто-, пара-изомеров в реакции нитрования (NO2 + )
С6H5-R
Замещение в положения, %
C6H5-CH3
C6H5-C2H5
C6H5-CH(CH3)2
C6H5-C(CH3)3
При изучении нитрования алкилбензолов было обнаружено так называемое ипсо-замещение , когда электрофильная атака протекает по тому атому углерода бензольного кольца, которое уже содержит заместитель, например:
Ипсо-атака обычно имеет место при несогласованной ориентации заместителей первого рода (особенно, находящихся в пара-положении). Она имеет место для практически всех алкилбензолов, а также галоген- и алкоксиалкилбензолов с подобным расположением заместителей.
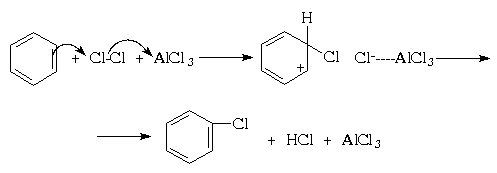
В отличие от нитрования, при галогенировании атака ароматического субстрата может осуществляться различными электрофилами. Свободные галогены, например, Cl2 и Br2,(прим.35) могут легко атаковать активированное ароматическое ядро (например, фенола), но не способны реагировать с бензолами и алкилбензолами (фотохимическая активация может, однако, в последнем случае привести к протеканию радикального замещения в боковую цепь; см. раздел IV.3). Для поляризации атакующей молекулы галогена необходим катализ кислотами Льюиса, такими как AlCl3, FeBr3, и т.п.; при этом в молекуле галогена появляется так называемый «электрофильный конец» (энергия же, требующаяся для образования катиона Наl + существенно выше). Тем самым электрофильное замещение существенно облегчается:
Галогенирование протекает очень энергично, если использовать реагенты, в которых галоген в результате поляризации имеет сильный положительный заряд или даже существует как катион. Так, очень инертный мета-динитробензол можно пробромировать бромом в концентрированной серной кислоте в присутствии сульфата серебра. Предполагают, что в этом случае промежуточно образуется бром-катион:
2Br2 + Ag2SO4 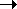
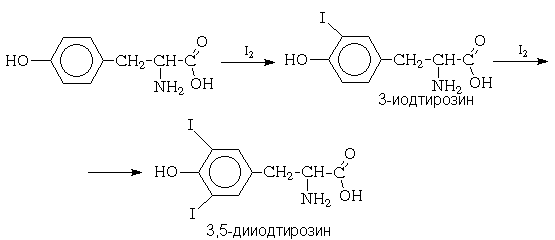
Реакционная способность элементарного иода в реакциях электрофильного замещения в ароматическом ядре незначительна, так что прямое иодирование возможно только в случае фенола и ароматических аминов. Иодирование других ароматических соединений проводят в присутствии окислителя (обычно, азотной кислоты). Считается, что в этих условиях роль электрофильного агента играет ион I- + OH2.
Для галогенирования аренов можно применять также смешанные галогены, например, монохлорид брома (BrCl) или иода (ICl):
Галогенирование in vivo. В качестве примера электрофильного ароматического галогенирования, протекающего в живых организмах, можно привести реакцию иодирования 
Детали механизма сульфирования исследованы менее подробно по сравнению с нитрованием и галогенированием. Сам бензол сульфируется довольно медленно горячей концентрированной серной кислотой, но быстро — олеумом, SO3 в инертных растворителях или комплексом SO3 с пиридином. Природа электрофильной частицы зависит от условий реакции, но, вероятно, это всегда SO3, или в свободном состоянии, или связанный с «носителем», например, в виде H2SO4 . SO3 (H2S2O7) в серной кислоте. Небольшие количества SO3 образуются в H2SO4:
2H2SO4 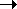
Атаку ароматического субстрата осуществляет атом серы поскольку он сильно положительно поляризован, то есть электронодефицитен:
Сульфирование является обратимым процессом. Это имеет практическое значение: при обработке сульфокислот водяным паром происходит замещение группы SO3Н на водород. Таким образом, можно ввести группу SO3Н как заместитель, ориентирующий требуемым образом последующие реакции (см. раздел IV.1.Б), а затем ее отщепить. Некоторые интересные особенности имеет сульфирование нафталина (см. раздел IV.1.Г).
Подобно галогенам, алкилгалогениды могут быть так сильно поляризованы кислотами Льюиса (хлоридами алюминия и цинка, трифторидом бора и др.), что они становятся способными к электрофильному замещению в ароматическом ядре:
R-Cl + AlCl3 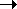
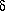
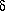
R + AlCl4 — + ArH 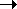
Кроме алкилгалогенидов, источниками карбокатионов для галогенирования ароматических соединений могут быть алкены или спирты. При этом необходимо присутствие протонной кислоты, чтобы протонировать алкен или спирт. В случае спиртов требуется добавка не менее чем эквимольного количества кислоты (так как вода, выделяющаяся в ходе реакции, дезактивирует эквимольное количество катализатора), тогда как в реакциях с участием алкилгалогенидов и алкенов достаточно добавлять незначительное количество катализатора.
В лаборатории алкилирование по Фриделю-Крафтсу имеет ограниченное применение, так как обычно при этой реакции образуются смеси продуктов, что обусловлено рядом причин:
1) Образующийся продукт алкилирования легче вступает в реакции электрофильного ароматического замещения, чем исходное соединение (Alk — электронодонорная группа), поэтому дальше преимущественно алкилируется продукт. Если хотят получить продукты моноалкилирования, то необходимо брать большой избыток ароматического соединения.
2) Как и сульфирование, реакция алкилирования по Фриделю-Крафтсу обратима (см. также раздел IV.1.Г).
3) Даже в мягких условиях первичные и вторичные алкилгалогениды дают преимущественно вторичные или третичные алкиларены соответственно, поскольку алкилирование происходит в условиях, приближающихся к SN1 реакции.(прим.37) Перегруппировки можно избежать, если работать при низких температурах.
Ацилирование ароматических соединений по Фриделю-Крафтсу является важнейшим методом синтеза жирноароматических кетонов. Производные карбоновых кислот, такие как ацилгалогениды и ангидриды, имеют полярную карбонильную группу и в принципе способны к электрофильному замещению в ароматических системах:
Электрофильная активность этих соединений, однако, невелика, и должна быть повышена действием кислот Льюиса. При этом кислотный катализатор, как правило, атакует атом кислорода карбонильного соединения и, смещая электронную плотность, повышает положительный заряд соседнего атома углерода. В результате образуется поляризованный комплекс (а в пределе — ацилкатион), действующий как электрофил:
Важное отличие реакции ацилирования ацилгалогенидами от реакции алкилирования алкилгалогенидами состоит в том, что в первой из этих реакций требуется более 1 моль кислоты Льюиса, тогда как во второй необходимо только каталитические количество. Это обусловлено тем, что кислота Льюиса образует комплекс как с ацилирующим производным карбоновой кислоты, так и с кетоном — продуктом реакции. При взаимодействии с ангидридами получающаяся кислота связывает еще моль моль катализатора, так что в целом его необходимо по крайней мере два моль. В каждом случае по окончании реакции образовавшийся комплекс кетона с хлоридом алюминия (или другой кислотой Льюиса) должен быть гидролитически разрушен (соляной кислотой со льдом).
Полиацилирования не наблюдается, поскольку образующийся кетон значительно менее реакционноспособен, чем исходное соединение (см. раздел IV.1.Б). Поэтому алкилбензолы часто предпочитают получать не прямым алкилированием, а ацилированием по Фриделю-Крафтсу с последующим восстановлением. Ароматические соединения с сильнодезактивирующими заместителями, например, нитро- или циано- группами, также не ацилируются по Фриделю-Крафтсу.
2. Изобразите диаграмму потенциальной энергии для реакции электрофильного ароматического замещения, в которой медленной стадией является образование 
см. раздел IV.1.A).
3. Какой продукт преимущственно образуется при бромировании: а)пара-нитротолуола; б) мета-нитробензолсульфокислоты; в) орто-нитрофенола.
4. Адреналин (1-(3′,4′-дигидроксифенил)-2-метиламиноэтанол)- первый гормон, выделенный из мозгового вещества надпочечников, в настоящее время синтезируюют в три стадии из пирокатехина. Напишите уравнение первой стадии этого синтеза — реакции ацилирования пирокатехина (1,2-дигидроксибензола) хлорангидридом хлоруксусной киcлоты и объясните механизм).
5. Одной их качественных реакций на белки является ксантопротеиновая реакция, указывающая на присутствие ароматических 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Бензол и его гомологи
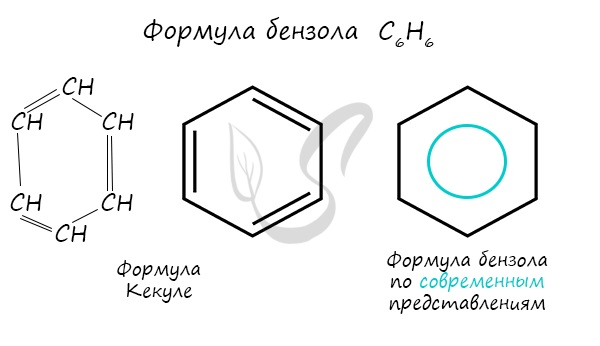
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
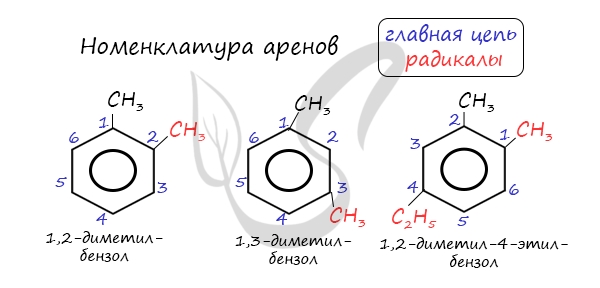
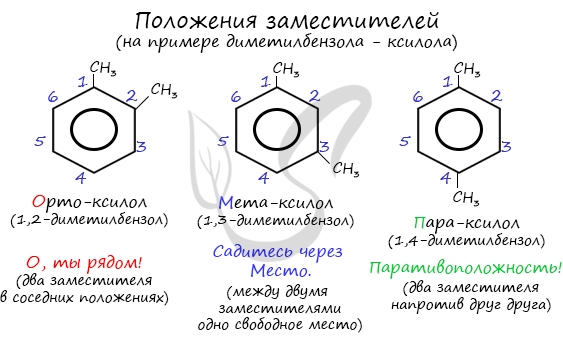
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
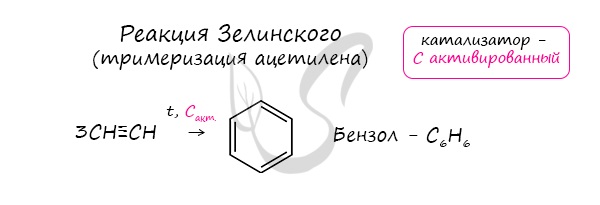
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
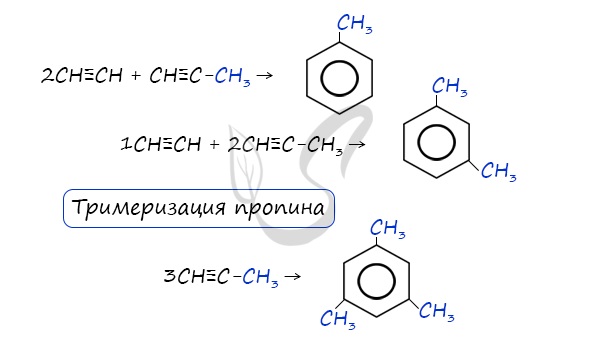
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
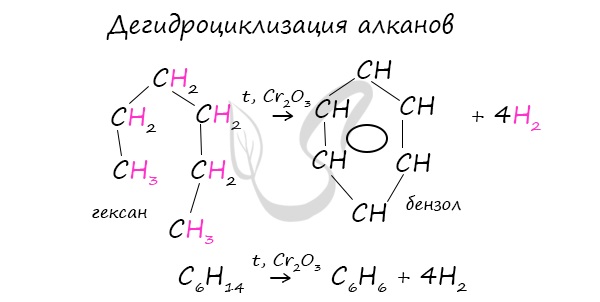
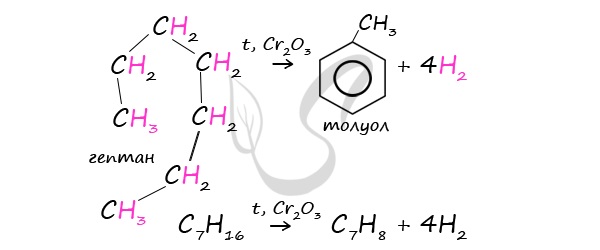
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
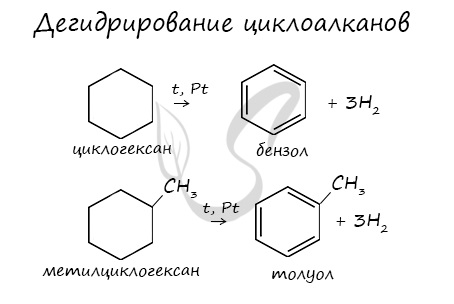
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
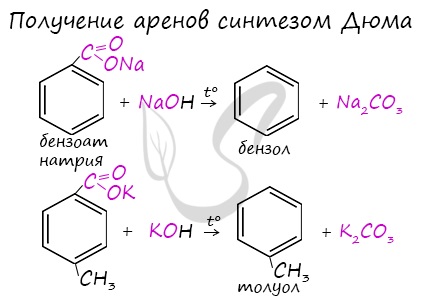
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
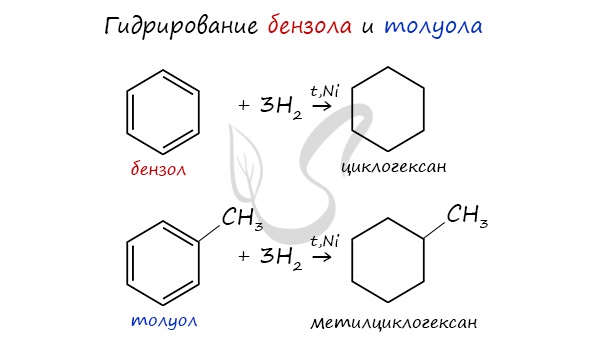
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
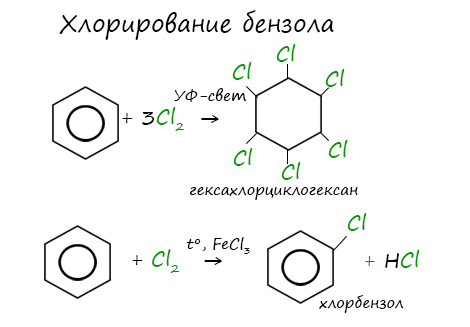
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
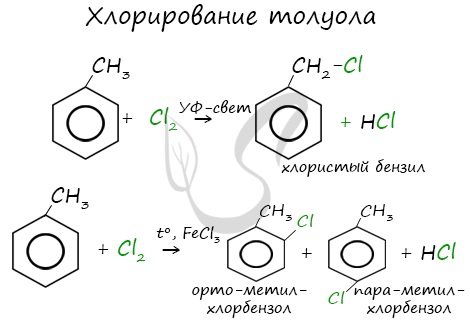
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
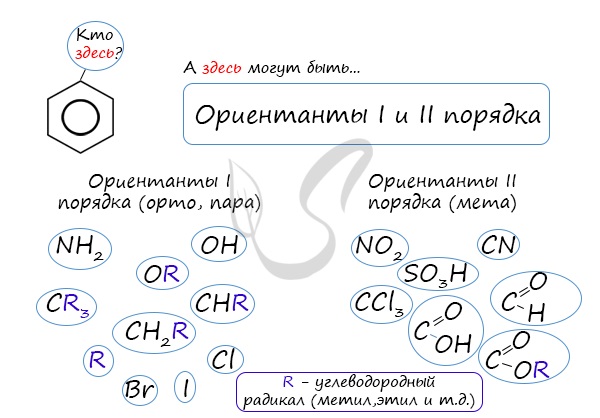
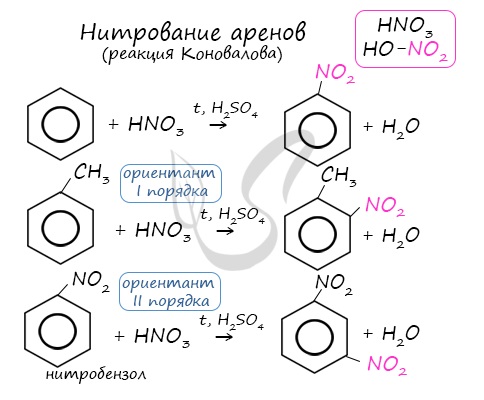
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
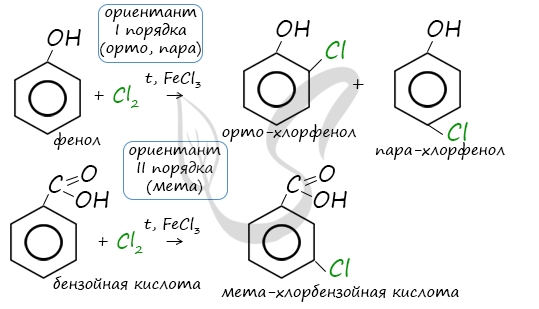
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
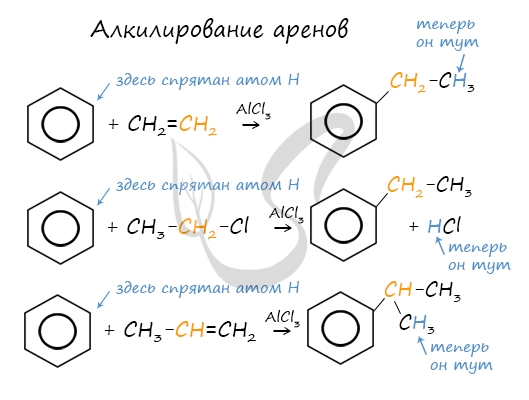
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
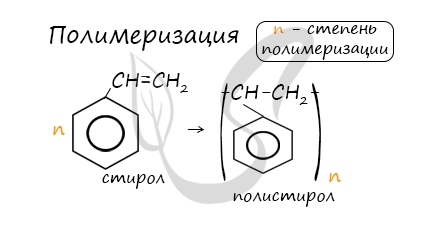
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://www.chem.msu.ru/rus/teaching/aromatic/gl4(1d).html
http://studarium.ru/article/186