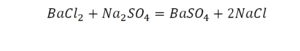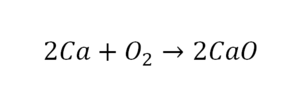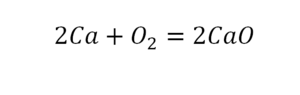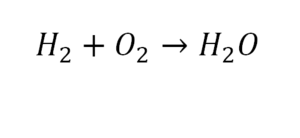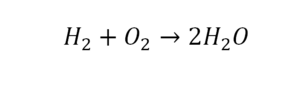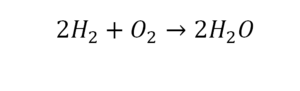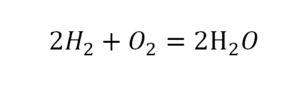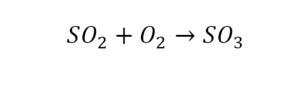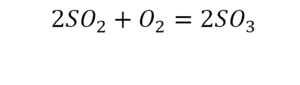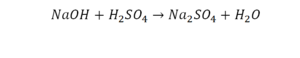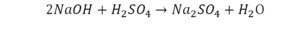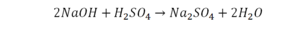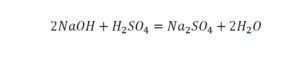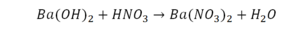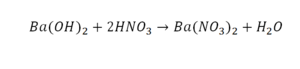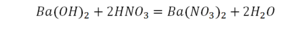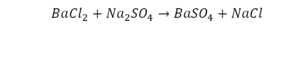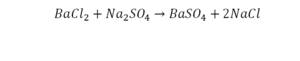Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Соломонов суд
Внеклассное мероприятие по теме
«Основные химические понятия»
Присяжные заседатели и свидетели обвинения занимают два первых ряда в зале. На сцене стулья с высокими спинками, на которых надписи «Закон», «Химия», «Оценка», скамья подсудимых, стол с реактивами и стол для демонстрации опытов.
На сцену выходит Химия.

Присяжные заседатели и свидетели обвинения встают. Входят Закон и Оценка.
Химия. Всемогущий Закон, займите место по правую руку, а вы, справедливая Оценка, – по левую.
Закон. Разрешите представить состав суда.
Присяжные заседатели: Кислота, Щелочь, Соль, Отличник.
Свидетели обвинения: Химический Знак, Индекс, Формула, Валентность, Масса, Задача.
Химия. Защитник обвиняемого – Химический Эксперимент.
Оценка. Стража, введите обвиняемого!
Закон. Обвиняемый, назовите свое имя, возраст, класс и оценку по химии.
Обвиняемый. Соломонов Федот, 15 лет, 8-й класс, оценка по химии «два».
Химия. Обвиняемый, признаете ли вы свою вину? Отвечайте «да» или «нет».
Обвиняемый. Нет!
Оценка. А какие у вас будут доказательства своей невиновности? Ведь незнание законов химии является тягчайшим преступлением.
Обвиняемый. А кому она нужна, ваша химия? Я и без законов проживу. У меня свои законы.
Закон. Это интересно. Какие же, позвольте вас спросить?
Обвиняемый.
1. Пусть дураки учатся.
2. Много будешь знать – скоро состаришься.
3. Век живи, век учись – дураком умрешь.
Химия. Да, это действительно особо опасный преступник. Придется его судить по всей строгости закона.
Закон. Приступим к выслушиванию показаний свидетелей обвинения. Сядьте, подсудимый.
Обвиняемый. Ну вот еще, тоже мне свидетели! Боюсь я их, как же! И вообще, мне все это надоело. Я домой хочу. Некогда мне с вами тут воду в ступе толочь. (Пытается уйти.)
Химия. Слово предоставляется Химическому Знаку.
Химический знак. Обвиняемый не знает химических знаков. Не умеет их правильно читать и писать.
Обвиняемый. Это неправда. Я их знаю. Хоть сейчас могу написать.
Химический знак. Ну это легко проверить. Напишите-ка мне химический знак лоуренсия.
Обвиняемый. Чего, чего? Вы не имеете права задавать такие вопросы. Я не академик, а ученик. Ну спросили бы химический знак водорода, кислорода или углерода – это еще куда ни шло. А то – лоуренсия. Да я и не слышал о нем никогда. Да вы и сами его не сможете написать.
Химия. Обвиняемый, не забывайтесь! Здесь судим мы. Еще раз спрашиваю: признаете ли вы свою вину?
Обвиняемый. Нет! Лоуренсий – это ничего не значит. Да его химический знак ни один ученик не напишет.
Химический знак. Ребята, знает ли кто-нибудь из вас химический знак лоуренсия?
Ответ из зала. Нет!
Обвиняемый. Вот видите! А я что говорил?
Химия. Неужели так никто и не напишет? А если Отличника спросить?
Отличник. Конечно, напишу.
Обвиняемый. Отличник – это не в счет. Отличников-то у нас – раз-два и обчелся.
Химический эксперимент. Правильное замечание, позволю себе заметить. Прошу данный факт истолковать в пользу обвиняемого.
Оценка. Мы все учтем, можете не беспокоиться. А ответ Соломонова оценивается двойкой.
Закон. Слово предоставляется Валентности.
Валентность. Уважаемые судьи! Обвиняемый совершенно не знает валентности – даже таких элементов, как водород и кислород.
Обвиняемый. А вот и неправда, знаю. У кислорода валентность равна единице, а у водорода – двум.
Валентность. Неправильно! Все наоборот: водород одновалентен, а кислород двухвалентен.
Обвиняемый. Подумаешь, перепутал. Подумаешь, важность какая.
Оценка. А если учитель перепутает и вместо оценки «три» поставит в журнал оценку «два»?
Обвиняемый. Такие вещи сравнивать нельзя. То валентность, а это – оценка.
Оценка. Вот я и ставлю вам за валентность оценку «два».
Обвиняемый. Зато я все остальное знаю. Вот еще увидите.
Химия. К сожалению, это невозможно. Без знания основных химических понятий нельзя научиться химии.
Закон. Слово предоставляется формуле.
Формула. Как уже было установлено следствием, Обвиняемый не знает валентности. Поэтому неудивительно, что он не умеет составлять и химические формулы. Вот его последняя контрольная работа. Вы только посмотрите, что он пишет: формула воды – НО, формула углекислого газа – СО. Глядя на эти безобразия, просто плакать хочется. Я прошу уважаемый суд приговорить обвиняемого к повторному году обучения.
Обвиняемый. А вы сначала скажите мне, что же в этих формулах неправильно?
Индекс. Индексы не проставлены. А все потому, что вы не знаете валентности элементов и правила составления формул. Формула воды – Н2О, а углекислого газа – СО2. Вы, любезный, хоть знаете, что такое индекс?
Обвиняемый. Знаю – это маленькая цифра после химического знака.
Химический эксперимент. Вот видите, господа! Кое-что он все-таки знает. Положение не совсем безнадежное. Его можно спасти.
Оценка. Отметка за ответ низшей категории сложности – «три с минусом».
Закон. Суд продолжается. Слово предоставляется Массе.
Масса. Как вам известно, господа судьи, господа присяжные заседатели, свидетели и защитник, масса атома – это… важнейшая характеристика химического элемента. Д.И.Менделеев за основу классификации химических элементов взял именно массу атома и благодаря этому открыл периодический закон.
Химия. Прошу не отвлекаться. Короче, пожалуйста. Переходите к сути дела.
Масса. Я прошу извинить меня за столь лирическое отступление. Массу химического соединения необходимо правильно находить по атомным массам при решении расчетных задач. Так вот, Соломонов Федот не знает, как правильно вычислять массу по химической формуле вещества.
Обвиняемый. Да знаю я. Что там трудного – посмотри в таблицу Д.И.Менделеева, выпиши и сложи атомные массы. Вот и все.
Масса. Пожалуйста, вычислите относительную массу… железного купороса FeSO4•7H2O.
Обвиняемый. 19 152 граммов. Вот сколько!
Все. Какой ужас, какой кошмар!
Обвиняемый. Что же, скажите, опять неправильно? Вы, наверное, специально такие сложные вопросы задаете? Массу такого вещества никто правильно не вычислит.
Химия. Ребята, докажите ему обратное и объясните Соломонову, почему у него получилось такое большое число.
Отличник. Относительная масса железного купороса – 278, а не 19 152. Соломонов, очевидно, перемножил массу сульфата железа(II) на массу семи молекул воды. Эту ошибку многие допускают.
Обвиняемый. Конечно, умножил. Ведь там точка стоит, а это – знак умножения.
Масса. Точка в химической формуле не имеет ничего общего со знаком умножения в математике. А формула читается так: «феррум эс о четыре на семь молекул аш два о».
Чтобы правильно вычислить массу такого вещества – кристаллогидрата – надо сложить массы сульфата железа(II) и семи молекул воды. А вы этого не знали.
Оценка. Отметка за вычисление массы – «два».
Химический эксперимент. Позвольте возразить. Я не совсем согласен. Ведь масса сульфата железа и масса семи молекул воды вычислены правильно. По-моему, можно поставить «три».
Оценка. После совещания высочайший суд пришел к единогласному решению: поставить оценку «три с двумя минусами».
Закон. Суд продолжается.
Химия. Слово имеет Задача.
Задача. Ранее выступавшие свидетели уже установили, что обвиняемый не знает химических знаков, валентности, не умеет составлять химические формулы, расставлять индексы, не умеет вычислять массу молекулы. Поэтому он не в состоянии решить хотя бы одну химическую задачу.
Химия. А теперь ответьте на последний вопрос: какие законы химии вам известны?
Обвиняемый. Периодический закон.
Химия. А как он читается?
Обвиняемый. Я забыл. Да разве все упомнишь. Что я – академик?
Закон. Все запоминать никому не следует. В химии надо больше понимать и уметь применять законы. Но вот формулировки химических законов действительно надо выучивать наизусть. Тем более что их не так уж много.
Химия. Закон сохранения массы, закон постоянства состава, закон Авогадро и периодический закон.
Закон. Слово предоставляется защите.
Химический эксперимент. Уважаемые судьи, присяжные заседатели, свидетели и просто заинтересованные лица! Позвольте мне просить вас о смягчении меры наказания виновному. Ведь в том, что он почти ничего не знает, виноваты больше мы, т.к. не сумели заинтересовать его такой удивительной наукой, как химия – древнейшей и самой современнейшей из всех наук, вечно молодой и вечно развивающейся. Наша задача состоит в том, чтобы раскрыть перед учениками красоту науки, ее значение, научить радоваться умению самостоятельно добывать знания. Так пусть Соломонов Федот вместе с другими учениками убедится в том, что химия может творить чудеса. Покажем химические опыты с участием основных классов неорганических соединений.
Опыт «Превращение красного вина в белое».
Опыт «Получение молока».
Опыт «Получение индиго».
Опыт «Получение крови».
Опыт «Эскимо на палочке».
Опыт «Факел Прометея».
Опыт «Гиена огненная».
Опыт «Несгораемый платочек».
Опыт «Окрашивание роз».
(Описание опытов см. в приложении.)
Химия. Обвиняемому предоставляется последнее слово.
Обвиняемый. Я признаю свою вину перед наукой. Я не смогу провести ни одного из этих опытов, т.к. у меня нет знаний. Химия действительно очень интересная наука. Ее надо любить и понимать. Я виноват в том, что ленился. Но теперь торжественно обещаю, что с завтрашнего дня буду серьезно заниматься химией. Прошу меня простить.
Закон. Суд удаляется на совещание.
Химия. Встать, суд идет!
Закон. Разрешите зачитать решение суда. Соломонова Федота оставить в своем классе для дальнейшего изучения курса химии. 8-му «А» классу взять Соломонова Федота на поруки.
ПРИЛОЖЕНИЕ

На дно стакана поместить несколько капель фенолфталеина. Прилить раствор щелочи. Появится малиновое окрашивание.

К полученному раствору малинового цвета приливать раствор кислоты до исчезновения малиновой окраски.

На дно стакана налить раствор хлорида бария и приливать раствор сульфата натрия до появления молочно-белого осадка.

К свежеприготовленному осадку гидроксида меди(II) добавлять раствор глицерина до образования раствора ярко-синего цвета.

На дно стакана налить раствор роданида аммония и приливать слабый раствор хлорида железа(III) до образования раствора кроваво-красного цвета. Интенсивность окраски подобрать опытным путем.

В узкий стакан поместить примерно 20 г (одну треть стакана) сахарной пудры. При непрерывном помешивании стеклянной палочкой приливать концентрированную серную кислоту. Сахар начнет обугливаться до углерода и будет вспениваться выделяющимися газами и парами. Черная масса по стеклянной палочке полезет из стакана. В конце опыта можно отломить часть столбика обугленного сахара и показать детям – напоминает эскимо на палочке.

В стеклянную трубку диаметром примерно 2,5 см и длиной примерно 50 см поместить тампон, смоченный ацетоном (спиртом). Подуть в противоположный конец и поджечь тампон горящей лучинкой. Факел будет гореть, пока не кончится ацетон.

В фарфоровую ступку насыпать речной песок, смочить его спиртом. В центре проделать лунку и поместить в нее смесь 12 г сахарной пудры с 2 г питьевой соды. Спирт поджечь. Сахар будет сгорать, а пепел – вспениваться углекислым газом. Пламя спирта будет ограничивать расширение пепла. Из пламени будет вылезать масса пепла, похожая на многоголового змея.

Тонкий батистовый платочек смочить в воде и отжать. Затем смочить его в ацетоне, расправить, закрепить за кончики в щипцах и поджечь. Ацетон вспыхнет, но платочек не сгорит.

Розы сделать из гофрированной бумаги, пропитать их фенолфталеином. В химический стакан налить концентрированный раствор аммиака, прикрыть стакан стеклом, нагреть, через некоторое время внести по очереди в стакан розы. Они окрасятся в малиновый цвет.
Мероприятие можно разнообразить викториной, играми, песнями и стихами.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
http://him.1sept.ru/article.php?ID=200600310
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah