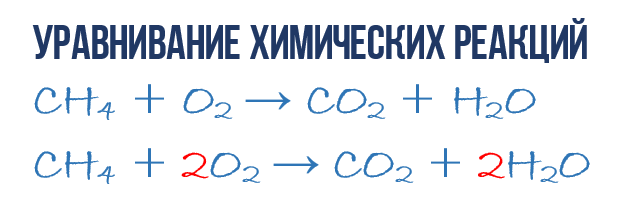Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Что такое частное в уравнении реакции
Математическое описание химических реакций .
Самый сложный класс химико-технологических процессов – это процессы протекания химических реакций (реакционные процессы). Именно к ним наиболее важно применять методы математического моделирования. В первую очередь мы будем рассматривать моделирование реакционных процессов. Математическое описание складывается из описания стехиометрии, химического равновесия и кинетики .
Стехиометрия и равновесие химических реакций
Стехиометрическое уравнение химической реакции (обычно его называют просто уравнением реакции) – это, как правило, самая первая информация, получаемая о ней химиком. Стехиометрическое уравнение представляет собой краткое выражение материального баланса реакции. Например, уравнение
означает, что всякий раз, как в процессе реакции затрачиваются две молекулы Н 2 , одновременно расходуется ровно одна молекула О 2 и образуются две молекулы H20
Наряду с подобными записями «со стрелкой», часто пишут уравнения реакций со знаком равенства. Мы будем считать, что оба способа записи равноценны, и в разных случаях пользоваться тем из них, который оказывается удобнее .
В большинстве случаев реагирующие вещества будем обозначать не конкретными формулами, а в общем виде : А, В, С, . J . причем под символом J обычно будем понимать «какое-либо вещество»; то, что относится к J, можно отнести к любому из веществ . Иногда все вещества будем обозначать одной буквой А , различая индексами : A 1 , A 2 и т. д. Стехиометрические коэффициенты в общем виде обозначим s с индексом вещества : s a , s j .
В расчетах сложных реакций бывают случаи , когда уравнения целесообразно писать не только в привычном виде
или в общем виде
причем в двух последних уравнениях разница между исходными веществами (реагентами) и продуктами реакции отражена в различных знаках стехиометрических коэффициентов . Обычно при таком способе записи считают, что для реагента или исходного вещества (расходуемого в реакции) s а для продукта (образующегося вещества ) s >0. Если реакция состоит из ряда стадий, то получается система из п уравнений :
где ( i – номер вещества ; m – общее количество веществ; п – число стадий. Разумеется, часть стехиометрических коэффициентов в любой строке может быть равна нулю .
Стехиометрические балансы . Стехиометрические расчеты особенно просты, когда количество вещества выражается в молях . Всюду, кроме особо оговоренных мест, мы будем выражать количество вещества g в молях, а концентрацию с – в молях на литр (или, что то же самое, в киломолях на кубометр ).
Рассмотрим реакцию, аналогичную выражению ( 1 )
Индексом 0 будем обозначать начальный момент ( c jo — начальное количество вещества J ).
Из уравнения реакции (3) для любого момента реакции вытекают уравнения стехиометрического баланса
Уравнение (4) выражает баланс реакции (1) по водороду: слева – удвоенное количество грамм-атомов Н в системе в текущий момент, справа – равное ему количество в момент начальный .
Уравнение (5) – баланс по кислороду. Первый член слева – количество грамм-атомов О в молекулах О 2 (поскольку в каждой молекуле содержится 2 атома ).
Левая и правая части уравнения (6) равны избытку одного из реагентов сверх стехиометрии . Если в избытке будет O 2 , то разность положительна, если Н 2 , то отрицательна. Если избытка нет, разность равна нулю. В ходе реакции избыток не меняется .
Если реакция идет при постоянном объеме (изохорически), то в любых балансовых уравнениях можно заменить g на с. Там, где не сделано оговорок, будем считать реакцию изохорической .
Уравнение стехиометрического баланса – одно из выражений стехиометрической эквивалентности реагирующих веществ. В реакции (3) эквивалентность определяется соотношениями :
В соотношениях эквивалентности для одностадийных реакций коэффициенты равны (или пропорциональны) стехиометрическим коэффициентам и обратны коэффициентам уравнений баланса (4) – (6 ).
Левые части уравнений (4) – (6) обладают тем свойством, что они не меняются по ходу реакции . Поэтому их называют и н-вариантами реакции ( invariantus – по-латыни неизменный), а для многостадийных реакций – инвариантами системы реакций .
Уравнения стехиометрического баланса (или инварианты) позволяют решать ряд важных расчетных задач . При описании химических процессов одна из важнейших моделей – уравнение материального баланса (3.5) или (3.6 ). Неизвестные, входящие в эти уравнения, – либо количества, либо концентрации веществ . Конкретный вид систем уравнений (3.5) может быть весьма сложным, и для упрощения вычислений часто крайне желательно уменьшить число уравнений, а стало быть, уменьшить число неизвестных g J . Для этого и могут служить стехиометрические балансы .
Так , из уравнений (4) – (6) следуют равенства
позволяющие исключить из дальнейших вычислений две величины ( g В и g С ), выразив их через g А и начальные условия .
Аналогично решается и другая задача: расчет состава реакционных смесей при неполном задании концентраций. Зная концентрации части веществ и все исходные концентрации, удается рассчитать концентрации других веществ, не измеряя их; иногда невязка стехиометрического баланса сигнализирует либо об ошибках в определении концентраций, либо о неверно записанной схеме реакций (например, о неучтенной побочной реакции ).
При решении подобных задач не следует учитывать обратимость реакций: стехиометрические балансы не зависят от обратимости .
Рассмотрим задачу. При постоянном объеме проходит сложная реакция :
В начальный момент концентрации составляли : с А0 = 5 моль/л ; с В0 = 6 моль/л ; С c0 =С 0 = C do =C fo =C ho =0.
В некоторый момент t смесь проанализировали, определив концентрации : с а =1 моль / л ; c С =2 моль/л ; c Е =2 моль/л ; c Н =5 моль/л . Требуется рассчитать концентрации В , D и F .
Решая эту задачу, необходимо иметь в виду, что все стадии сложной реакции идут в реакционной смеси одновременно .
Наиболее общий метод решения стехиометрических задач, использующий аппарат линейной алгебры, будет изложен ниже. Сейчас познакомимся с простым способом решения, связанным с представлением материального баланса реакции в виде ориентированного графа .
Граф – это система точек (вершин), соединенных линиями (ребрами). Если на каждом ребре указано направление (ребро – это стрелка), граф называют ориентированным. На рис. 1 изображен граф материального баланса данной реакций из расчета на 1 литр .
Вершины графа означают : 1– исходное количество А; 2 – количество А, оставшееся к моменту t ; 3 – израсходованное количество А; 4 – доля израсходованного А, пошедшая на образование С; 5 – соответствующая доля, пошедшая на образование D; 6 – исходное количество В; 7 –количество В, оставшееся к моменту t ; 8 – израсходованное количество В; 9 – количество образовавшегося С; 10 – количество С оставшееся к моменту C ; 11 – расход С на образование Е и Н (обратите внимание на то, что Е и Н образуются из одних и тех же молекул С, поэтому отдельно на образование Е и на образование Н вещество С не расходуется); 12 – количество образовавшегося Е, целиком оставшееся к моменту t , поскольку Е в дальнейшие реакции не вступает; 13 – количество Н, образовавшегося из С; 14 – количество образовавшегося D; 15 – количество D, оставшееся к моменту t ; 16 – израсходованное количество D; 17 – количество образовавшегося F ; 18 – количество Н, образовавшегося из D ; 19 – общее количество образовавшегося Н .
Расчет проводится от тех вершин, для которых количества известны, к другим вершинам. В начале известны количества А в вершинах 1 и 2 (5 и 1 моль). Отсюда количество А в вершине 3 равно 4 молям .
Дальнейший расчет ведем от вершины 12. Поскольку из С образовалось 2 моля Е, расход С составил также 2 моля (вершина 11). Вместе с 2 молями оставшегося С (вершина 10) получаем в вершине? количество образовавшегося С, составляющее 4 моля. Теперь переходим из вершины 11 в вершину 13; при расходовании 2 молей С, наряду с веществом Е, образуется 2 моля Н .
Следующий этап – расчет количеств А и В, пошедших на образование 4 молей С . По стехиометрии на это затрачено 2 моля А (вершина 4) и 4 моля В (вершина 8) . Следовательно, количество В, оставшегося к моменту t , равно 6 – 4=2 молям (вершина 7) .
Переходим к расчету образования и превращения D. Из количеств в вершинах 3 и 4 следует, что на образование D затрачено 2 моля А (вершина 5) . По стехиометрии из них образовалось 4 моля D – вершина 14 . Далее расчет приходится вести от вершины 18 . Поскольку общее количество образовавшегося Н равно 5 молям (вершина 19), а из С образовалось 2 моля Н (вершина 13), то в вершине 18 имеем 3 моля образовавшегося Н. На эту реакцию израсходовано 3 моля D (вершина 16). Одновременно по стехиометрии образовалось 6 молей F (вершина 17) . Наконец, сопоставив вершины 14 и 16, найдем, что из 4 молей образовавшегося D не вступил в реакцию и остался 1 моль (вершина 15) .
Окончательно : с В =2 моль/л; с d =1 моль/л ; с F =6 моль/л .
Применение линейной алгебры для решения стехиометрических задач .
Для многостадийных реакций нахождение инвариантов удобно производить методами линейной алгебры .
Условно рассмотрим выражение (2) как систему из п уравнений с т неизвестными A j . Пусть b 1 , b 2 , . , b т — какое-либо решение этой системы, т. е. при подстановке в систему (2) вместо A i чисел hi она обращается в тождество . Тогда сумма
является инвариантом данной системы реакций .
Уравнения системы (2) однородны (правые части их равны нулю) . При этом всегда m rg , где rg – ранг матрицы системы (2) . Такая система имеет бесконечное число решений . Поэтому для любой реакции можно определить бесконечное число инвариантов. Но только часть из них , в количестве, равном т – rg , линейно независимы. Любой другой инвариант может быть получен как линейна я комбинация выбранных ( т – rg ) инвариантов, соответствующих фундаментальной системе решений уравнений (2) .
Напомним , что линейной комбинацией величин или выражений x 1 , x 2 , . , x k называется выражение l 1 x 1 + l 2 x 2 +. + l k x k , где l 1 , . l k – произвольные числа . Если в некоторой системе выражений ни одно из них не может быть представлено как линейная комбинация остальных , система называется линейно независимой . Частный случай линейной комбинации – сумма ( l 1 = l 2 = ? = l k =1). Подробно об однородных системах, линейно независимых решениях, ранге и фундаментальных системах решений рассказано в книге [17]. Мы лишь поясним сказанное примерами .
Реакции А ® В соответствует уравнение
для которого т= 2, rg = l . Фундаментальная система состоит из 2–1=1 решения – например, b 1 = l , b 2 ,=1, которому соответствует инвариант g \+ gB , в данном простейшем случае линейная комбинация получается единственным образом – умножением фундаментального решения на произвольное число . Действительно, выражения 2 g A + 2 g B ; 750 g A + 750 g B ; 0,112 g A + 0,112 g B и т. д. также, разумеется, будут инвариантами этой реакции .
Для уравнения , соответствующего реакции (3) , m =3 , rg = l . Здесь фундаментальная система состоит из двух решений . Если в качестве одного из них принять : b 1 = l , b 2 =0, b 3 =1, а в качестве второго b 1 =0, b 2 =2, b 3 =1, то получим инварианты , определяемые , балансами (4) и (5). Любая линейная комбинация обоих решений также явится решением , и ей будет соответствовать инвариант реакции (3) . Так, вычтя второе решение из первого, получим b 1 =+ l , b 2 = –2 , b 3 =0 ; соответствующий инвариант g A –2 g B дан уравнением (6) .
Пример 1 . Инварианты сложной реакции .
Рассмотрим процесс нитрования бензола . При этом пренебрежем образованием о – и n –динитробензолов и несимметричных тринитробензолов. Тогда схема реакции запишется так :
Обозначим для краткости С 6 Н 6 =А 1 ; C 6 H 5 NO 2 = A 2 ; C 6 H 4 ( NO 2 ) 2 = A 3 ; С 6 Н 3 ( NO 2 ) 3 =А 4 ; Н 2 О=А 5 ; Н N О 3 =А 6 ; NO 2 =А 7 ; O 2 = A 8 ; N 2 O 4 =А 9 . Однородная система уравнений может быть записана в виде :
Методом Гаусса систему (8) привели к треугольному виду
Если принять, например, в качестве свободных переменных А 3 , А 4 , A 8 и А 9 , то получается фундаментальная система из четырех решений :
которой соответствуют инварианты :
Линейно независимые стадии реакции .
Рассмотрим для примера синтез карбамида. Можно предполагать следующие его стадии :
а также ряда других, не приводимых здесь для простоты ( например , образование NH 4 OH свободных радикалов и т. д.). Задача физико-химического изучения реакции заключается в расшифровке механизм а, т. е. выявлении того, какие из стадий проходят в действительности и каковы их скорости. Но некоторые практические задачи могут быть решены и без такой расшифровки. Так, равновесие и тепловой эффект не зависят от того, через какие стадии проходит реакция. Не нужна расшифровка механизма и для определения такого важного технологического показателя, как выход карбамида .
При решении этих задач оказывается, что записанная система стехиометрических уравнений в некотором смысле избыточна . Действительно, если мы исключим из рассмотрения стадию ( в ), то на ходе и результатах расчета равновесия или выхода это практически не отразится , поскольку данная стадия получается как сумма стадий ( а ) и ( б ) . То же относится к стадии ( д ), равной сумме ( а ) + ( г ).
В любой обратимой реакции одна из стадий равна другой, умноженной на – 1 . Некоторые стадии могут представлять собой не просто суммы, но и более сложные линейные комбинации иных стадий: так, ( и )=( б ) – ( г ) – ( а ) .
Разумеется, при исследовании механизма можно исключить из рассмотрения лишь такие стадии, для которых установлена нулевая скорость. Но в вышеназванных ограниченных задачах часто целесообразно исключить те стадии, которые можно получить как линейную комбинацию других стадий .
Сведение системы типа (2) к линейно независимой путем исключения строк, являющихся линейными комбинациями других, часто упрощает расчеты. Например, равновесие в системе характеризуется таким числом констант равновесия, которое равно числу линейно независимых строк. Остальные константы могут быть рассчитаны, исходя из предыдущих. Исключение линейно зависимых строк не меняет инвариантов данной системы реакций .
Для определения числа линейно независимых стадий записывают систему уравнений (2) для данной реакции. При этом, в соответствии со сказанным выше, из каждой обратимой реакции нужно включать в систему лишь одну стадию (безразлично, какую). Далее выписывают матрицу коэффициентов этой системы
Число линейно независимых стадий равно рангу матрицы . На вопрос о том, какие именно стадии включить в систему линейно независимых, можно дать не один ответ: любая совокупность из k строк матрицы , содержащая хотя бы один минор k- го порядка, не равный нулю, линейно независима. В таких случаях выбор требуемой системы определяется соображениями удобства – например, тем, для каких именно стадий известны константы равновесия. Более того, иногда удобно включить в линейно независимую систему новые стадии, полученные как линейные комбинации части строк системы (3), и исключить часть последних.
Способы нахождения ранга матрицы и линейно независимых комбинаций строк рассматриваются в линейной алгебре; когда число строк достаточно велико, целесообразно использовать ЭВМ .
ПРИМЕР 2 . Расчет линейно независимых стадий .
Для реакции синтеза карбамида обозначим : CO 2 = A 1 ; N Н 3 =А 2 ; Н 2 О=А 3 ;
NH 2 СОО N Н 4 =А 4 ; N Н 2 СО N Н 2 =А 5 ; ( N Н 4 )СО 3 =А 6 ; N Н 4 НСО 3 =А 7 . Тогда система ( 2 ) примет вид :
Запишем матрицу для этой системы:
Было рассчитано, что ранг матрицы , rg =4. Таким образом, из всех стадий реакций в качестве линейно независимых могут быть приняты только 4. Например, это могут быть стадии ( а ), ( б ), ( г ), ( е ) . Проверка показывает, что для этих стадий rg =4, и они действительно линейно независимы .
Подробно вопросы стехиометрических расчетов для сложных реакций рассмотрены в книге [17] .
Степень превращения и селективность – две характеристики технологического процесса, расчет которых тесно связан со стехиометрическими соотношениями .
Степень превращения х какого-либо реагента А равна доле превратившегося в продукты вещества от общего начального количества этого вещества. Например, для реакции :
степень превращения вещества А можно выразить следующим образом:
а степень превращения вещества В так :
Величины х а и х В в общем случае не равны одна другой . Они равны только, если соблюдается соотношение
т. е. если А и В взяты в стехиометрических количествах. В противном случае для того из веществ, которое взято в избытке относительно стехиометрии, степень превращения окажется меньше. Если избыток велик, вещество будет израсходовано лишь в малой степени, тогда как для второго степень превращения может быть близкой к 1. Этим нередко пользуются в технологии: давая в избытке менее ценный реагент, сдвигают равновесие и приближают использование ценного исходного вещества к 100% .
При постоянном объеме в формуле ( 10 ) можно заменить g на с .
Расчет степени превращения можно проводить и через количество продукта . Так, в реакции
степень превращения А составит
Но в такой форме расчет менее удобен, особенно если реакция—многостадийная. Так же, как описанный ниже расчет селективности, расчет степени превращения удобнее вести через исходное вещество .
Отметим еще следующее . Количество реагента можно выразить формулой
В этом смысле с точностью до знака степень превращения можно рассматривать как безразмерную концентрацию. Во многих работах описание протекания химических реакций проводится именно в терминах степеней превращения .
Селективность , под которой понимают выход целевого продукта на затраченное исходное вещество, является одной из важнейших характеристик тех процессов, в которых наряду с основной реакцией протекают побочные стадии, приводящие к образованию нежелательных побочных продуктов . Селективность s может быть определена следующим образом :
Таким образом , величина s показывает, какая доля превратившегося исходного вещества затрачена на основную реакцию—на образование целевого продукта .
При расчете селективности часто необходимо учитывать стехиометрическую эквивалентность исходных веществ и продуктов. Например, проходит реакция, в которой В – целевое вещество, а остальные продукты – отбросы .
В реакционной смеси : с А = 0,2 моль/л ; с В = 2,6 моль/л ; с С = 0,6 моль/л ; с D = 0,4 моль/л ; с Е = 0,2 моль/л ; с Н = 1,5 моль/л . Требуется рассчитать s .
Установим стехиометрическую эквивалентность веществ :
Теперь легко получить
В числителе – количество А, затраченное на образование В; второе и третье слагаемые знаменателя – затраты А на образование С и Е . Затраты А на получение Н не учитываются, поскольку образование Н не является самостоятельной , побочной реакцией: этот продукт обязательно образуется при получении В; при этом А отдельно не расходуется . По этой же причине в выражении для s учитывается образование лишь одного из продуктов второй стадии (безразлично, которого – для примера в уравнение введено вещество С) .
Расчет химического равнове сия основывается на решении систем уравнений , задаваемых константами равновесия , совместно с уравнениями стехиометрического баланса , аналогичными уравнениями ( 4) – (6 ). При этом в случае многостадийных реакций следует рассматривать только линейно независимые стадии , иначе система уравнений окажется избыточной , что может привести , например , к вырождению матрицы коэффициентов .
Мы рассмотрим лишь простейший случай , когда константы равновесия достаточно точно выражаются через концентрации . Трудности , связанные с введением коэффициентов активности , обычно разбираются в курсе физической химии . Но и без этих трудностей расчет равновесия далеко не всегда тривиально прост .
Пример 3 . Расчет равновесия .
Рассчитаем равновесные концентрации веществ в реакции
если заданы константы равновесия всех стадий, а также известно, что в исходной смеси концентрация реагента составляла , а остальные вещества отсутствовали.
Задача сводится к решению системы
Из первых трех уравнений легко получить
Тогда четвертое уравнение получит вид :
Дальнейший расчет элементарен .
Если в прямой или обратной реакции какой-либо стадии участвуют более одной молекулы, система оказывается нелинейной, что усложняет решение .
Формальная химическая кинетика
Кинетика химических реакций – основа их описания. Главной проблемой кинетики как раздела физической химии является вопрос о механизме реакции. Основная задача кинетики – раскрыть механизм реакции и установить, как он отражается в кинетических закономерностях .
При анализе, описании и расчете протекания реакции как элемента химико-технологического процесса вопрос о механизме реакции часто не встает: кинетические закономерности рассматриваются как уже заданные (например, изученные на предыдущем – физико-химическом этапе исследования). В этих случаях описание проводится на языке формальной кинетики .
Скорость реакции – основное понятие кинетики . Она определяется как количество вещества , реагирующее в единицу времени в единице реакционного пространства
где V – реакционное пространство , которое в случае гомогенной реакции представляет собой объем , а в случае гетерогенной – поверхность .
Часто применяют удобный частный вид уравнения (1). Но прежде, чем записать его, необходимо подчеркнуть, что пользоваться им можно только при соблюдении двух условий :
1 ) реакция проходит при постоянном объеме ;
2) объем этот можно считать закрытым .
Закрытой, или замкнутой называется система, которая по ходу процесса не обменивается веществом с окружающей средой (хотя и может обмениваться энергией). Большинство химико-технологических процессов, и в первую очередь все непрерывные процессы, протекают в открытых системах, которые характеризуют обмен с окружающей средой энергией и веществом. Лишь в одном крайнем случае (поток идеального вытеснения) в аппарате непрерывного действия удается выделить объем , который можно считать закрытым ( см . раздел 12 ).
Если гомогенная реакция в закрытом объеме проходит изохорически ( V = const ), то постоянную величину 1 / V в формуле (1) можно внести под знак дифференциала ; учтя , что g / V = c есть концентрация, получим —
Уравнением (2) часто пользуются , так как оно удобно для интегрирования ; но необходимо помнить , что это – лишь частный случай , который верен далеко не всегда .
Формально простые и сложные реакции . Химическая кинетика определяет простые (одностадийные) реакции как такие, которые по существу проходят в одну стадию; простая реакция содержит один элементарный акт. Однако такие реакции, которые проходят как истинно одностадийные, встречаются редко .
В формальной кинетике оказывается удобным говорить о формально простых реакциях. Так называют реакции, которые можно формально представить как протекающие в одну стадию. При этом по существу реакция может быть сложной, проходящей через какие-то промежуточные стадии. Но если в условиях рассматриваемой задачи промежуточные продукты не обнаруживаются, то реакция будет считаться формально простой. В какой-либо другой задаче та же реакция может фигурировать, как сложная – это будет означать лишь переход к иному формальному рассмотрению. Несмотря на условность понятия – формально простая реакция, оно удобно и поэтому часто используется .
Многие реакции всегда приходится рассматривать как сложные: они явно распадаются на стадии (продукты различных стадий образуются в значительных количествах) .
Можно выделить три простейших типа сложных реакций .
Обратимая реакция . С излагаемой точки зрения это сложная реакция, состоящая из двух стадий: прямой и обратной реакции .
Параллельные реакции : исходное вещество по двум или нескольким параллельно протекающим реакциям (стадиям) превращается в два или несколько продуктов. Примером может служить нитрование толуола с параллельным получением о- и n — нитротолуолов .
Последовательные реакции : стадии реакции следуют одна за другой, продукт первой стадии является исходным веществом второй, и т. д. Примером может служить деполимеризация с последовательным распадом макромолекулы на все более мелкие части. Остальные сложные реакции можно представить в виде комбинаций указанных трех типов – например, последовательно-параллельные, последовательные реакции с обратимыми стадиями
Оговоримся, что здесь мы не рассматриваем такие многостадийные реакции, стадии которых разделены во времени: сначала проводится одна стадия, затем через некоторое время – вторая и т. д. Такой процесс мы будем считать несколькими независимыми реакциями. А те сложные реакции, о которых здесь идет речь, проходят так, что в реакционной смеси одновременно идут все стадии .
Скорость одностадийной реакции и скорость реакции по веществу .
Рассмотрим формально одностадийную реакцию (она может быть и одной из стадий сложной реакции)
Возникает следующий вопрос. Количество какого из веществ (А, В или С) следует вводить в уравнение (1) при определении скорости реакции (3)? Ответ на этот вопрос легко получить из понятия стехиометрической эквивалентности. Если за какой-то промежуток времени прореагирует некоторое количество g A вещества А, то за это же время количества прореагировавшего В и образовавшегося С составят :
Поэтому , если мы подставим в формулу (1) один раз g а , другой раз § в , третий раз g c , то получим три значения : r A , r B и r C , отличающиеся одно от другого постоянными множителями . Строго говоря , это одна и та же величина – скорость реакции (3), но выражена она в разных единицах . Для единообразия скорость одностадийной реакции , или скорость стадии принято определять , деля скорость , выраженную через любое вещество J , участвующее в этой стадии , на стехиометрический коэффициент этого вещества
В этом случае безразлично, какое из веществ принято в качестве J. Действительно, из выражений (4) следует :
Во многих формально-кинетических расчетах используются и значения скорости стадии, выраженные через конкретные вещества. Для этих значений из формулы (5) получаем :
При пользовании формулой (7) следует учитывать, что если в рассматриваемой стадии J – исходное вещество , то s j и соответственно, получим r J J – продукт, т. е. образуется на данной стадии , то s j >0 и r J >0. Так, в реакции (3) s А s b s С >0, и соответственно , r а r В r С >0 .
Пример 1 . Скорость реакции по веществам .
имеющую первый порядок по реагенту А и нулевой – по В ; константу скорости обозначим через k . Для этой реакции, в соответствии с формулой (7), имеем
r а = – 2 kc A r B = – kc A r C = 2 kc A
Обратите внимание на то, что и r а , и r B и r C зависят от c A и не зависят от c B . Вопрос о том, почему это так, лежит вне формальной кинетики – это вопрос о механизме реакции. Но в формально-кинетических расчетах важно помнить, что в случае формально одностадийной реакции или стадии сложной реакции r а , r B и r C – не три разные скорости, а одна и та же скорость реакции, и различаться эти величины могут только множителями – стехиометрическими коэффициентами. Уравнение реакции устанавливает однозначную связь между реагирующими количествами А, В и С и, стало быть, связь между скоростями по этим веществам, определяемую формулой (7) .
Порядок реакции . Скорость многих (хотя и не всех) формально простых реакций, а также стадий сложных реакций пропорциональна концентрациям реагирующих веществ в некоторых степенях. Показатели степени в таком случае называют порядком реакции по реагентам. Так, для реакции
соответствующая зависимость будет выражаться кинетически м уравнением
Здесь n 1 — порядок реакции по веществу А , n 2 – порядок по веществу В , сумму n 1 + n 2 называют общим, или суммарным порядком. Коэффициент пропорциональности k именуют константой скорости реакции .
Порядок реакции или стадии будем обозначать цифрой над (или под) стрелкой, указывающей направление реакции; здесь же будем приводить обозначение константы скорости . Так, запись
обозначает обратимую реакцию, у которой прямая стадия имеет 1-й порядок по А и константу скорости – k 1 , обратная – 2-й порядок по С и константу k 2 . Поскольку порядок по В не указан, он – нулевой .
На практике встречаются реакции самых разнообразных порядков: целочисленных и дробных, нулевого, изредка и отрицательных. Численное значение порядка может быть и очень малым, и большим – так, для каталитической димеризации ацетилена установлен порядок выше 9-го [50] .
Достаточно часты случаи, когда порядок по каждому из реагентов совпадает с его стехиометрическим коэффициентом. Но обязательно такое совпадение лишь для строго (не формально) простых реакций. Вследствие сложности механизма формально одностадийные процессы могут протекать по порядкам, сильно отличным от стехиометрических коэффициентов .
Заметим, что у тех реакций, порядок которых не совпадает со стехиометрическими коэффициентами, при приближении к равновесию (или к 100%-ному. Превращению, если реакция необратима), как правило, начинается изменение порядка – непосредственно вблизи равновесия порядок сходится к величине, определяемой стехиометрией .
Существует достаточно много реакций, скорость которых вообще не может быть описана формулой (9). Понятие – порядок реакции к таким реакциям либо вообще неприменимо, либо применимо с оговорками. В частности, обычно нельзя говорить о порядке разветвленных цепных реакций. Для многих неразветвленных цепных реакций и гетерогенно-каталитических реакций (в случае существенного влияния стадии адсорбции) в кинетическое уравнение, наряду со степенными, входят и сомножители более сложной структуры. Например, кинетическое уравнение для синтеза бромистого водорода из простых веществ имеет вид :
В то же время задание порядка реакции иногда является кратким выражением особенностей кинетики .
Пример 2. Гомогенный катализ. Реакция может иметь некоторый порядок по веществу, не входящему в стехиометрическое уравнение :
Это гомогенный катализ: вещество D является катализатором. В роли гомогенного катализатора может выступать один из продуктов реакции — это случай автокатализа :
По некоторым веществам порядок реакции может быть отрицательным – отрицательный катализ, или ингибирование. Чаще всего в роли ингибитора выступает один из продуктов реакции :
Хотя возможен и случай, когда ингибитор не отражен в стехиометрии реакции :
Температурная зависимость скорости реакции . В уравнении (9) концентрации не зависят от температуры в явном виде. Порядок реакции иногда претерпевает изменения с ростом температуры, но это – скорее исключение, чем правило. Наиболее тесно с температурой связана константа скорости реакции. Эта зависимость чаще всего может быть описана уравнением Аррениуса
Параметрами уравнения (12) являются предэкспоненциальный множитель , или предэкспонента А и энергия активации E . Формальная кинетика не занимается физическим смыслом величин А и Е, но для многих задач важно понимать, какая именно характеристика реакции определяется величиной Е .
Иногда приходится встречаться с мнением, что чем больше энергия активации, тем, в соответствии с формулой (12), меньше величина k и значит, тем медленнее реакция. Но это мнение неверно. Величина k определяется не значением Е , а совокупностью значений Е и А. Поэтому сама по себе величина Е еще не определяет, быстра или медленна реакция .
Формальный (феноменологический) смысл Е иной: чем больше энергия активации, тем сильнее скорость реакции зависит от температуры. На рис. 1 изображена зависимость констант скоростей двух одностадийных реакций от температуры. По рисунку сразу можно сказать, что Е 2 > Е 1 .
Указанный характер влияния Е на ход реакции позволяет произвести быструю качественную оценку влияния температуры на ход некоторых сложных реакций. Так, для обратимых реакций получаются следующие закономерности .
Обратимые экзотермические реакции характеризуются соотношением E 2 > E 1 : энергия активации обратной реакции больше, чем прямой. Поэтому с ростом температуры k 2 растет быстрее , чем k 1 , в результате чего равновесие смещается влево. Наоборот, в эндотермических обратимых реакциях E 2 E 1 , и с ростом температуры равновесие смещается вправо .
Рис . 1 . График температурной зависимости констант скорости двух реакций ( E 2 E 1 ).
Если рассматривается сложная реакция, некоторые стадии которой являются для нас побочными, то соотношение энергий активации различных стадий определяет влияние температуры на селективность: при нагревании преимущественно ускоряются те стадии, которые характеризуются большей энергией активности .
Скорость сложных реакций . Для всех типов формально сложных реакций, кроме простейшей обратимой, понятие общей скорости реакции не имеет смысла. Реакция состоит из ряда стадий, каждая из них имеет свою скорость, и нельзя достаточно естественным образом определить, что такое скорость всей сложной реакции в целом .
В то же время любое из участвующих в реакции веществ образуется или расходуется с определенной скоростью, причем знание этой скорости обязательно при расчете процесса .
Скорость сложной реакции по любому веществу J равна алгебраической сумме скоростей всех стадий по этому веществу (с учетом стехиометрических коэффициентов )
Здесь i – номер стадии; m – число стадий .
Скорость стадии по веществу определяется формулой (7). Если вещество в стехиометрии стадии не участвует, его стехиометрический коэффициент в этой стадии равен нулю .
Пример 3 . Скорости сложной реакции по веществам .
Запишем кинетические уравнения для веществ, участвующих в реакции :
Вещество А участвует в 1-й, 2-й и 3-й стадиях со стехиометрическими коэффициентами – 1, +1 и – 1 . Поэтому
( если выражение не ясно, вернитесь к примеру 1 ). Соответственно
Последнее равенство естественно, поскольку Н, будучи катализатором, не участвует в стехиометрии реакций: не расходуется и не образуется .
Заметьте, что если вещество участвует в обратимой реакции, то стехиометрические коэффициенты для прямой и обратной стадий равны по абсолютной величине и обратны по знаку .
Интегрирование уравнений кинетики . Если химическая реакция (простая или сложная) проходит в замкнутой системе при постоянном объеме, то ход ее, как правило, описывается системой дифференциальных уравнений. Действительно, совместное рассмотрение уравнений (2), (9) и (13) приводит к формуле :
причем число таких уравнений равно числу веществ, участвующих в реакции (реагентов и продуктов). Однако всегда можно уменьшить число уравнений, исключив из рассмотрения часть веществ при помощи стехиометрических инвариантов .
Пример 4 . Упрощение системы кинетических уравнений .
Рассмотрим две задачи на описание кинетики . 1 по А) А
Здесь система уравнений (14) имеет вид :
Но простейшие стехиометрические соотношения ( при с В0 = с С0 =0)
http://nauka.club/khimiya/khimicheskie-uravneniya.html
http://www.gaps.tstu.ru/win-1251/lab/sreda/tpo/6/new/lekcii/mat_opis.html