Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
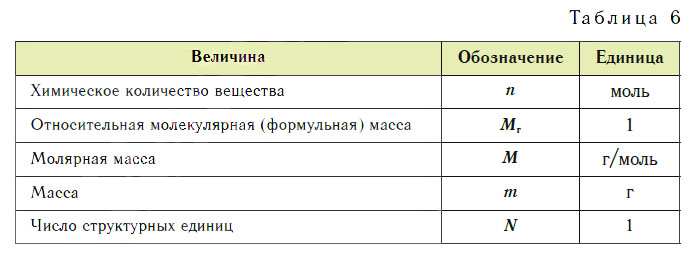
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Конспект урока химии «Расчёты по химическим уравнениям»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Конспект урока «Расчёты по химическим уравнениям»
1. Ф.И.О. учителя : Харламова Е.Н
2 . Предмет : химия .
3 . Базовый учебник О.С.Габриелян «Химия – 8». 3 изд, переработанное. – М.: «Дрофа» 2014г
5. Место урока в изучаемой теме : тема «Изменения, происходящие с веществами» урок № 8.
6. Тип урока : изучение нового
7 . Цель: создание условий для развития навыков решения задач по уравнениям реакций, используя алгоритмы, находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ
8 .Задачи: — 8.1 образовательные: познакомить учащихся с основными способами решения задач по химическим уравнениям ( находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ ), закрепить знания об уравнениях химических реакций, закрепить умения использовать физическую величину «количество вещества», умение записывать формулы веществ по их названию, отработать умения пользоваться математическими понятиями «отношения», «пропорция»
-8.2 развивающие: способствовать развитию умения обобщать данные опыта и делать выводы, сравнивать, умения составлять план и пользоваться им, учить анализировать ответы товарищей, понимать свои ошибки, осуществлять самоконтроль
— 8.3 воспитательные: стремиться воспитать чувство ответственности за порученное дело, исполнительности, аккуратности, добросовестности.
9. Планируемые результаты обучения :
9.1. Личностные результаты: принятие социальной роли обучающегося формирование ответственного отношения к учению и устойчивых познавательных интересов у обучающихся, повышение своего образовательного уровня
9.2 Предметные: овладение приемами работы с информацией химического содержания, представленной в разной форме (в виде текста, формул, схем) 9.3 Метапредметные результаты: умение определять понятия, создавать обобщения, устанавливать аналогии, умение извлекать информацию из различных источников, овладение навыками самостоятельного приобретения новых знаний, организации учебной деятельности, поиска средств ее осуществления.
10. Формы работы учащихся фронтальная, индивидуальная, парная, работа с книгой,
11. Оборудование : Периодическая система химических элементов Д.И. Менделеева, Раздаточный лист для учащихся с задачами (Приложение № 1)
12. Контроль: формы :индивидуальный, фронтальный; методы: устный опрос, наблюдение за работой учащихся
13. Литература учителя: М.Ю Горковенко. «Поурочные разработки по химии»- М. «Вако», Мастр — класс Можаева Г.М «Решаем вместе»
Приветствие учащихся, настрой на работу.
Актуализация имеющихся знаний.
Расставьте коэффициенты в следующих схемах реакций, укажите типы реакций:
Натрий + вода = гидроксид натрия + водород
Хлорид железа (III) + гидроксид калия = гидроксид железа (III) + хлорид калия
Проверка д.з. у доски : стр 197 учебника упр 1 а – в.
В жизни любому человеку приходится решать з адачи – профессиональные, бытовые, семейные, учебные. Решать задачи это означает: для достижения своей цели использовать имеющиеся знания и находить новые, выбирать нужные способы и методы, применять их, осмысливать свою работу и отлавливать возникающие ошибки. И на уроках химии мы с вами уже решали задачи. Давайте вспомним.
Вам хорошо известны две величины, характеризующие порцию вещества: масса ( m ) и объем ( V ) . Вы знаете обозначения этих величин, как они измеряются, в каких единицах. Знаете вы и о связи этих величин через производную величину – плотность вещества: ρ = m / V . Однако в химических реакциях взаимодействуют не граммы или миллилитры, а отдельные атомы, молекулы, группы атомов, то есть структурные единицы вещества.
— Какая физическая величина характеризует порцию вещества по числу его структурных — единиц? — Какая у неё единица измерения?
Один учащийся записывает на доске необходимые формулы.
Стр 99 учебника упр 4 (в), стр 95 упр 3 (г)
Вы умеете производить расчеты по формулам, вы умеете и записывать уравнения реакций.
Какая будет тема нашего урока?
Исходя из темы, сформулируйте цель урока.
Большая часть расчетных задач по химии связана с расчетами по уравнениям химических реакций. Для проведения таких расчетов надо знать количественные характеристики химической реакции. Основной качественной и количественной характеристикой химической реакции является уравнение этой реакции.
— Что показывает уравнение химической реакции? (Уравнение показывает, какие вещества вступают в реакцию и какие получаются, а коэффициенты в этом уравнении показывают число структурных единиц этих веществ, а значит, коэффициенты показывают и определенное число моль для каждого вещества)
4Р + 5О 2 = 2Р 2 О 5
В реакцию вступил фосфор количеством вещества ? моль и кислород количеством ? моль, образовалось ? моль оксида фосфора ( V ).
Если в реакцию вступит 2 моль фосфора, то потребуется ? моль кислорода ? моль
И если какого то вещества взять больше или меньше, чем указано в уравнении, то, чтобы реакция прошла полностью, во столько же раз больше или меньше придется взять других веществ, во столько раз больше или меньше получится продуктов реакции. Соотношение между числом моль веществ останется прежним, зависящим от коэффициентов. Это соотношение можно выразить в виде следующей пропорции:
Эта пропорция позволяет, зная количество вещества одного из участников реакции, провести по уравнению реакции один или несколько расчетов, определяя количество вещества для других ее участников.
Решение задач с раздаточного листа.
Задача №1 Какой объем кислорода (н. у.) необходим для сгорания 0,6 моль алюминия .
Анализ условия задачи . Его можно условно разбить на две составляющие – анализ химической стороны задачи и анализ ее количественных характеристик. При анализе химической стороны задачи вы должны понять, какие вещества и процессы описаны в условии, отобразить их формулами и уравнениями реакций. Не менее важен и анализ количественной стороны задачи: какие именно величины характеризуются числами в условии задачи, ввести нужные обозначения, правильно указать принадлежность величины. Анализ количественной стороны задачи должен быть отражен в краткой записи условия.
Анализ количественной стороны: учитель на доске, учащиеся в тетради записывают условие задачи.
Анализ химической стороны задачи: записывают уравнение реакции.
Учитель обращает внимание учащихся на алгоритм решения задач
Алгоритм решения расчетных задач — учебник стр 167
Учитель объясняет решение предложенной задачи.
Отвечают ли единицы измерения искомой величине? Полученное значение – возможным значениям этой величины? Соответствуют ли хотя бы по порядку величины значения исходных данных и результата?
Задачи №2 и № 3решаются аналогично задаче № 1, поэтому учащиеся работают в парах с проверкой у доски
Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода.
Вычислите количество вещества воды, если при ее разложении получили 3 моль кислорода
Но чаще в условиях задач дается и надо найти массу, объём вещества. Тогда будем переводить эти данные в количества вещества
Расчеты по химическим уравнением
Разделы: Химия
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход и содержание урока
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
- Новая тема.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
Запишем уравнение химической реакции:
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
откуда х = 0,25 моль Слайд 7
Следовательно, n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Ответ: m(О2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
M(Fe)=56г/моль,
m(Fe2O3)=
Проверим решение задачи 2
4.
х моль = 0,07моль,
m (H2O) = 
n(CuO) = 10г/ 80г/моль = 0,125 моль
х моль = 0,125моль, n(H2O)=0,125 моль
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO3 = CaO + CO Cлайд 16.
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 — 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Расчеты по химическим уравнениям
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г ; кг ; мг
Кол-во в-ва (n) : моль ; кмоль ; ммоль
Молярная масса (M): г/моль ; кг/кмоль ; мг/ммоль
Объём (V) : л ; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль ; м 3 /кмоль; мл/ммоль
Число частиц (N): 6•1023 (число Авагадро – NA); 6•1026 ; 6•1020
http://infourok.ru/konspekt-uroka-himii-raschyoti-po-himicheskim-uravneniyam-1916069.html
http://urok.1sept.ru/articles/612236