Материальный баланс
|
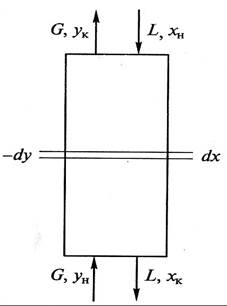
Рассмотрим массообменный процесс между фазами G и L в противоточном аппарате, схема которого представлена на рис. 9.1. Будем считать, что начальные хн, ун и конечные хк, ук массовые (мольные) концентрации распределяемого вещества в фазах G и L соответствуют его переходу из фазы G в фазу L. В этом случае на некотором малом участке произвольного сечения массоо6менного аппарата концентрация компонента М в фазе L увеличится на величину dх, а в фазе G уменьшится на величину dу (по ходу движения фазы).
Таким образом, переданное количество dМ распределяемого компонента можно записать как по одной, таки по другой распределяющим фазам:
Уравнение (9.2) является дифференциальным уравнением материального баланса массообменного процесса.
Для получения полного (интегрального) уравнения материального баланса проинтегрируем его в пределах изменения рабочих концентраций
Легко убедиться, что уравнение (9.3), так же как и (9.2), не зависит от направления движения взаимодействующих фаз, а характеризует только материальный баланс системы при массопередаче.
Важной характеристикой массоо6менных процессов являются уравнения рабочих линий, которые связывают между собой концентрации распределяемого компонента в распределяющих фазах во время осуществления процесса.
Различают два основных способа взаимодействия распределяющих фаз в процессе массообмена: противоток и прямоток.
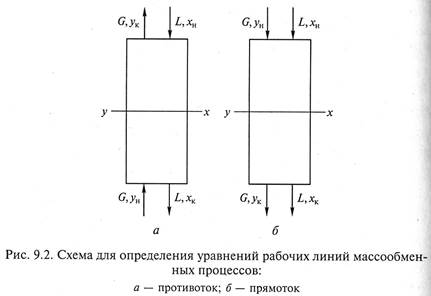
1. Противоточная схема проведения процесса массопередачи (рис. 9.2, а).
Используя уравнение материального баланса (9.2), проинтегрируем его для верхней части аппарата в указанных на схеме пределах:
В результате получаем уравнение рабочей линии противоточного процесса массопередачи
которое является уравнением прямой с тангенсом угла наклона L/G. Второе слагаемое является постоянной величиной, Не меняющейся в случае интегрирования уравнения (9.2) в пределах концентраций в нижней части массообменного аппарата.
2. Прямоточная схема осуществления процесса массопередачи (рис. 9.2, б).
Интегрирование уравнения (9.2) произведем также для верхней части массообменного аппарата в указанных на схеме пределах:
В результате получаем уравнение рабочей линии прямоточного процесса массопередачи
Уравнение (9.5) также является уравнением прямой линии, однако угол наклона этой прямой противоположен углу наклона рабочей линии противоточного массообменного процесса, о чем указывает знак « — » перед значением тангенса угла (L/G) наклона прямой.
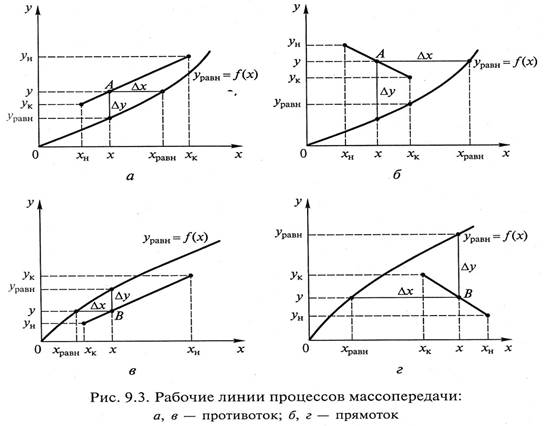
Изображения рабочих линий процесса массопередачи для противотока и прямотока представлены на рис. 9.3.
Движущая сила массоо6менного процесса определяется степенью отклонения системы от равновесия и может быть выражена разностью содержаний целевого компонента в рабочем и равновесном состояниях системы (Δу или Δх). Направление переноса
распределяемого вещества удобно определять на диаграмме у – х по расположению равновесной и рабочей линий.
Если рабочая линия расположена выше линии равновесия (рис. 9.3, а, б), то для любой точки, расположенной на этой линии (точка А), у > уравн и х хравн.
При таком процессе распределяемый компонент будет переходить из фазы L в фазу G, причем движущая сила в точке В, выраженная через концентрации соответствующих фаз, может быть записана как Δу = уравн – y и Δх = х – хравн.
Скорость массопередачи может быть выражена через количество вещества, переходящего в единицу времени из одной фазы в другую. В этом случае, в соответствии с (В. 3) можно записать основное уравнение массопередачи в дифференциальном
или интегральном (для стационарных процессов) виде
Скорость массопередачи связана с механизмом переноса распределяемого вещества в фазах, между которыми происходит массообмен.
Перенос вещества в фазах может происходить либо путем молекулярной диффузии, либо конвекцией и молекулярной диффузией одновременно (конвективная диффузия).
Массопередача молекулярной диффузией осуществляется в неподвижной среде вследствие движения молекул, атомов и ионов.
Массопередача конвективной диффузией реализуется в движущейся среде. При этом если движение жидкости обусловлено градиентами температуры или концентрацией, то такая конвекция называется свободной, или естественной. Если движение вызвано внешними силами, конвекция является вынужденной.
В случае турбулентного движения жидкости, сопровождающегося массопередачей, в ряде случаев рассматривают турбулентный механизм переноса вещества, при котором оно переносится беспорядочными турбулентными пульсациями потока. Такой механизм называется турбулентной диффузией.
Молекулярная диффузия описывается первым законом Фика, в соответствии с которым количество продиффундировавшего вещества dМ пропорционально градиенту концентрации в направлении диффузии дс/дп, площади массопередачи dF, перпендикулярной направлению диффузионного потока и времени осуществления процесса dτ,
где 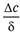
Коэффициент пропорциональности D в уравнениях (9.8) и (9.9) называется коэффициентом молекулярной диффузии и имеет размерность м 2 /с при с, кг/м 3 .
Коэффициент молекулярной диффузии показывает, какая масса вещества диффундирует в единицу времени через единицу поверхности при градиенте концентрации, равном единице. Значение коэффициента молекулярной диффузии зависит от природы и свойств как распределяемого вещества, таки среды, через которую он диффундирует, а также давления и температуры. Причем увеличению его значения способствует повышение температуры и уменьшение давления. Знак минус перед правой частью уравнения (9.8) указывает на то, что молекулярная диффузия протекает в направлении уменьшения концентрации распределяемого компонента.
В ряде случаев по аналогии с первым законом Фика, записывают уравнение, характеризующее массопередачу в результате турбулентной диффузии,
где Dтурб – коэффициент турбулентной диффузии, зависящий от гидродинамических условий протекания процесса — скорости потока и масштаба турбулентных пульсаций.
Конвективная диффузия характеризуется тем, что полный поток вещества складывается из конвективного и диффузионного потоков.
Поскольку конвективный перенос вещества осуществляется преимущественно потоками жидкости, его интенсивность учитывается компонентами скорости перемещения массы, диффузионная составляющая – коэффициентом молекулярной диффузии и суммой вторых производных концентраций по соответствующим координатам
Уравнение (9.10) является дифференциальным уравнением конвективной диффузии.
При массоо6мене в неподвижном слое проекции скорости на оси координат Wx = Wy = =Wz= 0, и уравнение (9.10) преобразуется в дифференциальное уравнение молекулярной диффузии (второй закон Фика)
Трудности теоретического описания и расчета процесса массопередачи обусловлены сложностью механизма переноса вещества к границе раздела фаз и от нее, недостаточной изученностью гидродинамических закономерностей турбулентных потоков, особенно вблизи границы раздела фаз.
|
В связи с этим предложен ряд теоретических моделей, в основу большинства которых положены допущения:
· общее сопротивление процессу массопередачи складывается из сопротивления распределяющих фаз. Сопротивлением поверхности разделав большинстве случаев можно пренебречь;
· на поверхности раздела фазы находятся в равновесии.
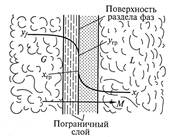
На рис. 9.4 представлена схема массопередачи между система ми жидкость – газ (пар) или жидкость — жидкость. Фазы разделены поверхностью раздела и движутся друг относительно друга с некоторой скоростью.
Процесс массопередачи заключается в переносе распределяемого вещества из фазы G к поверхности раздела фаз (процесс массоотдачи), а затем массоотдачи от поверхности раздела к фазе L.
Процесс массопередачи связан со структурой потока в каждой фазе, которая включает турбулентное ядро потока, где массоперенос осуществляется конвекцией и концентрация компонента практически постоянна. При приближении к поверхности раздела в пограничном слое происходит затухание пульсаций, преобладание механизма молекулярной диффузии, а следовательно, резкое уменьшение концентраций.
Для нахождения скорости перехода вещества из одной фазы к поверхности раздела фаз и далее от нее во вторую фазу используют уравнения массоотдачи, которые для схемы, представленной на рис. 9.4, можно записать как
где уf — угр и хгр — хf – движущие силы в процессах массоотдачи в фазах G и L; F – поверхность массопередачи; βy и βх – коэффициенты массоотдачи (β, м/с, при размерности единичной движу щей силы – кг/м 3 ).
Коэффициент массоотдачи показывает, какое количество вещества переходит из ядра потока к поверхности раздела (или наоборот) через единицу площади поверхности за единицу времени при движущей силе, равной единице, и зависит в первую очередь от гидродинамических условий.
Если равновесная линия массообменного процесса – прямая с тангенсом угла наклона Аравн, то между коэффициентами массопередачи Кy, Кх из уравнений (9.6) (9.7) и коэффициентами массоотдачи βy, βх из уравнений (9.11) (9.12) существует однозначная связь
Коэффициент массопередачи показывает, какое количество вещества переходит из одной фазы в другую за единицу времени через единицу площади поверхности контакта фаз при движущей силе массопередачи, равной единице. Размерность коэффициента массопередачи совпадает с размерностью коэффициента массоотдачи.
Поскольку величины, обратные значениям коэффициентов массопередачи, представляют собой общее сопротивление переносу вещества из фазы в фазу (В.3), то выражения в знаменателях уравнений (9.13) представляют сумму сопротивлении массоотдачи в фазах.
Для расчетов коэффициентов массоотдачи βх и βy чаще всего используют уравнения, которые получают на основании теории подобия.
Дата добавления: 2015-08-14 ; просмотров: 3510 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Материальный баланс
Составление баланса обычно ассоциируется с бухгалтерской отчетностью и непосредственно бухгалтерским балансом, в котором обеспечено равенство актива и пассива в силу двойной записи. Однако существуют и другие виды баланса, которые могут быть составлены в организации. Это материальный баланс, трудовой баланс, баланс денежных средств и прочие. Они не относятся напрямую к бухгалтерской отчетности, хотя также касаются определенных аспектов деятельности организации.
Что входит в понятие материального баланса
Этот вид баланса обычно составляют в производственных целях, и к бухгалтерской отчетности он никак не относится. Сам по себе материальный баланс служит подтверждением закона сохранения масс: он характеризует соотношение между количеством исходного материала, используемого на производстве, числом готовой продукции, полученных отходов, а также материальных потерь.
В виде формулы этот баланс обычно представляют как равенство между количеством выделенного для использования исходного материала и суммы всех остальных перечисленных факторов.
Показатели могут быть выражены в натуральных мерах измерения, например – килограммы или литры, так и в виде количества денежных средств. В каких-то ситуациях показатели, входящие в число составляющих материального баланса, могут отсутствовать. Тогда формула будет короче. Например, если в нее не включены материальные потери, которых не произошло в процессе производства.
Формула может быть расширена, если в число показателей вошел какой-то дополнительный признак, который тоже необходимо указать. Например, выпускать на фабрике могут не только основную продукцию, но и побочную или полуфабрикаты. Тогда их тоже включают в общую формулу в качестве отдельного пункта.
Таким образом, можно выделить несколько наиболее часто используемых в составлении материального баланса позиций:
- исходный материал – выступает обязательной составляющей формулы;
- готовая продукция – также входит в число обязательных пунктов;
- количество отходов;
- возможные материальные потери;
- возможная дополнительная продукция.
Формула может изменяться в зависимости от особенностей анализируемого производства. Как правило, такие расчеты составляют для рассмотрения чисто производственной деятельности и повышения эффективность управления материальными ресурсами в рамках организации.
Методичка ОХТ_2006. Методическое пособие по практическим занятиям для студентов специальностей 148 01 01 Химическая технология производства и переработки неорганических материалов
| Название | Методическое пособие по практическим занятиям для студентов специальностей 148 01 01 Химическая технология производства и переработки неорганических материалов |
| Анкор | Методичка ОХТ_2006.doc |
| Дата | 23.10.2017 |
| Размер | 1.11 Mb. |
| Формат файла |  |
| Имя файла | Методичка ОХТ_2006.doc |
| Тип | Методическое пособие #9744 |
| страница | 3 из 9 |
| Подборка по базе: Пневматика пособие.pdf, О. Ф. Алехина О. С. Гапонова основы менеджмента учебное пособие., Метод указания к семинарским занятиям по Педагогике.docx, Учебно-метод. пособие по истории 2021.pdf, учебное пособие профессиональная этика.pdf, Задания к практическим занятиям.docx, учебное пособие по диагностике оппортунистов от 19.02.21 г..docx, ОТВЕТЫ НА ЗАДАНИЯ ПО ПРАКТИЧЕСКИМ ЗАНЯТИЯМ .docx, Отчет по практическим работам.docx, Сагинова Уч пособие _zhylzhymaytyn mulik_ekonomikasy (1).pdf 2. материальный баланс химико-технологических процессов Материальный баланс основан на законе сохранения массы вещества, согласно которому масса веществ, поступивших в замкнутую систему, равна массе веществ на выходе из нее. Применительно к материальному балансу любого технологического процесса это означает, что масса веществ, поступивших на технологическую операцию, – приход, равна массе всех веществ, получившихся в результате ее, – расходу. Материальный баланс может быть представлен уравнением, левую часть которого составляет масса всех видов сырья и материалов, поступающих на переработку (Σmприх), а правую – масса получаемых продуктов плюс производственные потери (Σmрасх): Уравнение материального баланса может быть представлено в следующем виде: m где m1 и m2 массы поступившего газообразного, жидкого и твердого сырья и вспомогательного материала; m3, m4, m5 полученные целевой продукт, побочный продукт, отход соответственно; m6 непрореагировавшее сырье; m7 – производственные потери. Слагаемые прихода и расхода, число которых зависит от состава производственных потоков, называют статьями материального баланса. Материальный баланс – зеркало технологического процесса, отражающее расходные коэффициенты по сырью, наличие твердых отходов, газообразных выбросов, жидких стоков, состав образующихся продуктов. Чем подробнее изучен процесс, тем более полно можно составить материальный баланс. Составляют его по уравнению основной суммарной реакции с учетом параллельных и побочных реакций. Поскольку на практике приходится иметь дело не с чистыми веществами, а с сырьем сложного химического состава, то для составления материального баланса следует учитывать массу всех компонентов, входящих в его состав. Для этого пользуются данными химических анализов. Стехиометрические коэффициенты в химических уравнениях показывают количество моль компонентов, вступивших в химическое взаимодействие. Их можно выразить в массовых величинах, умножая стехиометрические коэффициенты на молярную массу. Например, окисление диоксида серы описывается уравнением SO2 + 0,5O2 SO3. Молярные массы, г/моль или кг/кмоль: SO2 – 64; O2 – 32; SO3 – 80, и это же уравнение с «массовыми» стехиометрическими коэффициентами будет иметь вид 64SO2 + 16O2 80SO3. В такой записи очевиден материальный баланс: суммарная масса исходных веществ равна массе продукта. Рассмотрим пример: в производстве азотной кислоты определить количество HNO3, образующейся из 1 т аммиака. В химико-технологическом процессе протекают следующие реакции: (принимаем, что NH3 полностью окисляется до NO); окисление оксида азота хемосорбция диоксида азота В абсорбционную колонну подается кислород, и образующийся оксид азота повторно окисляется до NO2 по реакции (27). Таким образом, образование азотной кислоты представлено стехиометрическими уравнениями (2628). Умножим первое из них на 1, второе – на 3, третье – на 2 и сложим их. Получим суммарное стехиометрическое уравнение (брутто-уравнение) Конечно, такая реакция не известна. Но стехиометрическое уравнение показывает, в каких соотношениях реагенты вступают во взаимодействие друг с другом, и этому определению отвечает уравнение (29). Умножим стехиометрические коэффициенты в (29) на мольные массы соответствующих компонентов (г/моль или кг/кмоль) (NH3 – 17; O2 – 32; HNO3 – 63; Н2О – 18) и получим Из уравнения (30) видно, что для производства 63 кг азотной кислоты надо затратить 17 кг аммиака, а на 1 т (1 000 кг) азотной кислоты пойдет 17 1000 / 63 = 270 кг NH3. Удобство записи суммарного стехиометрического уравнения очевидно. Сожжено 100 м 3 газовой смеси, содержащей 50 об. % пропана и 50 об. % бутана. Избыток воздуха по отношению к теоретически необходимому для сгорания составляет 20%. Составить материальный баланс процесса горения и рассчитать состав продуктов сгорания (об. %). При расчете принимаем, что воздух является смесью одного объема кислорода и 3,76 объема азота (т. е. молярное отношение О2 : N2 составляет 1 : 3,76). Объем 1 кмоль О2, N2 при н. у. равен 22,4 м 3 . Уравнения реакций горения имеют следующий вид: Исходя из состава воздуха и с учетом его избытка при сжигании газовой смеси, запишем общее уравнение реакции, принимая во внимание, что молярное соотношение пропана и бутана в смеси такое же, как объемное соотношение (т. е. 1 : 1): воздух для воздух для избыток воздуха сжигания пропана сжигания бутана Данное уравнение можно записать в следующем виде: Результаты материального баланса представлены в табл. 1. Стехиометрические балансы могут быть представлены в виде уравнений, согласно которым можно рассчитать степень превращения реагентов и их концентрацию в данный момент времени (табл. 2). где стехиометрический коэффициент; абсолютное значение стехиометрического коэффициента (для исходных веществ 0). Обозначим количество исходных веществ (в моль) перед началом реакции через na 0, nb 0, …, ni 0, …, а количество исходных веществ в данный момент реакции na, nb, …, ni, … . Когда исходные реагенты берутся в стехиометрическом соотношении, степени превращения каждого из них одинаковы. Если же исходные реагенты вступают в реакции не в стехиометрическом соотношении, то значение степени превращения х зависит от того, для какого вещества эта величина рассчитывается. Следовательно, так как соотношения количеств исходных реагентов могут быть нестехиометрическими, расчет будем вести по степени превращения одного, произвольно выбранного, исходного реагента, например K. хk = В соответствии со стехиометрическим уравнением (31), когда превращению подвергается 1 моль исходного вещества K, одновременно превращение претерпевает число молей исходного вещества I, равное ni 0 ni = Nj = В числителе и знаменателе выражения (32) написан знак «+», так как вместо i использовано i (для исходных веществ i | |||
| Т, С | 50 | 100 | 150 |
| Кр | 17,29 | 0,9042 | 0,0948 |
реакции получения хлористого изопропила из стехиометрической смеси пропилена и хлористого водорода по уравнению
Общее давление Р = 1 атм.
Рассчитать степень превращения пропилена 
Принимаем, что в реакцию вступают 1 моль пропилена и 1 моль хлористого водорода. После установления равновесия будет (1 – x) моль пропилена, (1 – x) моль хлористого водорода и x моль хлористого изопропила. Всего
http://buhguru.com/buhgalteria/materialnyj-balans.html
http://topuch.ru/metodicheskoe-posobie-po-prakticheskim-zanyatiyam-dlya-student/index3.html


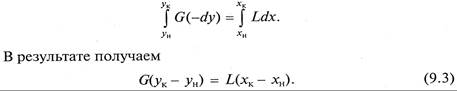
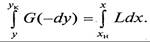
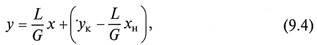

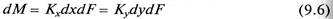

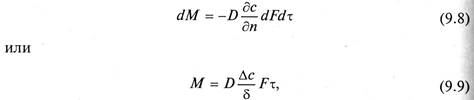
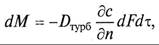
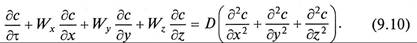
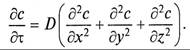

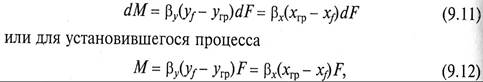
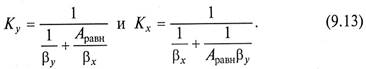

 + m
+ m  + m
+ m  + m
+ m  = m
= m  + m
+ m + m
+ m  + m
+ m + m7, (25)
+ m7, (25)


 .
. nk 0 хk.
nk 0 хk. . (32)
. (32)