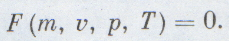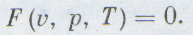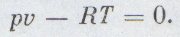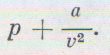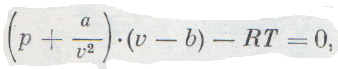Уравнение состояния вещества
Вы будете перенаправлены на Автор24
Параметры состояния связаны друг с другом. Соотношение, которое определяет эту связь, называется уравнением состояния этого тела. В простейшем случае равновесное состояние тела определяется значением тех параметров: давления p, объема V и температуры, массу тела (системы) обычно считают известной. Аналитически связь между этими параметрами выражают как функцию F:
Уравнение (1) называют при этом уравнением состояния. Это закон, который описывает характер изменения свойств вещества при изменении внешних условий.
Что такое идеальный газ
Особенно простым, но весьма информативным является уравнение состояния так называемого идеального газа.
Идеальным называют газ, в котором взаимодействием молекул между собой можно пренебречь.
К идеальным можно отнести разреженные газы. Особенно близки по своему поведению к идеальному газу гелий и водород. Идеальный газ представляет собой упрощенную математическую модель реального газа: молекулы считаются движущимися хаотически, а соударения между молекулами и удары молекул о стенки сосуда — упругими, такими, которые не приводя к потерям энергии в системе. Такая упрощенная модель очень удобна, так как не требует учитывать силы взаимодействия между молекулами газа. Большинство реальных газов не отличаются в своем поведении от идеального газа при условиях, когда суммарный объем молекул пренебрежимо мал по сравнению с объемом сосуда (т.е. при атмосферном давлении и комнатной температуре), что позволяет использовать уравнение состояния идеального газа в сложных расчетах.
Уравнение состояния идеального газа можно записать в нескольких видах (2), (3), (5):
Уравнение (2) — уравнение Менделеева — Клайперона, где m — масса газа, $\mu $ — молярная масса газа, $R=8,31\ \frac<Дж><моль\cdot К>$- универсальная газовая постоянная, $\nu \ $- количество молей вещества.
где N — число молекул газа в массе m, $k=1,38\cdot 10^<-23>\frac<Дж><К>$, постоянная Больцмана, которая определяет «долю» газовой постоянной приходящуюся на одну молекулу и
$N_A=6,02\cdot 10^<23>моль^<-1>$ — постоянная Авогадро.
Если разделить в (4) обе части на V, то получим следующую форму записи уравнения состояния идеального газа:
где $n=\frac
Что такое реальный газ
Обратимся теперь к более сложным системам — к неидеальным газам и жидкостям.
Готовые работы на аналогичную тему
Реальным газом называют газ, между молекулами которого существуют заметные силы взаимодействия.
В неидеальных, плотных газах взаимодействие молекул велико и его нужно учитывать. Оказывается, что взаимодействие молекул столь сильно усложняет физическую картину, что точное уравнение состояния неидеального газа не удается записать в простой форме. В таком случае прибегают к приближенным формулам, найденным полуэмпирический. Наиболее удачной такой формулой является уравнение Ван-деp-Ваальса.
Взаимодействие молекул имеет сложный характер. На сравнительно больших расстояниях между молекулами действуют силы притяжения. По мере уменьшения расстояния силы притяжения сначала растут, но затем уменьшаются и переходят в силы отталкивания. Притяжение и отталкивание молекул можно рассматривать и учитывать раздельно. Уравнение Ван-дер-Ваальса описывающее состояние одного моля реального газа:
где d — диаметр молекулы,
величина a вычисляется по формуле:
где $W_p\left(r\right)\ $- потенциальная энергия притяжения двух молекул.
С увеличением объема роль поправок в уравнении (6) становится менее существенной. И в пределе уравнение (6) переходит в уравнение (2). Это согласуется с тем фактом, что при уменьшении плотности реальные газы по своим свойствам приближаются к идеальным.
Достоинством уравнения Ван-деp-Ваальса является то обстоятельство, что оно при очень больших плотностях приближённо описывает и свойства жидкости, в частности плохую ее сжимаемость. Поэтому есть основание полагать, что уравнение Ван-деp-Ваальса позволит отразить и переход от жидкости к газу (или от газа к жидкости).
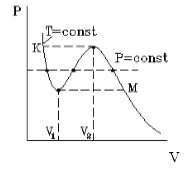
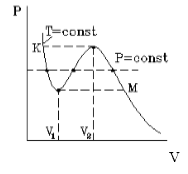
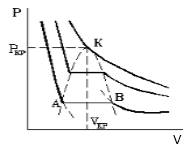
На рис.1 изображена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T, построенная из соответствующего уравнения.
В области «извилины» (участок КМ) изотерма трижды пересекает изобару. На участке [$V_1$, $V_2$] давление pастет с увеличением объема.
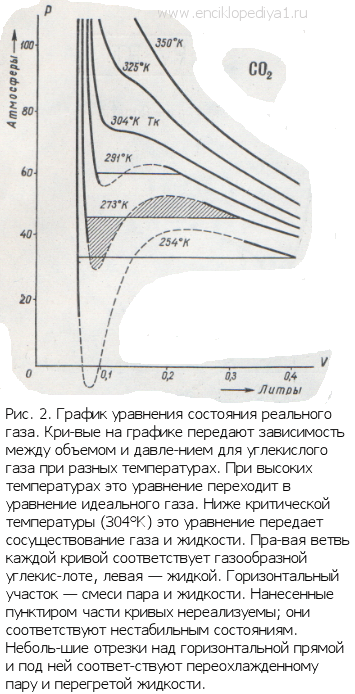
Такая зависимость невозможна. Это может означать, что в данной области с веществом пpоисходит что-то необычное. Что именно это, невозможно увидеть из уравнения Ван-деp-Ваальса. Необходимо обратиться к опыту. Опыт показывает, что в области «извилины» на изотерме в состоянии равновесия вещество расслаивается на две фазы: на жидкую и газообразную. Обе фазы сосуществуют одновременно и находятся в фазовом равновесии. В фазовом равновесии протекают процессы испарения жидкости и конденсации газа. Они идут с такой интенсивностью, что полностью компенсируют друг друга: количество жидкости и газа с течением времени остается неизменным. Газ, находящийся в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазового равновесия нет, нет компенсации испарения и конденсации, то газ называется ненасыщенным паром. Как же ведет себя изотерма в области двухфазного состояния вещества (в области «извилины» изотермы Ван-деp-Ваальса)? Опыт показывает, что в этой области при изменении объема давление остается постоянным. График изотермы идет параллельно оси V(рис 2).
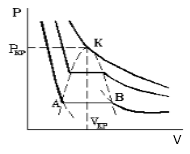
По мере увеличения температуры участок двухфазных состояний на изотермах сужается, пока не превратится в точку (рис. 2). Это особая точка К, в которой исчезает различие между жидкостью и паром. Она называется критической точкой. Параметры, соответствующие критическому состоянию, называются критическими (критическая температура, критическое давление, критическая плотность вещества).
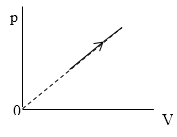
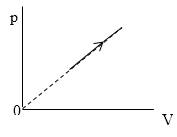
Задание: В процессе, который представлен на рисунке (рис.3) давление $p\sim T^n.\ $ Найти значение n.
Из графика, который приведен на рис. 3 запишем уравнение процесса в параметрах p(V):
\[p=kV\ или\ p\sim V\ (1.1)\]
Из уравнения Менделеева-Клайперона имеем:
Используем (1.1), подставим вместо объема, получим:
\[p^2\sim T\to p\sim \sqrt
Задание: Моль кислорода охлаждают до $-100^oС$. Определить давление, оказываемое газом на стенки сосуда, если занимаемый газом объем V = 0,1 л. Сравнить p с давлением идеального газа pid, если бы кислород вел себя как идеальный газ. Значения постоянных Ван-дер-Ваальса a и b, для кислорода $a=0,1358Па \cdot м^6/моль^2, b=3,167 \cdot 10^<-5>м^3/моль$
Решение: Из уравнения Ван-Дер-Ваальса следует, что:
Переведем температуру в СИ: T=t+273, По условию $T=173K, V = 0,1 л=10^<-4>м^3$
Для идеального газа:
Проведем расчет: $p_
Ответ: $p\approx 0,53p_
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 16 12 2021
Уравнение состояния вещества
Параметры состояния связаны друг с другом. Соотношение, при котором определяется данная связь, называют уравнением состояния данного тела. В самом простом случае равновесное состояние тела определяется значением следующих параметров: давления p , объема V и температуры (масса тела или системы, как правило, известна).
Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
Уравнение состояния идеального газа запишем несколько раз ( 2 ) , ( 3 ) , ( 5 ) :
p V = m μ R T = ν R T ( 2 ) .
Уравнение ( 2 ) – уравнение Менделеева-Клапейрона, где m – это масса газа, μ – это молярная масса газа, R = 8 , 31 Д ж м о л ь · К – это универсальная газовая постоянная, ν – это число молей вещества.
где N – это количество молекул газа в массе m , k = 1 , 38 · 10 — 23 Д ж К , постоянная Больцмана, определяющая «долю» газовой постоянной, которая приходится на 1 молекулу и
N A = 6 , 02 · 10 23 м о л ь — 1 – это постоянная Авогадро.
Если поделить в ( 4 ) обе части на V , то получаем следующий вид записи уравнения состояния идеального газа:
где n = N V – это количество частиц в единице объема или же концентрация частиц.
Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
p + a V μ 2 V μ — b = R T ( 6 ) ,
где a V μ 2 – это внутреннее давление, обусловленное силами притяжения между молекулами, b – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
b = N A 2 3 πd 3 ( 7 ) ,
где d – это диаметр молекулы. Значение a рассчитывается по формуле:
a = — 2 πN A 2 ∫ d ∞ W p ( r ) r 2 dr ( 8 ) ,
где W p ( r ) – это потенциальная энергия притяжения 2 -х молекул.
При увеличении объема значение поправок в уравнении ( 6 ) становится менее существенным. И в пределе уравнение ( 6 ) превращается в уравнение ( 2 ) . Это согласовано с тем фактом, что с уменьшением плотности реальные газы по своим характеристикам приближаются к идеальным.
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
На рисунке 1 представлена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T , которая построена из соответствующего уравнения.
В месте “извилины” (участок КМ) изотерма 3 раза пересекает изобару. На участке
V 1 , V 2 давление увеличивается с ростом объема.
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на 2 фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте «извилины» изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси V (рисунок 2 ).
С увеличением температуры участок двухфазных состояний на изотермах уменьшается до тех пор, пока не превращается в точку (рисунок 2 ). Это особая точка К , в которой исчезает разница между жидкостью и паром. Ее называют критической точкой.
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
Необходимо найти величину n . В процессе, представленном на рисунке 3 , давление p
Из графика, приведенного на рисунке 3 , запишем уравнение процесса в параметрах p ( V ) :
С учетом уравнения Менделеева-Клайперона:
V вместо объема, получаем:
Моль кислорода охлаждают до — 100 ° C . Необходимо определить давление, которое оказывает газ на стенки сосуда, если занимаемый газом объем V = 0 , 1 л . Необходимо также сравнить p с давлением идеального газа p i d , если бы кислород вел себя как идеальный газ. Величина постоянных Ван-дер-Ваальса a и b , для кислорода a = 0 , 1358 П а · м 6 / м о л ь 2 , b = 3 , 167 · 10 — 5 м 3 / м о л ь .
Из уравнения Ван-Дер-Ваальса имеем:
p = R T V μ — b — a V μ 2
Переведем температуру в систему измерения: T = t + 273 , По условию T = 173 K , V = 0 , 1 л = 10 — 4 м 3 .
Произведем расчет: p = 8 , 31 · 173 ( 10 — 3 , 2 ) · 10 — 5 — 0 , 1358 ( 10 — 4 ) 2 = 75 , 61 · 10 5 ( П а ) .
Для идеального газа:
Рассчитаем: p i d = 1 · 8 , 31 · 173 10 — 4 = 143 · 10 5 ( П а ) .
—> Детская Энциклопедия —>
Уравнение состояния
И химику, и теплотехнику, и физику, и конструктору новых космических кораблей мало знать общие закономерности поведения системы вообще. Им нужно рассчитывать совершенно конкретные задачи: один хочет знать, с помощью какой химической реакции он сможет получить новое соединение дешевле и проще; другому необходимо еще более повысить коэффициент полезного действия у двигателя; физик, например, мечтает достичь настолько высоких температур, чтобы можно было осуществить начало термоядерной реакции; космонавтам необходимы еще более тяжелые космические корабли, и им нужно новое топливо, еще более мощное и с большим тяговым усилием.
Это примеры очень важных, имеющих огромное значение процессов, в них принимают участие определенные реальные вещества. И свойства этих веществ должны входить в термодинамические расчеты.
Для этого нужно знать уравнение состояния вещества. Его нельзя получить при помощи термодинамики. Оно должно быть найдено другим, независимым путем — либо точными измерениями, либо теоретически.
Уравнение состояния необходимо термодинамике знать заранее, без него она ничего не может рассчитать. Оно позволяет рассчитать для определенного вещества любую из четырех важнейших величин — количество вещества (т), его объем (v), давление (р) или температуру (Т), если известны три остальные величины:
Удобнее рассматривать всегда один моль газа, тогда уравнение состояния будет проще:
Каждый школьник знает уравнение состояния идеальных газов, его вывел впервые петербургский профессор француз Клапейрон:
Такое допущение определяет область, в которой применяется это уравнение: при низком давлении газ занимает настолько большой объем, что объемом самих молекул можно смело пренебречь, а при высокой температуре молекулы обладают такой большой энергией и такой большой скоростью, что взаимное притяжение не влияет на их движение.
Конечно, в действительности нельзя пренебрегать ни собственными размерами молекул, ни их взаимным притяжением. 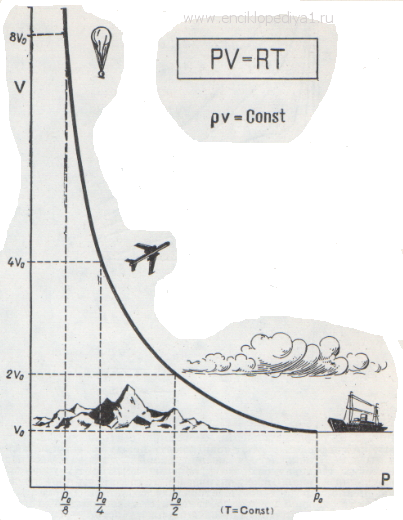
Эти поправки ввел в уравнение идеального газа голландский ученый Ван-дер-Ваальс. Он предложил уравнение
Таким образом, в совокупности свойств, характеризующих состояние системы, нельзя
произвольно менять значения всех свойств. Эти значения связаны между собой уравнением. Уравнение состояния обязательно нужно знать, только при этом условии возможно успешно использовать замечательный математический аппарат термодинамики.
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/uravnenie-sostojanija-veschestva/
http://enciklopediya1.ru/index/0-729