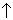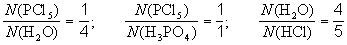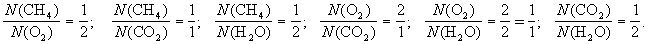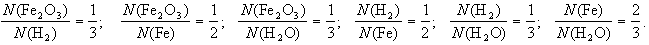Химические уравнения.
Химическое уравнение – это условное изображение химической реакции с помощью химических формул веществ, числовых коэффициентов и математических символов.
При записи химических уравнений должен строго соблюдаться закон сохранения массы: массы вступивших в реакцию веществ, равны массе продуктов реакции.
Химическая реакция – процесс, при котором вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и свойствами. При этом в составе атомных ядер изменений не происходит.
Химические реакции всегда сопровождаются физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ.
Пример составления химического уравнения:
слева 2 атома Fe – справа 1 атом Fe (множитель 2)
слева 3 атома O – справа 1 атом O (множитель 3)
Затем подбирается коэффициент для H2O:
слева 2 атома H – справа 2 атома H (множитель 1), но т.к. справа 3 атома O, то множитель для H2O получаем 3. Н в правой части уравнения имеет множитель 6, для равновесия Н, в левой части используем множитель 3.
Итоговое химическое уравнение:
Выпадение осадка в результате химической реакции обозначается в химическом уравнении стрелкой вниз ↓. Это означает, что соединение нерастворимо:
Выделение газа в результате химической реакции обозначается в химическом уравнении стрелкой вверх ↑.
Виды химических реакций.
Реакции соединения: хотя бы два элемента образуют один продукт:
Реакции разложения: вещество распадается на два или более простых элемента (соединения):
Реакция замещения: обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе:
Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакция обмена: реагенты и продукты реакции являются сложными веществами:
Урок 8 Бесплатно Химическая реакция- уравнение и типы
Начало
Продолжим изучение химической реакции как одной из основ химической науки.
Ведь полноценное понимание этой темы нужно для дальнейшего изучения химии, и в то же время это сделает вас образованнее не только в научном плане, но и в бытовом!
Уравнение химической реакции
Вся информация о протекающей химической реакции (исходные вещества, продукты реакции, условия протекания, тепловой эффект) на письме фиксируется в виде уравнения реакции.
Уравнение можно записать для любой реакции. Для этого нужно знать состав молекул исходных веществ и продуктов.
Всё это записывается в виде химических формул.
Всё происходит как в математике: в левой части записываются формулы исходных веществ, а в правой – формулы продуктов.
Только вместо знака «равно» чаще всего ставят стрелку: она показывает, что реакция идёт именно в этом направлении.
У меня есть дополнительная информация к этой части урока!
В некоторых случаях возможно протекание реакции при одних и тех же условиях в обоих направлениях. В таком случае обычно ставят две стрелки в обе стороны, но также и допустимо ставить знак «равно».
В некоторых случаях (когда это требуется) указывают условия протекания реакции и тепловой эффект реакции.
Условия протекания записывают над стрелкой, а тепловой эффект – в виде количества теплоты в левой части, если реакция эндотермическая, и в правой части, если экзотермическая.
Для примера запишем уравнение реакции водорода с кислородом:
Зигзаг обозначает искру – условие для начала реакции, а «+ Q» – то, что в результате реакции выделяется энергия.
В зависимости от конкретных задач условия протекания и тепловой эффект могут вообще не отмечать или отмечать конкретное числовое значение теплового эффекта.
Если среди продуктов реакции есть газ, около его формулы пишут стрелку вверх.
Например, когда мы капаем на рану перекись водорода, под действием ферментов крови она разлагается с выделением кислорода:
У меня есть дополнительная информация к этой части урока!
Кислород обладает обеззараживающим действием и способствует более быстрой свёртываемости крови!
Перекись водорода может разлагаться не только под воздействием ферментов крови, но и многих других веществ.
Разложение перекиси водорода в присутствии оксида марганца (IV) (Оксид марганца (IV) в химической реакции не участвует).
Если реакция идет в растворе и в результате выпадает осадок, то пишут стрелку вниз.
Садовые деревья весной обрабатывают от паразитов «бордосской жидкостью». Чтобы её приготовить, смешивают растворы извести и медного купороса.
При этом наблюдается выпадение хлопьев, которые состоят сразу из двух нерастворимых веществ: гидроксида меди и сульфата кальция.
Получившийся сульфат кальция, гипс, образует корку, которая будет дольше держаться на стволе дерева, и поэтому такая смесь дольше защищает его от вредителей.
Запишем уравнение этой реакции
Как правильно читать уравнение химической реакции?
В химии принято делать это примерно так: «один моль сульфата меди реагирует с одним молем гидроксида кальция с образованием одного моля гидроксида меди и одного моля сульфата кальция».
То есть коэффициент перед формулой вещества считают количеством вещества в молях, а не количеством молекул.
Ведь в реальной жизни мы наблюдаем реакцию не единичных молекул, а большого объема веществ.
При составлении уравнений химики опираются на два основных закона природы: закона сохранения массы и закона постоянства состава веществ.
Пройти тест и получить оценку можно после входа или регистрации
Что в химическом уравнении обозначает стрелка вверх
При химических реакциях одни вещества превращаются в другие. Вспомним известную нам реакцию серы с кислородом. И в ней из одних веществ (исходных веществ или реагентов) образуются другие (конечные вещества или продукты реакции).
Для записи и передачи информации о химических реакциях используются схемы и уравнения реакций.
Схема химической реакции – условная запись,дающая качественнуюинформацию о химической реакции.
Схема реакции показывает, какие вещества вступают в реакцию и какие образуются в результате реакции. И в схемах, и в уравнениях реакций вещества обозначаются их формулами.
Схема горения серы записывается так: S8 + O2 SO2.
Это означает, что при взаимодействии серы с кислородом протекает химическая реакция, в результате которой образуется диоксид серы (сернистый газ). Все вещества здесь молекулярные, поэтому при записи схемы использованы молекулярные формулы этих веществ. То же относится и к схеме другой реакции – реакции горения белого фосфора:
P4 + O2 P4O10.
При нагревании до 900 o С карбоната кальция (мела, известняка) протекает химическая реакция: карбонат кальция превращается в оксид кальция (негашеную известь) и диоксид углерода (углекислый газ) по схеме:
CaCO3 CaO + CO2.
Для указания на то, что процесс происходит при нагревании, схему (и уравнение) обычно дополняют знаком » t« , а то, что углекислый газ при этом улетучивается, обозначают стрелкой, направленной вверх:
CaCO3 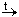
Карбонат кальция и оксид кальция – вещества немолекулярные, поэтому в схеме использованы их простейшие формулы, отражающие состав их формульных единиц. Для молекулярного вещества – углекислого газа – использована молекулярная формула.
Рассмотрим схему реакции, протекающей при взаимодействия пентахлорида фосфора с водой: PCl5 +H2O H3PO4 + HCl.
Из схемы видно, что при этом образуется фосфорная кислота и хлороводород.
Иногда для передачи информации о химической реакции бывает достаточно и краткой схемы этой реакции, например:
S8 SO2; P4 P4O10; CaCO3 CaO.
Естественно, что краткой схеме может соответствовать и несколько разных реакций.
Уравнение химической реакции – условная запись, дающая качественную и количественную информацию о химической реакции.
Для любой химической реакции справедлив один из важнейших законов химии:
При протекании химических реакций атомы не появляются, не исчезают и не превращаются друг в друга.
При записи уравнений химических реакций, кроме формул веществ, используются коэффициенты. Как и в алгебре, коэффициент «1» в уравнении химической реакции не ставится, но подразумевается. Рассмотренные нами реакции описываются следующими уравнениями:
Знак равенства между правой и левой частью уравнения означает, что число атомов каждого элемента, входящих в состав исходных веществ, равно числу атомов этого элемента, входящих в продукты реакциии.
Коэффициенты в уравнении химической реакции показывают отношение между числом реагирующих и числом образующихся молекул (для немолекулярных веществ – числом формульных единиц) соответствующих веществ. Так, для реакции, протекающей при взаимодействии пентахлорида фосфора с водой
и так далее (всего 6 пропорций).Обычно отдельный коэффициент в уравнении реакции не имеет никакого смысла, но в некоторых случаях может означать число молекул или формульных единиц данного вещества.Примеры информации, даваемой схемами и уравнениями реакций.
1-й пример. Реакция горения метана в кислороде (или на воздухе):
СН4 + O2 CO2 + H2O (схема),
СН4+ 2O2 = CO2 + 2Н2О (уравнение).
Схема химической реакции показывает, что (1) в реакции, протекающей между метаном и кислородом, образуются углекислый газ и вода.
Уравнение реакции добавляет, что (2) число молекул метана, вступившего в реакцию, относится к числу молекул вступившего в реакцию кислорода, как 1 к 2, и так далее, то есть:
Кроме того, уравнение показывает, что одна молекула метана реагирует с двумя молекулами кислорода, при этом образуется одна молекула углекислого газа и две молекулы воды.
2-й пример. Восстановление железа водородом из его оксида:
Fe2O3 + H2 Fe + H2O (схема),
Fe2O3 + 3H2 = 2Fe + 3H2О (уравнение).
Схема химической реакции показывает, что (1) при взаимодействии оксида железа(Fe2O3) с водородом (которое происходит при нагревании) образуются железо и вода.
Уравнение добавляет к этому, что (2) число формульных единиц оксида железа, вступившего в реакцию, относится к числу вступивших в реакцию молекул водорода, как 1 к 3, и так далее. То есть:
Кроме того уравнение показывает, что одна формульная единица оксида железа реагирует с тремя молекулами водорода, при этом образуется два атома железа и три молекулы воды.
Как вы узнаете в дальнейшем, уравнения реакций дают нам и другую количественную информацию.
| Карбонат кальция – CaCO3. Бесцветное немолекулярное вещество, нерастворимое в воде. Такие широко известные горные породы, как мрамор и известняк, состоят в основном из карбоната кальция. Мел, которым вы пишете на доске, – тоже карбонат кальция: многие морские организмы (радиолярии и др.) строят свои панцири из этого вещества; за длительное время на дне океана формируются залежи мела, представляющего собой огромные слои спрессованных панцирей этих организмов. Карбонат кальция не обладает способностью плавиться – при нагревании он разлагается. Горные породы, образуемые карбонатом кальция, используются в строительстве в качестве отделочных материалов, строительного камня, а также для производства негашеной извести (CaO). В металлургии карбонат кальция в виде известняка добавляют в руду для лучшего образования шлаков. |

1.Запишите уравнения, соответствующие следующим схемам реакций:
а) Na+ Cl2 NaCl; б) CuO + Al Al2O3 + Сu;
в) N2O N2 + O2; г)NaOH + H2SO4 Na2SO4 + H2O.
2.Какую информацию передают составленными вами уравнениями реакций (среди приведенных веществ молекулярными являются Cl2, N2О, N2, O2, H2SO4 и H2O; остальные – немолекулярные).
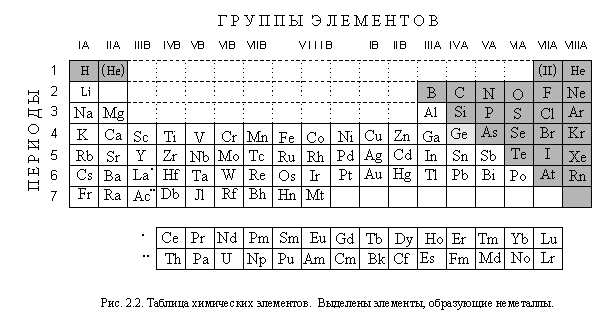
Вы уже познакомились в той или иной степени примерно с пятьюдесятью индивидуальными (чистыми) химическими веществами. Всего же науке известно несколько миллионов таких веществ. Чтобы не утонуть в этом » море» веществ, их необходимо систематизировать и прежде всего классифицировать – классифицировать более подробно, чем мы делали это в параграфе 1.4 (рис. 1.3).
Вещества отличаются друг от друга своими свойствами, а свойства веществ определяются составом и строением. Поэтому важнейшие признаки, по которым классифицируют вещества – состав, строение и свойства.
По составу, а точнее, по числу входящих в их состав элементов, вещества делятся на простые и сложные (это вы уже знаете). Сложных веществ в сотни тысяч раз больше, чем простых, поэтому среди них выделяют бинарные вещества (бинарные соединения).
Бинарные вещества (бинарные соединения) – сложные вещества,в состав которых входят атомы двух элементов.
Схема этой классификации приведена на рисунке 2.1.
Признаком, по которому проводят дальнейшую классификацию веществ, являются их свойства.
Начнем с простых веществ.
По физическим свойствам простые вещества делятся на металлы и неметаллы.
Характерные физические свойства металлов:
1) высокая электропроводность (способность хорошо проводить электрический ток),
2) высокая теплопроводность (способность хорошо проводить теплоту),
3) высокая пластичность (ковкость, изгибаемость, вытягиваемость).
Кроме того все металлы обладают » металлическим» блеском. Но следует помнить, что таким блеском обладают не только металлы, но и часть неметаллов, и даже некоторые сложные вещества. Блестит кристаллический кремний, одна из полиморфных модификаций мышьяка, теллур, а это всё – неметаллы. Из сложных веществ – пирит FeS2, халькопирит CuFeS2 и некоторые другие.
Основой систематизации химических элементов, простых веществ и соединений служит ЕСТЕСТВЕННАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, открытая в 1869 году выдающимся русским химиком Дмитрием Ивановичем Менделеевым (1834 –1907) и названная им » периодической системой» . Усовершенствованная многими поколениями ученых, эта система продолжает называться » периодической» , хотя это и не совсем правильно. Графически система химических элементов выражается в виде таблицы элементов (рис. 2.2); со строением этой таблицы вы подробно познакомитесь, изучая главу 6. Пока же посмотрим, где в таблице элементов расположены элементы, образующие неметаллы, а где – элементы, образующие металлы. Оказывается, элементы, образующие неметаллы, группируются в правом верхнем углу таблицы элементов. Все остальные элементы – элементы , образующие металлы. Причину этого вы узнаете, изучив строение атомов и химические связи.
При комнатной температуре металлы – твердые вещества (исключение – ртуть, ее температура плавления – 39 o С).
В отличие от металлов, неметаллы не обладают каким-либо определенным набором характерных физических характеристик. Даже агрегатное состояние у них может быть разным. При комнатной температуре газообразныдвенадцать простых веществ (Н2, Не, N2, O2, O3, F2, Nе, Cl2, Аr, Кr, Хе, Rn), жидкость одна (Br2), а твердых веществ – более десяти (В, С(алмаз), С(графит), Si, P4, S8, As, Se, Те, I2 и др.). По своим химическим свойствам большинство металлов сильно отличается от большинства неметаллов, но резкой границы между ними нет.
Многие простые вещества при определенных условиях могут вступать в реакции друг с другом, например:
В результате таких реакций образуются бинарные соединения.
В принципе, в состав бинарного соединения могут входить любые элементы (кроме гелия и неона). Но часто один из этих элементов – кислород, водород или один из галогенов (фтор, хлор, бром или йод). Такие вещества называются кислородными соединениями, водородными соединениями или галогенидами. Примеры бинарных соединений: CaO, Al2O3, КН, HCl, АlI3, СаС2.
| Кислородное соединение – бинарное соединение, один из элементов в котором кислород. |
Примеры кислородных соединений: H2O (вода), H2O2 (пероксид водорода), Na2O (оксид натрия), Na2O2 (пероксид натрия), СО2 (диоксид углерода), OF2 (фторид кислорода). Большинство кислородных соединений является оксидами. Чем оксиды отличаются от остальных кислородных соединений, вы узнаете позже.
Примеры оксидов:
Li2O – оксид лития, CO2 – диоксид углерода, CaO – оксид кальция, SiO2 – диоксид кремния, Al2O3 – оксид алюминия, Н2О – вода,
MnO2 – диоксид марганца, SO3 –триоксид серы.
| Водородное соединение – бинарное соединение, один из элементов в котором водород. |
Примеры водородных соединений: NаН – гидрид натрия, H2O – вода, КН – гидрид калия, НСl – хлороводород, СаH2 – гидрид кальция,
NH3 – аммиак, BaH2 – гидрид бария, CH4 – метан.
Галогенид (фторид, хлорид, бромид или – бинарное соединение,один из элементов в котором – галоген.
Примеры галогенидов: CaF2 – фторид кальция, BF3 – трифторид бора, NaCl – хлорид натрия,PCl5 – пентахлорид фосфора, КВr – бромид калия, НВr – бромоводород, AlI3 – йодид алюминия, HI – йодоводород.
Примеры названий бинарных соединений приведены в таблице 6.
http://ladle.ru/education/himia/8class/himicheskaya-reakciya15
http://www.chem.msu.su/rus/school/zhukov1/02a.html