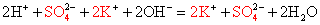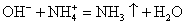Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

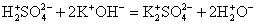
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
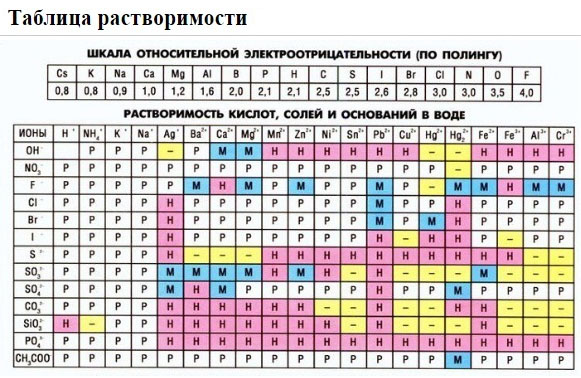
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
Что выражает сокращенное ионное уравнение реакции
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Что выражает сокращённое ионное уравнение реакции? Сущность реакции ионного обмена.
В чём его отличие от молекулярного уравнения? Молекулярное уравнение, в отличие от ионного, не отражает все процессы, происходящие в растворах.
Задание 2
С какими из перечисленных веществ реагирует соляная кислота: нитрат калия, нитрат серебра (I), гидроксид калия, оксид углерода (IV), оксид меди (II), гидроксид железа (III)? Напишите уравнения реакций в молекулярном, полном и сокращённом ионном виде.
HCl + AgNO3 = AgCl↓ + HNO3
H + + Cl — + Ag + + NO3 — = AgCl↓ + H + + NO3 —
Ag + + Cl — = AgCl↓
CuO + 2HCl = CuCl2 + H2O
CuO + 2H + + 2Cl — = Cu 2+ + 2Cl — + H2O
CuO + 2H + = Cu 2+ + H2O
Задание 3
Какую реакцию называют реакцией нейтрализации? Реакцию между кислотой и основанием.
Какая соль образуется при нейтрализации азотной кислоты гидроксидом кальция? Нитрат кальция Ca(NO3)2.
Напишите уравнение реакции.
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
Задание 4
При смешивании двух бесцветных растворов — нитрата ртути (II) и иодида калия выпадает ярко-красный осадок иодида ртути (II) (рис. 32). Напишите уравнение реакции в молекулярном, полном и сокращённом ионном виде.
Ag(NO3)2 + 2KI = AgI2↓ + 2KNO3
Ag + + 2NO3 — + 2K + + 2I — = AgI2↓ + 2K + + 2NO3—
Ag + + 2I — = AgI2↓
Задание 5
При действии на сульфид железа (II) соляной кислотой наблюдается выделение газа сероводорода H2S. Напишите уравнение реакции в молекулярном, полном и сокращённом ионном виде.
FeS + 2HCl = FeCl2 + H2S↑
FeS + 2H + + 2Cl — = Fe 2+ + 2Cl — + H2S↑
FeS + 2H + = Fe 2+ + H2S↑
Задание 6
Какую область химии называют аналитической? Область химии, занимающуюся определением качественного и количественного состава неизвестных веществ, называют аналитической химией.
Что такое качественный, количественный анализ? Качественный анализ отвечает на вопрос, из атомов каких элементов состоит то или иное вещество, а количественный анализ позволяет определить соотношение атомов, образующих соединение, а также ответить на вопрос, сколько того или иного вещества содержится в данном образце. В основе качественного определения некоторых ионов лежат реакции, заканчивающиеся образованием осадков.
Задание 7
Какие ионы выступают реагентами на хлорид-ионы? Ионы нитрата серебра.
По каким признакам можно судить о наличии в растворе хлорид-ионов? По образованию белого творожистого осадка хлорида серебра AgCl↓
Задание 8
Реактивом на сульфат-ионы служат растворимые соли бария, образующие с сульфат-ионами белый кристаллический осадок сульфата бария, нерастворимый в кислотах. Напишите уравнение реакции взаимодействия серной кислоты с раствором хлорида бария в молекулярном, полном и сокращённом ионном виде.
BaCl2 + H2SO4= BaSO4↓ + 2HCl
Ba 2+ + 2Cl — + 2H + + SO4 2- = BaSO4↓ + 2H + + 2Cl —
Ba 2+ + SO4 2- = BaSO4↓
Задание 9
Напишите два уравнения реакций в молекулярном виде, отвечающие сокращённому ионному уравнению
H + + ОН – = H2O
NaOH + HCl = NaCl + H2O
2KOH + H2SO4 = K2SO4 + H2O
Задание 10
Какая масса 10%-го раствора гидроксида натрия потребуется для полной нейтрализации 98 г 10%-го раствора серной кислоты?
Дано: m(р-ра H2SO4)=90 г, ω1(H2SO4)=10%, ω2(NaOH)=10%
Найти: m(р-ра NaOH)-?
Решение
1. Вычисляем массу серной кислоты в растворе.
m(H2SO4)=m1(р-ра H2SO4)•ω(H2SO4):100%=98 г • 10%:100%=9,8 г
2. Количество вещества серной кислоты рассчитываем по формуле: n=m/M, где M ― молярная масса
M(H2SO4)=98 г/моль
n(H2SO4)=m( H2SO4 )/M( H2SO4 )=9,8 г : 98 г/моль=0,1 моль
3. Составим химическое уравнение: 2NaOH + H2SO4 = Na2SO4 + H2O
По уравнению реакции n(NaOH)/2=n(H2SO4)/1, поэтому
n(NaOH)=2 • n(H2SO4)=2 •0,1 моль = 0,2 моль
4. Массу гидроксида натрия рассчитываем по формуле: m=n•M, где M ― молярная масса.
M(NaOH)=40 г/моль
m( NaOH )=n( NaOH )•M( NaOH )=0,2 моль • 40 г/моль=8 г
5. Вычисляем массу раствора гидроксида натрия.
m(р-ра NaOH)= m(NaOH):ω(NaOH) •100% =8 г : 10% • 100%=80 г
Ответ: m(р-ра NaOH)= 80 г
Задание 11
Какой объём газа (н.у.) выделится при действии на 13,2 г сульфида железа (II) соляной кислотой?
Дано: m(FeS)=13,2 г
Найти: V(H2S)-?
Решение
1. Количество вещества сульфида железа рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(FeS)=88 г/моль
n(FeS)=m(FeS):M(FeS)=13,2 г : 88 г/моль=0,15 моль
2. Составим химическое уравнение: FeS + 2HCl = FeCl2 + H2S ↑
По уравнению реакции n(FeS)/1=n(H2S)/1, поэтому
n(H2S)=n(FeS)=0,15 моль
3. Объём сероводорода рассчитываем по формуле: V=n•Vm, где Vm ― молярный объём.
V( H2S )=n( H2S )•Vm=0,15 моль•22,4 л/моль=3,36 л
Ответ: V(H2S)=3,36 л
Задание 12
Предложите схему опыта, позволяющего определить наличие в водопроводной воде ионов:
а) кальция;
Реактив ― углекислый газ. Наблюдаем растворение малорастворимого осадка CaCO3.
CaCO3 ↓ + H2O + CO2 = Ca(HCO2)2
б) железа (III);
Реактив ― щелочь. Наблюдаем образование бурого осадка Fe(OH)3 ↓ .
Fе 3+ + 3OH — = Fe(OH)3 ↓
в) SO4 2- ;
Реактив ― cоли бария. Наблюдаем образование белого осадка BaSO4 ↓ , нерастворимого в кислоте.
Ba 2+ + SO4 2- = BaSO4 ↓
г) CO3 2- .
Реактив ― сильная кислота. Наблюдаем бурное выделение газа.
CO3 2- + 2H + = H2O + CO2 ↑
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
http://gdz.cool/h11_edl_2019/1228-h11_e_2019_9.html
http://chemege.ru/reakcii-ionnogo-obmena/