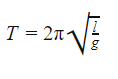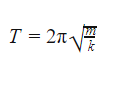Что является фазой в уравнении
Любая гетерогенная система состоит из отдельных гомогенных, физически или химически различных, механически отделимых друг от друга частей, называемых фазами. Например, насыщенный раствор хлорида натрия с кристаллами NaCl в осадке и водяным паром над раствором — это система, состоящая из 3 фаз: жидкого раствора, твердой соли и газообразной воды. Фазы имеют различный химический состав и физические свойства и могут быть разделены чисто механическими операциями: раствор можно отфильтровать от осадка, а пар собрать в любом свободном объеме системы.
Фаза — это совокупность всех гомогенных частей гетерогенной системы,
отделенная от других частей системы четкими поверхностями раздела
(межфазными границами).
Химический состав и свойства остаются постоянными внутри объема, занимаемого фазой. При переходе через межфазную границу состав и свойства меняются скачком. Поскольку газы полностью смешиваются друг с другом, в системе может быть только одна газовая фаза, но много твердых и жидких несмешивающихся фаз.
Числом компонентов — К, называется наименьшее число независимо
изменяющихся веществ, с помощью которых можно описать состав каждой
фазы в системе в отдельности.
Это определение легко применить, когда вещества не реагируют друг с другом. Так, смесь воды и этанола – двухкомпонентная система. Ситуация усложняется, когда химическая реакция приводит к равновесию между веществами в системе. Число компонентов меньше числа веществ, образующих систему, потому что при равновесии концентрации различных веществ связаны определенными соотношениями. Существуют два типа уравнений связи:
- уравнения химического равновесия,
- дополнительные условия, которые связывают концентрации веществ или состав фаз.
где s — число веществ,
n — число независимых химических реакций,
m — число соотношений между концентрациями веществ или составами фаз.
Приведем другой метод определения числа независимых компонентов. Пусть имеется система из нескольких фаз в равновесии, и пусть химическим анализом определен состав каждой фазы. Если все фазы имеют одинаковый состав, то система состоит только из одного компонента. Если две фазы должны быть соединены друг с другом, чтобы получить состав третьей фазы, то имеется система из двух компонентов; если необходимы три фазы, чтобы дать состав четвертой — то в системе три компонента и т.д.
Выбор компонентов зачастую произволен, но число компонентов К — величина фиксированная, она является важной характеристикой системы при данных условиях.
Пример 1. Твердый оксид кальция, твердый карбонат кальция и газообразный диоксид углерода находятся в равновесии. Общее число веществ s=3. Число независимых компонентов уменьшается на единицу ( т.е. К=s-n=3-1=2 ), благодаря наличию химического равновесия, в котором участвуют три фазы:
CaCO3 (тв.) CaO(тв.) + CO2(газ) . (2)
Равновесие описывается следующей константой:
т.к. активности твердых веществ равны единице (CaCO3 и CaO нерастворимы друг в друге). Данная константа не зависит от количеств карбоната и оксида кальция, принимающих участие в равновесии. Следовательно, система остается двухкомпонентной и в том случае, когда СаО и СО2 получаются при диссоциации СаСО3. Эти рассуждения будут справедливы для разложения любого твердого вещества с образованием газообразной и твердой фазы другого состава. Карбонат кальция представляет пример вещества, которое испаряется с разложением, или инконгруэнтно. В данном случае вполне естественно в качестве независимых компонентов выбрать СаО и СО2. Возможны и другие пары компонентов: СаСО3 и СаО, СаСО3 и СО2.
Пример 2. Водород и кислород находятся в равновесии с водяным паром ( s=3, n=1 ). В этой однофазной системе существует два независимых компонента (H2O и O2, H2O и H2 или H2 и O2), потому что состав третьего определяется из уравнения равновесия:
2 H2O(газ) 2 H2(газ) + O2(газ) . (4)
Если указаны дополнительные условия, то число компонентов уменьшается до единицы ( K=s-n-m=3-1-1=1 ). Например, если водород и кислород образуются только из воды, то имеется еще одно дополнительное уравнение связи рH2 = 2рO2 (m=1), которое отражает равновесный состав газовой смеси.
Пример 3. При нагревании хлорид аммония диссоциирует на аммиак и хлороводород. В этой системе 2 фазы ( твердая — хлорид аммония, и газообразная — смесь аммиака и хлороводорода) и 3 вещества ( s=3 ), но только количество одного из них изменяется независимо. Химическое равновесие ( n=1 ):
NH4Cl(тв.) NH3(газ) + HСl(газ) , (5)
с учетом того, что (состав твердой фазы) = (составу газовой фазы) (m=1), позволяет выбрать одно вещество — NH4Cl, для описания составов обеих фаз ( K=s-n-m=3-1-1=1).
Если к газовой фазе добавить один из продуктов диссоциации, например HCl, то система станет двухкомпонентной, поскольку состав твердой фазы как и прежде — NH3 : HCl = 1 : 1, а в газовой фазе NH3 : HCl = x : y ( s=3, n=1, m=0 ). Для выражения состава газовой фазы теперь нужно использовать два компонента — NH3 и HCl.
Эти рассуждения справедливы для разложения любого вещества с образованием только газовой фазы ( т.е. для вещества, которое возгоняется при нагревании ). О таких веществах говорят, что они испаряются конгруэнтно.
Рассмотрим систему вода – этанол. Известно, что в ней может образовываться третье вещество – слабо связанный димер воды и этанола. Должны ли мы называть эту систему трехкомпонентной? Считаем, что три вещества вода, этанол и димер находятся в равновесии, тогда, несмотря на то, что s = 3, имеем n = 1 и K = 2. Еще один вид ограничений связан с ионными растворами.
Задача 1. Сколько независимых компонентов содержится в системе NaCl – H2O?
Решение: Первый ответ – два: соль и вода. Второй – три: катион, анион и вода. Ошибка второго ответа заключается в следующем: в нем не учитывается электронейтральность раствора; раствор не может иметь заряда, поэтому число ионов Na + должно быть равно числу ионов Cl — . Т.е., s=3, но m=1(условие электронейтральности раствора [Na + ] = [Cl — ]) и, следовательно, К=2. Такой же результат будет получен, если принимать во внимание диссоциацию воды.
Числом степеней свободы — С, называется наименьшее число независимых переменных системы (давление, температура и концентрации веществ в различных фазах), которые необходимо задать, чтобы полностью описать состояние системы.
В 1876 г. Гиббс вывел простую формулу, связывающую число фаз, находящихся в равновесии, число компонентов и число степеней свободы системы. При равновесии должны быть выполнены следующие условия:
- давление (р) и температура (Т) одинаковы во всех точках системы,
- химический потенциал ( i) каждого i-го компонента одинаков во всех фазах.
Рассмотрим равновесную систему из Ф фаз и К компонентов. Состав каждой фазы можно определить с помощью (К-1) концентраций, поскольку все концентрации связаны условием: S Xi = 1, где Xi — мольная доля i-го компонента. Общее число переменных, характеризующих систему = (К-1) . Ф концентраций + 2 (температура и давление).
Если одна из этих переменных (температура или давление) поддерживается постоянной, то число независимых переменных составит (К-1) . Ф + 1. Если же на систему действует, например, внешнее магнитное поле, то общее число независимых переменных увеличится и составит (К-1) . Ф + 3.
Часть переменных связана уравнениями, вытекающими из условий равновесия (см.второе условие равновесия):
1 1 = 1 2 = … = 1 Ф
2 1 = 2 2 = … = 2 Ф
К 1 = К 2 = … = К Ф
Общее число таких уравнений = (число строк) х (число равенств в строке) =К . (Ф-1).
Число степеней свободы С=(общему числу переменных)-(число уравнений связи между этими переменными)=[(К-1) . Ф + 2] — К . (Ф-1); раскрывая скобки и группируя слагаемые получим :
Правило фаз Гиббса: С + Ф = К + 2
Согласно этому правилу, чем больше компонентов в системе, тем больше степеней свободы; с другой стороны, чем больше фаз тем меньше переменных, необходимо определить для полного описания системы.
- Для любой системы число фаз максимально, когда С=0.
- Для однокомпонентной системы К=1 максимальное число фаз Ф=3.
- Для двухкомпонентной системы К=2 максимальное число фаз Ф=4.
Пример 4. Рассмотрим систему, образованную CaCO3 (тв.) и продуктами его разложения — CaO(тв.) и CO2(газ). Данная система двухкомпонентна — К=2, независимо от относительных количеств составляющих ее веществ (см. Пример 1); в системе присутствуют три фазы (Ф=3): две твердых — CaCO3 (тв.) и CaO(тв.), и одна газообразная — CO2(газ). Согласно правилу фаз, число степеней свободы такой системы С=1. Это означает, что для описания состояния системы достаточно одного параметра. Предмет нашего описания — химическое равновесие, выраженное уравнением (2). Константа данного равновесия зависит от парциального давления углекислого газа ( уравнение (3)) и температуры, т.е. Кр=f(pCO2,T); однако, лишь один из двух параметров состояния системы — pCO2 и T, может быть выбран в качестве независимого параметра. В качестве такового удобно выбрать температуру, тогда pCO2 = f(T). Следовательно, давление углекислого газа в системе, содержащей карбонат и оксид кальция и оксид углерода в равновесии, однозначно определяется температурой системы. При постоянной температуре это давление — фиксированная величина, его можно вычислить через константу равновесия, используя термодинамические функции веществ. В случае Т=const нужно заменить двойку в выражении правила фаз на единицу ( С + Ф = К + 1, см.вывод правила фаз ), тогда получим, что число степеней свободы данной системы при постоянной температуре С=0.
Приведенные выше рассуждения справедливы для любой двухкомпонентной системы, в которой находятся в равновесии три фазы, одна из которых — газообразная. При постоянной температуре давление газа в такой системе есть величина постоянная и не зависит от соотношения фаз.
Пример 5. Хлорид аммония в равновесии с продуктами его диссоциации представляет однокомпонентную систему (К=1, см. Пример 3) с двумя фазами (Ф=2): твердой — NH4Cl(тв.), и газообразной — смесь NH3(газ) и HСl(газ). Применив к данной системе правило фаз, получим число степеней свободы С=1. Это означает, что для описания химического равновесия (5) в нашем случае достаточно одной переменной. Константа равновесия имеет вид:
поскольку pNH3 = pHCl = р/2 ( р = (pNH3 + pHCl) — общее давление продуктов диссоциации). Таким образом, Кр = f(p,T), но только один из аргументов функции является независимым. Выбирая, как и в предыдущем примере, в качестве независимого параметра температуру, получим p=f(T), т.е. давление продуктов диссоциации в рассматриваемой системе однозначно определяется температурой.
Добавление в систему одного из продуктов диссоциации, например, HСl(газ), кардинально меняет ситуацию. Несмотря на то, что число фаз остается прежним — Ф=2, данную систему уже нельзя считать однокомпонентной, число компонентов становится равным К=2 (см. Пример 3). Это приводит и к увеличению числа степеней свободы, теперь С=2. Поскольку в данной системе pNH3 pHCl, для выражения константы равновесия через общее давление газообразных продуктов, придется выразить парциальные давления аммиака и хлороводорода через их мольные доли: pHCl = p . x, pNH3=p . (1-x) (здесь х — мольная доля хлороводорода в газовой смеси). Отсюда константа равновесия будет иметь следующий вид:
Таким образом, константа есть функция 3 переменных — Kp = f(p,x,T), но только две из них являются независимыми. Выбирая в качестве таковых состав газовой фазы (х) и температуру (Т), получим p = f(x,T). Выбранные нами переменные однозначно определяют состояние данной системы.
Зафиксировав температуру, мы уменьшим число степеней свободы до С=1. Это означает, что из двух оставшихся переменных — р, х, только одна является независимой, т.е. p = f(x). Полученный нами вывод проливает свет на один замечательный экспериментальный факт: добавление одного из продуктов диссоциации, например HCl, к системе, содержащей твердый NH4Cl и продукты его испарения, при постоянной температуре, изменяет общее давление в системе. Это не так в случае системы из CaCO3, CaO и CO2 при постоянной температуре, которая рассматривалась в предыдущем примере. Добавление избытка СО2 приводит к реакции его с оксидом кальция с образованием СаСО3, и давление в системе (определяемое давлением СО2) возвращается к первоначальному состоянию.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Правило фаз Гиббса
Содержание:
Правило фаз (или правило фаз Гиббса) — соотношение, связывающее число компонентов, фаз и термодинамических степеней свободы в равновесной термодинамической системе. Роль правила фаз особенно велика при рассмотрении гетерогенных равновесий в многофазных многокомпонентных системах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Правило фаз Гиббса
Правило фаз Гиббса утверждает, что число степеней свободы С равновесной термодинамической системы равно разности между числом компонентов К и числом фаз Ф, плюс число факторов п, влияющих на равновесие.
Независимые компоненты и степени свободы системы
Представления о гомогенных и гетерогенных системах и фазах, изложенных в предыдущей главе, следует дополнить понятиями о компонентах и степенях свободы. Компонентами называют индивидуальные вещества системы, концентрации которых определяют состав всех ее фаз, т. е. веществ в системе может быть больше, чем требуется для описания состава всех ее фаз. Например, при установлении равновесия
система состоит из трех веществ, но для описания состава всех трех фаз достаточно знать любые два, их называют независимыми компонентами; состав третьей фазы легко определить, используя уравнение вещественного баланса. Из приведенного примера следует: число независимых компонентов равновесной системы равно общему числу индивидуальных веществ минус число связывающих их уравнений. При наличии химических реакций число независимых компонентов системы меньше числа индивидуальных веществ. Если же между веществами нет химического взаимодействия, то числа независимых компонентов и индивидуальных веществ совпадают (например, воздух состоит из такого же числа независимых компонентов, сколько сортов молекул входит в его состав).
Степенями свободы (С) равновесной системы называют те параметры, которые можно произвольно изменять, не меняя числа и природы фаз системы. Степенями свободы могут являться концентрации реагирующих веществ в фазах переменного состава (растворах), давление, температура.
Число степеней свободы определяют разностью между общим числом независимых переменных системы и числом уравнений, их связывающих. В приведенном выше примере общее число переменных равно двум (температура и давление С02 или его концентрация), уравнение одно, следовательно, число степеней свободы С данной системы равно: 2—1 = 1.
Количественное соотношение между числами степени свободы (С), фаз (Ф) и независимых компонентов (К), получившее название правила фаз, выведено В. Гиббсом (1876), оно имеет вид
Здесь 2 — число переменных параметров системы (давление и температура). Использование этого правила помогает при изучении химических реакций и равновесных систем.
Рассмотрим некоторые конкретные примеры.
Пример 1. Система представлена равновесием
Число независимых компонентов К равно разности числа индивидуальных веществ и числа уравнений, их связывающих, следовательно,

Связь 

Пример 2. Пусть система представлена равновесием 
Число независимых компонентов в ней равно

Это легко понять, если записать выражение температурной зависимости константы равновесия:

Следовательно, чтобы определить значение любой из переменных, нужно задать значения остальных трех.
Пример 3. Пусть система представлена ненасыщенным водным раствором хлористого натрия NaCl. В растворе, помимо молекул воды 

Эта однофазная система представлена тремя индивидуальными фермами соединений и одним уравнением, отсюда число независимых компонентов в этой однофазной системе равно
Поскольку газовая фаза (пар над раствором) не входит в рассматриваемую систему (по условию), то в выражении правила фаз Гиббса число параметров должно стать на единицу меньше, т. е. 
Однокомпонентные системы
Наиболее просты системы, состоящие из одного компонента. Каждая однокомпонентная система представлена единственным веществом, находящимся в различных агрегатных состояниях. Так, например, вода может существовать в парообразном, жидком и кристаллическом состояниях, каждое из которых устойчиво в определенных интервалах температуры и давления.
Переменными параметрами . однокомпонентных систем могут служить только давление и температура, поскольку состав фаз по условию постоянен. Поэтому состояние однокомпонентных систем может быть представлено в виде зависимости давления от температуры:

Графическое изображение такой зависимости получило название диаграммы состояния или фазовой диаграммы
состояния, поскольку состав фаз в однокомпонентной системе одинаков и при изменении условий не меняется.
Давление пара в процессах па рообра зова ни я уста на вл ивается и над твердыми, и над жидкими веществами:

Характер этой функциональной зависимости приведен на графике рис. 7.1. Точка плавления кристаллической фазы находится .совместным решением приведенных выше уравнений; исходя из условия равенства жидкой и кристаллической фаз должно выполняться условие 
При переходе из кристаллического состояния в пар (сублимация) степень разупорядоченности движения частиц больше, чем при испарении (в жидкости беспорядочность движения частиц больше, чем в кристаллах), поэтому величина 
Поскольку температура может принимать только значения Т > 0, величина 
Точно так же обстоит дело с полиморфными превращениями, если они есть.
Зависимость температуры плавления чистых веществ от давления p = fT можно определить уравнением Клаузиуса— Клайперона (приближенная форма):
В этом уравнении 


На рис. 7.2, а, б показано, что каждому из условий соответствует определенный наклон линии р = f(Т). Крутой ход кривых в равновесии между двумя конденсированными фазами объясняют незначительной разностью
Рассмотрим в качестве примера однокомпонентную систему вода—лед—пар. С точки зрения правила фаз Гиббса для такой системы 
Равновесие двух фаз (испарение, сублимация) характеризуется одной степенью свободы (произвольны давление или температура). Двухфазные превращения описываются следующими уравнениями:


При использовании этих данных на рис. 7.3 построен график зависимости р =f(Т), получивший название диаграммы’; состояния воды. Линии (а), (b) и (с) отвечают равновесиям двух фаз: твердое вещество— пар; твердое вещество— жидкость; жидкость— пар соответственно. Точка пересечения трех кривых носит название тройной точки, она отвечает равновесию всех трех фаз, а участки диаграммы I, II и III отвечают однофазному равновесию с тремя степенями свободы. Линия (b) имеет отрицательный наклон, соответствующий отрицательному значению 
Двухкомпонентные системы
Перейдем к характеристике более сложных, двухкомпонентных систем. С точки зрения правила фаз число степеней свободы в системах с К = 2 может максимально быть равным 3, если Ф= 1. Это означает, что кроме таких переменных параметров системы, как давление и температура, появляется третий— концентрация раствора. Примером однофазных систем переменного состава, образованных двумя и более независимыми компонентами, служат растворы. Растворы образуются во всех агрегатных состояниях. Они могут быть газообразными, жидкими и твердыми.
Все газы в любых соотношениях между собой неограниченно растворимы. Только при низких температурах и очень высоких давлениях в некоторых газовых смесях наблюдается расслоение. В жидком состоянии ограничение растворимости наблюдают довольно часто. Однако с повышением температуры растворимость обычно возрастает, так что многие жидкие смеси, расслоенные на две фазы, с повышением температуры становятся однофазными. Наиболее важные группы жидких растворов следующие:
1) водные, неводные и органические растворы;
2) солевые расплавы галогенидных, кислородных и сульфидных соединений (при высоких температурах);
3) расплавы металлов (при высоких температурах).
В твердом состоянии ограничение в растворимости также имеет место. Известны три типа твердых растворов: замещения, внедрения и вычитания. Твердые растворы замещения обычно образуются двумя или несколькими различными элементами, так что в кристаллической структуре места атомов одного элемента неупорядоченно замещаются атомами второго элемента. В результате распределение каждого из элементов оказывается хаотическим, а соотношение между количествами атомов того и другого сорта — произвольным. Примерами твердых растворов замещения служат сплавы меди и никеля или смешанные кристаллы хлористого и бромистого натрия. Твердые растворы внедрения получают чаще всего при растворении небольших по размеру атомов неметаллов в металлической решетке, например раствор углерода в железе. В этом случае атомы неметаллов (Н, В, С, О и др.) хаотически и в произвольных соотношениях располагаются в промежутках между атомами металла.
Твердые растворы вычитания, или дефектные структуры, характеризуются наличием пустот, которые размещаются хаотически и создают беспорядок в расположении мест, занятых атомами элементов. Примером таких структур служит сульфидный минерал пирротин, монотонно изменяющий свой состав в пределах
Общая характеристика растворов
Процесс растворения— сложный физико-химический акт, а не простое распределение частиц одного вещества между частицами другого, которое в какой-то степени применимо для описания разреженных газовых смесей. В жидких и твердых растворах частицы растворителя и растворенного вещества непосредственно взаимодействуют между собой и находятся на таких коротких расстояниях, как и в химических соединениях. Взаимодействие молекул растворителя с растворяемым веществом зависит от сил разнообразной природы, за счет которых в растворе образуются устойчивые комплексные и полимерные соединения, способные существовать вне раствора,— сольваты, а в случае водных растворов—гидраты.
Одна из важнейших количественных характеристик растворов, связанная через закон действующих масс с энергетикой процессов растворения,— концентрация раствора. Поэтому целесообразно вспомнить некоторые наиболее используемые способы выражения концентраций, кроме уже упомянутых молярности и молярной доли следует знать массовую и объемную доли, моляльную концентрацию (моляль-ность), титр.
Поскольку процессы растворения имеют сложную химическую природу, законы, определяющие растворение и отражающие природу растворов, сложны. Для упрощения введено понятие идеального раствора, простейшими примерами которого могут служить разреженные газы. В реальных газах соотношение между объемом, давлением и температурой описывается уравнением Ван-дер-Ваальса
В этом уравнении слагаемые 

Составляя смеси таких газов, можно убедиться в том, что для их взаимодействия справедливо условие 
Газовые растворы, которые образуются из составляющих их частей с нулевым тепловым эффектом, а объем их смеси в точности равен сумме объемов частей, получили название идеальных.
Для жидких и твердых растворов также существует понятие идеальности, в общем виде оно может быть сформулировано следующим образом: идеальными называют растворы, которые образуются из составных частей при выполнении условий
Примерами идеальных растворов могут служить газовые смеси изотопов, а также все разбавленные растворы. И действительно, добавление к растворителю небольшого количества растворяемого вещества мало изменяет свойства растворителя и раствора, и условие идеальности (7.2) справедливо. Но свойства растворяемого вещества в таком растворе далеки от идеальных.
Концентрированные растворы но свойствам не близки к идеальным, однако для получения грубой качественной картины их можно описывать с помощью модели идеальных растворов. Для строгого решения производственных и научных задач требуется обязательное введение поправок на реальность.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Гармонические колебания
О чем эта статья:
9 класс, 11 класс, ЕГЭ/ОГЭ
Механические колебания
Механические колебания — это физические процессы, которые точно или приблизительно повторяются через одинаковые интервалы времени.
Колебания делятся на два вида: свободные и вынужденные.
Свободные колебания
Это колебания, которые происходят под действием внутренних сил в колебательной системе.
Они всегда затухающие, потому что весь запас энергии, сообщенный в начале, в конце уходит на совершение работы по преодолению сил трения и сопротивления среды (в этом случае механическая энергия переходит во внутреннюю). Из-за этого свободные колебания почти не имеют практического применения.
Вынужденные колебания
А вот вынужденные колебания восполняют запас энергии внешним воздействием. Если это происходит каждый период, то колебания вообще затухать не будут.
Вынужденные колебания — это колебания, которые происходят под действием внешней периодически меняющейся силы.
Частота, с которой эта сила воздействует, равна частоте, с которой система будет колебаться.
Например, качели. Если вас кто-то будет на них качать, каждый раз давая толчок, когда вы приходите в одну и ту же точку — такое колебание будет считаться вынужденным.
Это колебание все еще будет считаться вынужденным, если вас будут раскачивать из положения равновесия. Просто в данном случае амплитуда (о которой речь пойдет чуть ниже) будет увеличиваться с каждым колебанием.
Автоколебания
Иногда вынужденному колебанию не нужно внешнего воздействия, чтобы случиться. Бывают такие системы, в которых это внешние воздействие возникает само из-за способности регулировать поступление энергии от постоянного источника.
У автоколебательной системы есть три важных составляющих:
- сама колебательная система
- источник энергии
- устройство обратной связи, обеспечивающей связь между источником и системой
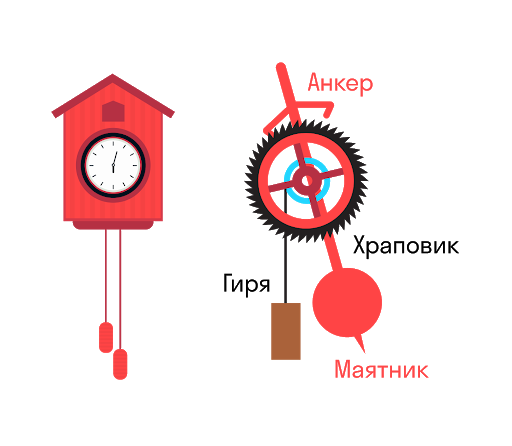
Часы с кукушкой — пример автоколебательной системы. Гиря на ниточке (цепочке) стремится вращать зубчатое колесо (храповик). При колебаниях маятника анкер цепляет за зубец, и вращение приостанавливается.
Но в результате маятник получает толчок, компенсирующий потери энергии из-за трения. Потенциальная энергия гири, которая постепенно опускается, расходуется на поддержание незатухающих колебаний.
Характеристики колебаний
Чтобы перейти к гармоническим колебаниям, нам нужно описать величины, которые помогут нам эти колебания охарактеризовать. Любое колебательное движение можно описать величинами: период, частота, амплитуда, фаза колебаний.
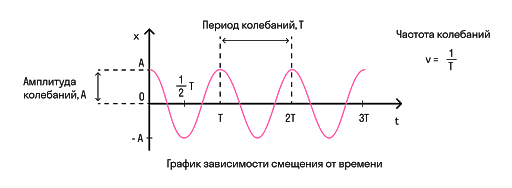
Период — это время одного полного колебания. Измеряется в секундах и обозначается буквой T.
Формула периода колебаний
T = t/N
N — количество колебаний [—]
Также есть величина, обратная периоду — частота. Она показывает, сколько колебаний совершает система в единицу времени.
Формула частоты
ν = N/t = 1/T
N — количество колебаний [—]
Амплитуда — это максимальное отклонение от положения равновесия. Измеряется в метрах и обозначается либо буквой A, либо x max .
Она используется в уравнении гармонических колебаний:
Гармонические колебания
Простейший вид колебательного процесса — простые гармонические колебания, которые описывают уравнением:
Уравнение гармонических колебаний
x — координата в момент времени t [м]
t — момент времени [с]
(2πνt) в этом уравнении — это фаза. Ее обозначают греческой буквой φ
Фаза колебаний
t — момент времени [с]
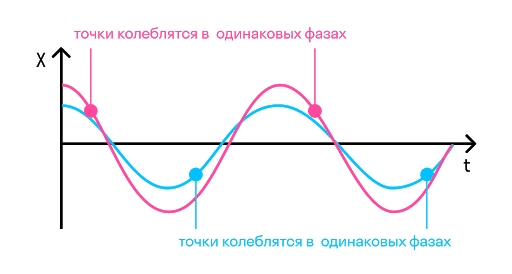
Фаза колебаний — это физическая величина, которая показывает отклонение точки от положения равновесия. Посмотрите на рисунок, на нем изображены одинаковые фазы:
Например, в тех же самых часах с кукушкой маятник совершает колебания. Он качается слева направо и приходит в самую правую точку. В той же фазе он будет находиться, когда придет в ту же точку, идя справа налево. Если мы возьмем точку на сантиметр левее самой правой, то идя в нее не слева направо, а справа налево, мы получим уже другую фазу.
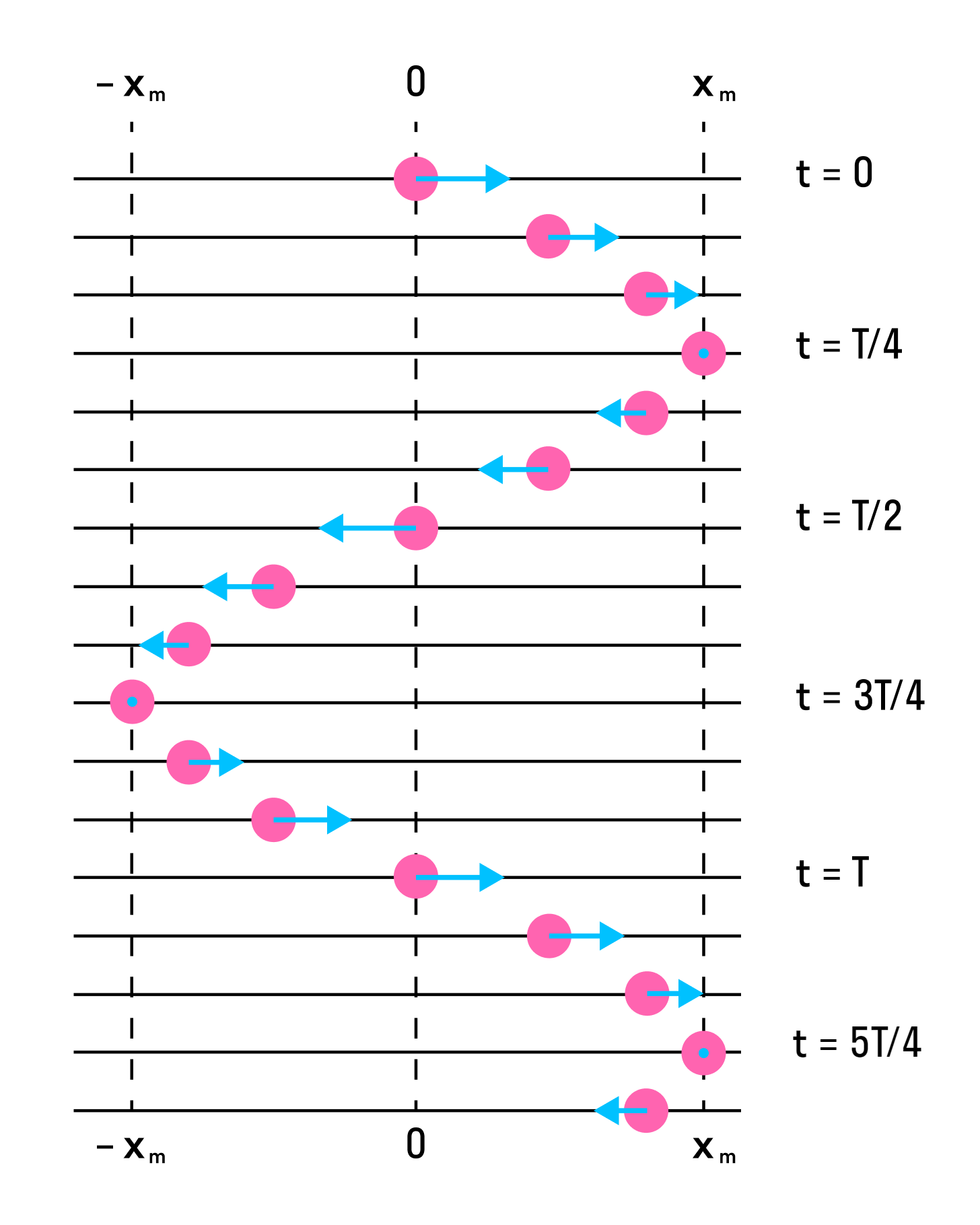
На рисунке ниже показаны положения тела через одинаковые промежутки времени при гармонических колебаниях. Такую картину можно получить при освещении колеблющегося тела короткими периодическими вспышками света (стробоскопическое освещение). Стрелки изображают векторы скорости тела в различные моменты времени.
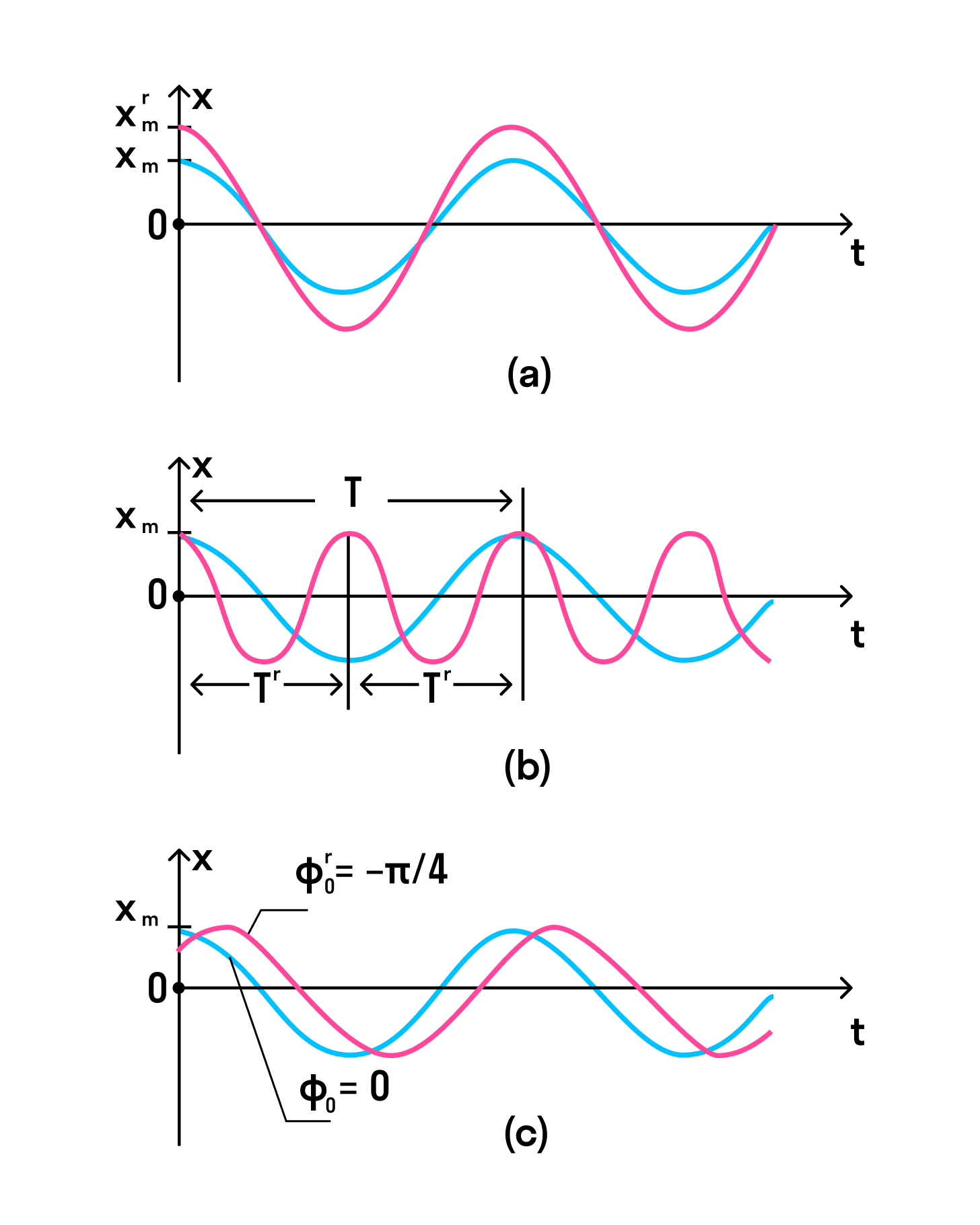
Если изменить период, начальную фазу или амплитуду колебания, графики тоже изменятся.
На рисунке ниже во всех трех случаях для синих кривых начальная фаза равна нулю, а в последнем (с) — красная кривая имеет меньшую начальную фазу.
В первом случае (а) красная кривая описывает колебание, у которого амплитуда больше колебания, описанного синей линией.
Во втором случае (b) красная кривая отличается от синей только значением периода — у красной период в два раза меньше.
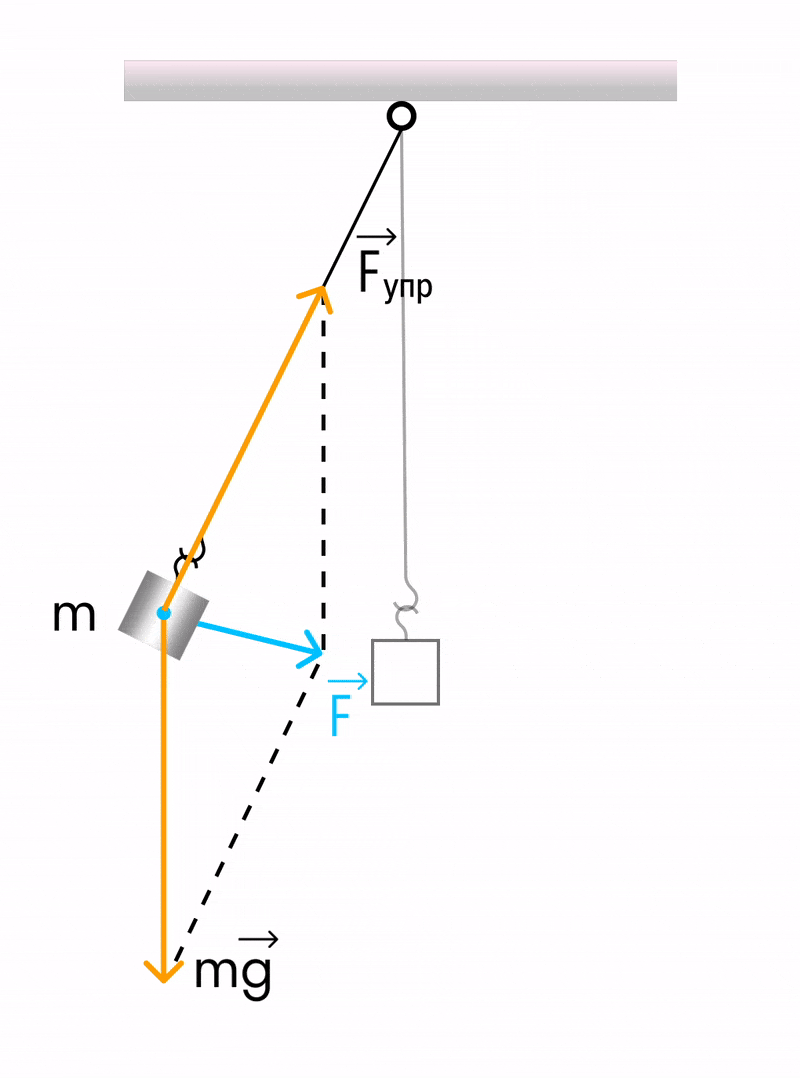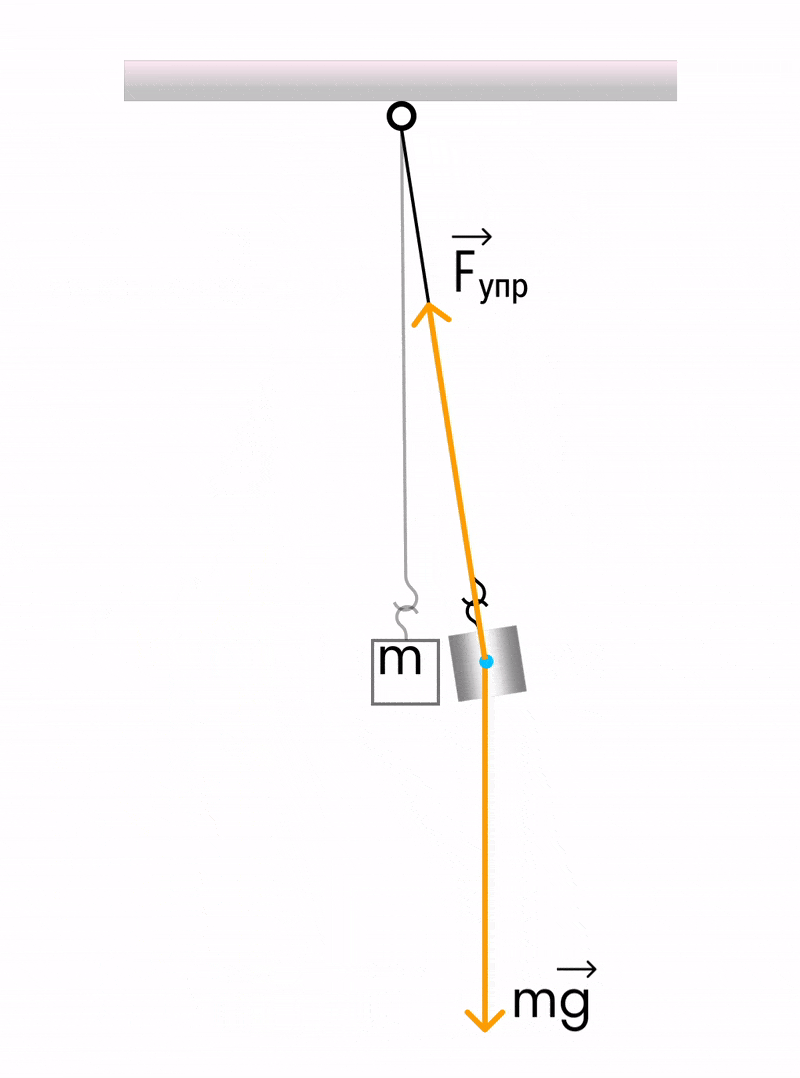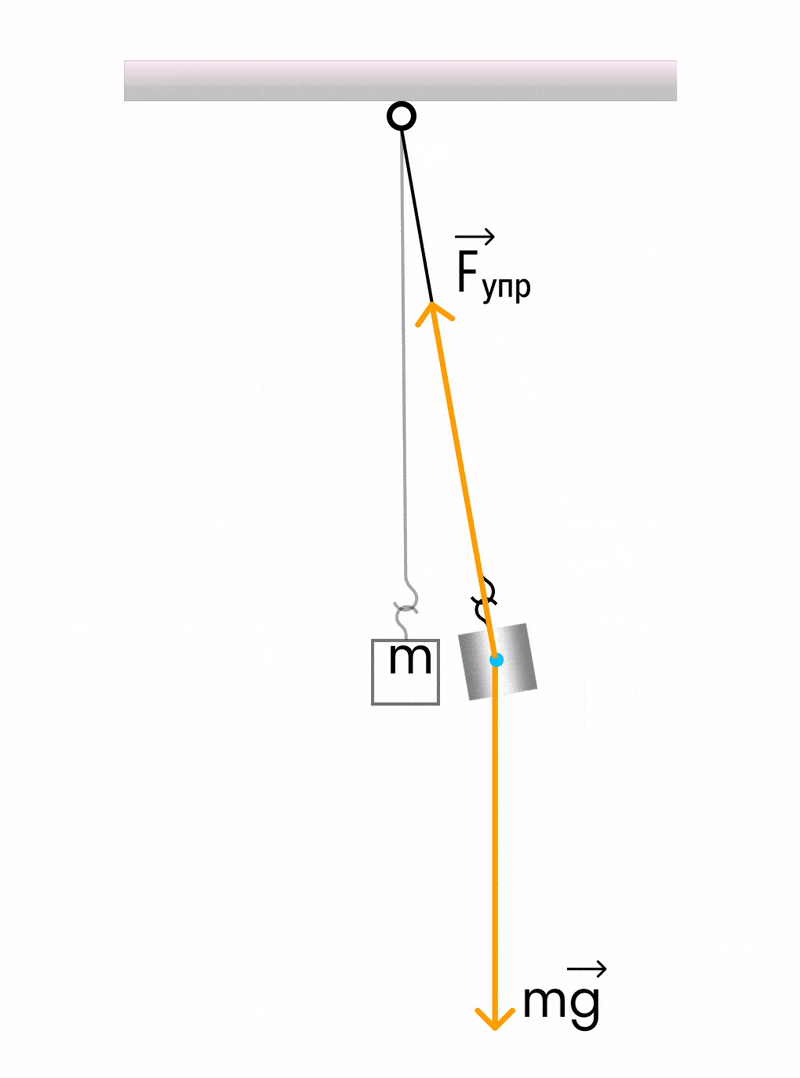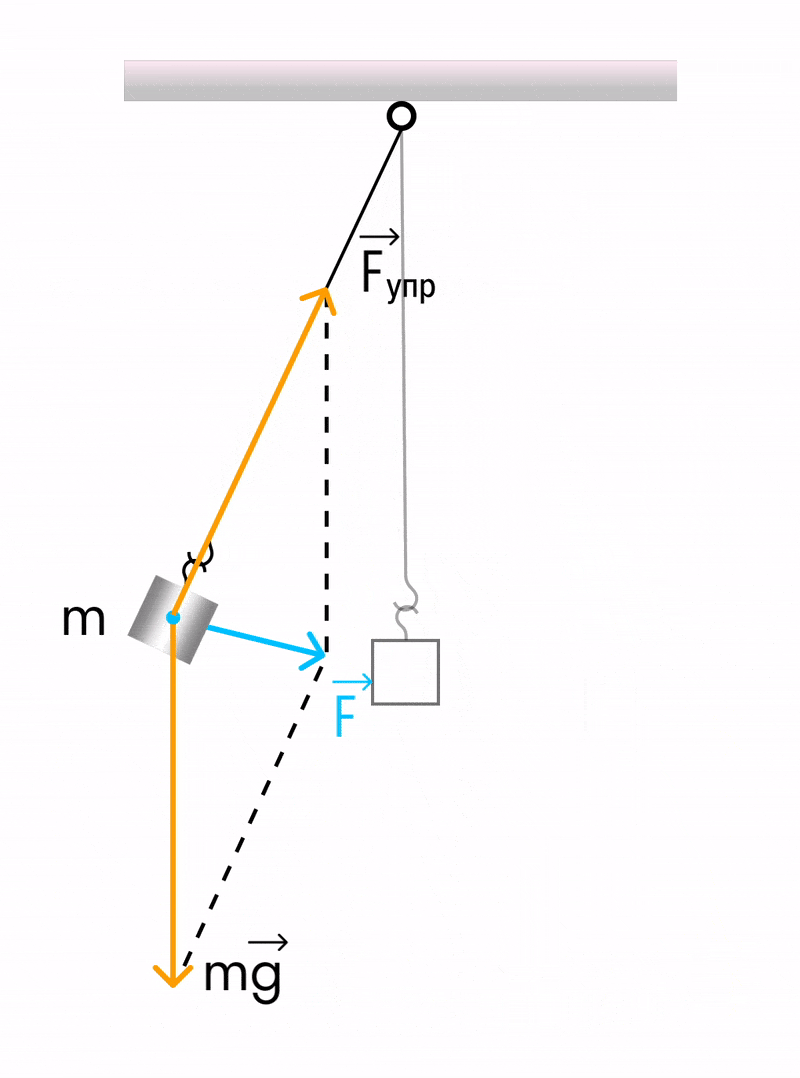
Математический маятник
Математический маятник — отличный пример гармонических колебаний. Если мы подвесим шарик на нити, то это еще не будет математическим маятником — пока он только физический.
Математическим этот маятник станет, если размеры шарика много меньше длины нити (тогда этими размерами можно пренебречь и рассматривать шарик как материальную точку), растяжение нити очень мало, а масса нити во много раз меньше массы шарика.
Математическим маятником называется система, которая состоит из материальной точки массой m и невесомой нерастяжимой нити длиной l, на которой материальная точка подвешена, и которая находится в поле силы тяжести (или других сил).
Период малых колебаний математического маятника в поле силы тяжести Земли определяется по формуле:
Формула периода колебания математического маятника
l — длина нити [м]
g — ускорение свободного падения [м/с 2 ]
На планете Земля g = 9,8 м/с 2
Пружинный маятник
Пружинный маятник — это груз, прикрепленный к пружине, массой которой можно пренебречь.
В пружинном маятнике колебания совершаются под действием силы упругости.
Пока пружина не деформирована, сила упругости на тело не действует.
Формула периода колебания пружинного маятника
m — масса маятника [кг]
k — жесткость пружины [Н/м]
Закон сохранения энергии для гармонических колебаний
Физика — такая клевая наука, в которой ничего не исчезает бесследно и не появляется из ниоткуда. Эту особенность описывает закон сохранения энергии.
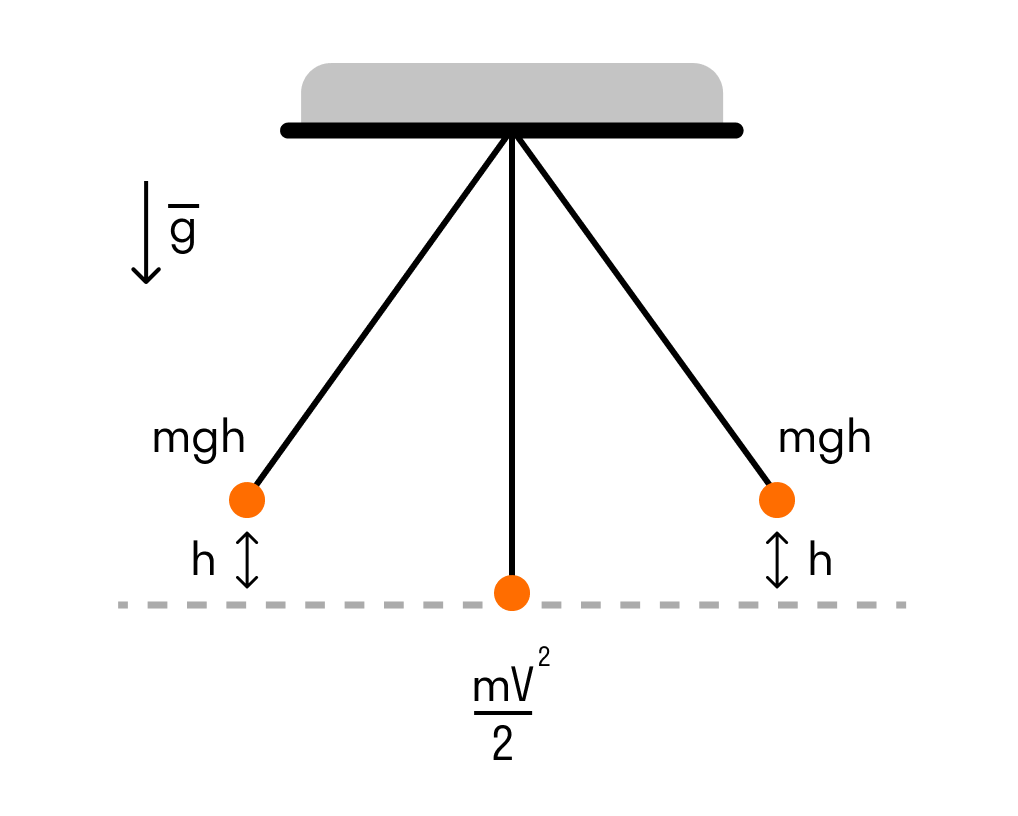
Рассмотрим его на примере математического маятника.
- Когда маятник отклоняют на высоту h, его потенциальная энергия максимальна.
- Когда маятник опускается, потенциальная энергия переходит в кинетическую. Причем в нижней точке, где потенциальная энергия равна нулю, кинетическая энергия максимальна и равна потенциальной энергии в верхней точке. Скорость груза в этой точке максимальна.
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
http://natalibrilenova.ru/pravilo-faz-gibbsa/
http://skysmart.ru/articles/physics/garmonicheskie-kolebaniya