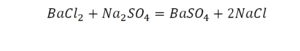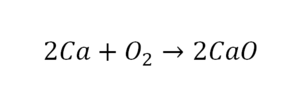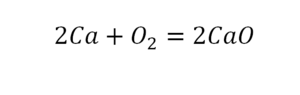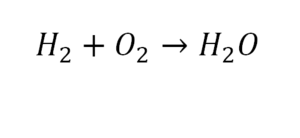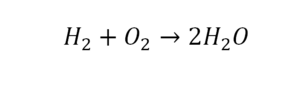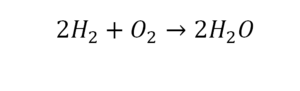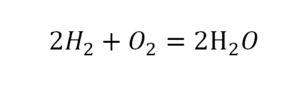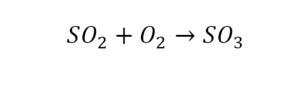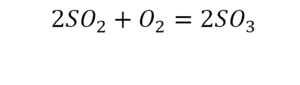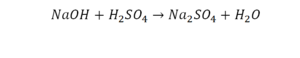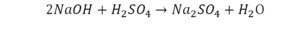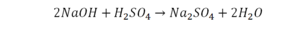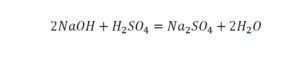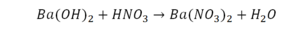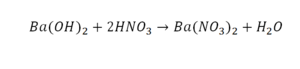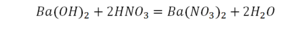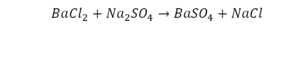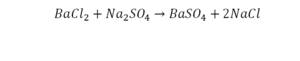Урок 8 Бесплатно Химическая реакция- уравнение и типы
Начало
Продолжим изучение химической реакции как одной из основ химической науки.
Ведь полноценное понимание этой темы нужно для дальнейшего изучения химии, и в то же время это сделает вас образованнее не только в научном плане, но и в бытовом!
Уравнение химической реакции
Вся информация о протекающей химической реакции (исходные вещества, продукты реакции, условия протекания, тепловой эффект) на письме фиксируется в виде уравнения реакции.
Уравнение можно записать для любой реакции. Для этого нужно знать состав молекул исходных веществ и продуктов.
Всё это записывается в виде химических формул.
Всё происходит как в математике: в левой части записываются формулы исходных веществ, а в правой – формулы продуктов.
Только вместо знака «равно» чаще всего ставят стрелку: она показывает, что реакция идёт именно в этом направлении.
У меня есть дополнительная информация к этой части урока!
В некоторых случаях возможно протекание реакции при одних и тех же условиях в обоих направлениях. В таком случае обычно ставят две стрелки в обе стороны, но также и допустимо ставить знак «равно».
В некоторых случаях (когда это требуется) указывают условия протекания реакции и тепловой эффект реакции.
Условия протекания записывают над стрелкой, а тепловой эффект – в виде количества теплоты в левой части, если реакция эндотермическая, и в правой части, если экзотермическая.
Для примера запишем уравнение реакции водорода с кислородом:
Зигзаг обозначает искру – условие для начала реакции, а «+ Q» – то, что в результате реакции выделяется энергия.
В зависимости от конкретных задач условия протекания и тепловой эффект могут вообще не отмечать или отмечать конкретное числовое значение теплового эффекта.
Если среди продуктов реакции есть газ, около его формулы пишут стрелку вверх.
Например, когда мы капаем на рану перекись водорода, под действием ферментов крови она разлагается с выделением кислорода:
У меня есть дополнительная информация к этой части урока!
Кислород обладает обеззараживающим действием и способствует более быстрой свёртываемости крови!
Перекись водорода может разлагаться не только под воздействием ферментов крови, но и многих других веществ.
Разложение перекиси водорода в присутствии оксида марганца (IV) (Оксид марганца (IV) в химической реакции не участвует).
Если реакция идет в растворе и в результате выпадает осадок, то пишут стрелку вниз.
Садовые деревья весной обрабатывают от паразитов «бордосской жидкостью». Чтобы её приготовить, смешивают растворы извести и медного купороса.
При этом наблюдается выпадение хлопьев, которые состоят сразу из двух нерастворимых веществ: гидроксида меди и сульфата кальция.
Получившийся сульфат кальция, гипс, образует корку, которая будет дольше держаться на стволе дерева, и поэтому такая смесь дольше защищает его от вредителей.
Запишем уравнение этой реакции
Как правильно читать уравнение химической реакции?
В химии принято делать это примерно так: «один моль сульфата меди реагирует с одним молем гидроксида кальция с образованием одного моля гидроксида меди и одного моля сульфата кальция».
То есть коэффициент перед формулой вещества считают количеством вещества в молях, а не количеством молекул.
Ведь в реальной жизни мы наблюдаем реакцию не единичных молекул, а большого объема веществ.
При составлении уравнений химики опираются на два основных закона природы: закона сохранения массы и закона постоянства состава веществ.
Пройти тест и получить оценку можно после входа или регистрации
Химические уравнения.
Химическое уравнение – это условное изображение химической реакции с помощью химических формул веществ, числовых коэффициентов и математических символов.
При записи химических уравнений должен строго соблюдаться закон сохранения массы: массы вступивших в реакцию веществ, равны массе продуктов реакции.
Химическая реакция – процесс, при котором вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и свойствами. При этом в составе атомных ядер изменений не происходит.
Химические реакции всегда сопровождаются физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ.
Пример составления химического уравнения:
слева 2 атома Fe – справа 1 атом Fe (множитель 2)
слева 3 атома O – справа 1 атом O (множитель 3)
Затем подбирается коэффициент для H2O:
слева 2 атома H – справа 2 атома H (множитель 1), но т.к. справа 3 атома O, то множитель для H2O получаем 3. Н в правой части уравнения имеет множитель 6, для равновесия Н, в левой части используем множитель 3.
Итоговое химическое уравнение:
Выпадение осадка в результате химической реакции обозначается в химическом уравнении стрелкой вниз ↓. Это означает, что соединение нерастворимо:
Выделение газа в результате химической реакции обозначается в химическом уравнении стрелкой вверх ↑.
Виды химических реакций.
Реакции соединения: хотя бы два элемента образуют один продукт:
Реакции разложения: вещество распадается на два или более простых элемента (соединения):
Реакция замещения: обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе:
Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакция обмена: реагенты и продукты реакции являются сложными веществами:
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
http://www.calc.ru/Khimicheskiye-Uravneniya.html
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah