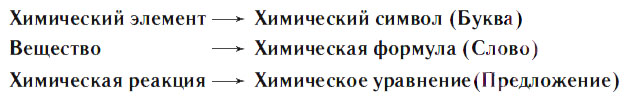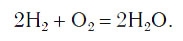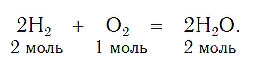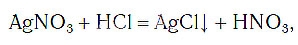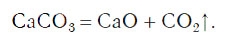Уравнения химических реакций
Схема химической реакции
Для характеристики определенной химической реакции необходимо уметь составить запись, которая будет отображать условия протекания химической реакции, показывать какие вещества вступили в реакцию, а какие образовались. Для этого используют схемы химических реакций.
Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции Рассмотрим в качестве примера реакцию взаимодействия угля и кислорода. Схема данной реакции записывается следующим образом:
уголь взаимодействует с кислородом с образованием углекислого газа
Углерод и кислород – в данной реакции реагенты, а полученный углекислый газ – продукт реакции. Знак «→» обозначает протекание реакции. Часто над стрелкой пишут условия, при которых происходит реакция
- Знак « t° → » обозначает, что реакция протекает при нагревании.
- Знак « Р → » обозначает давление
- Знак « hv → » – что реакция протекает под действием света. Также над стрелкой могут указывать дополнительные вещества, участвующие в реакции.
- Например, « О2 → ». Если в результате химической реакции образуется газообразное вещество, то в схеме реакции, после формулы этого вещества записывают знак «→». Если при протекании реакции образуется осадок, его обозначают знаком «→».
- Например, при нагревании порошка мела (он содержит вещество с химической формулой CaCO3), образуются два вещества: негашеная известь CaO и углекислый газ. Схема реакции записывается так:
Так, природный газ, в основном состоит из метана CH4, при его нагревании до 1500°С он превращается в два других газа: водород Н2 и ацетилен С2Н2. Схема реакции записывается так:
Важно не только уметь составлять схемы химических реакций, но и понимать, что они обозначают. Рассмотрим, еще одну схему реакции:
Данная схема означает, что под действием электрического тока, вода разлагается на два простых газообразных вещества: водород и кислород. Схема химической реакции является подтверждением закона сохранения массы и показывает, что химические элементы во время химической реакции не исчезают, а только перегруппировываются в новые химические соединения.
Уравнения химических реакций
Согласно закону сохранения массы исходная масса продуктов всегда равна массе полученных реагентов. Количество атомов элементов до и после реакции всегда одинаковое, атомы только перегруппировываются и образуют новые вещества. Вернемся к схемам реакций, записанным ранее:
С + О2 ↑ СО2.
В данных схемах реакций знак «→» можно заменить на знак «=», так как видно, что количество атомов до и после реакций одинаковое. Записи будут иметь следующий вид:
С + О2 = СО2.
Именно такие записи называют уравнениями химических реакций, то есть, это – записи схем реакций, в которых количество атомов до и после реакции одинаковое.
Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
Если мы рассмотрим другие, приведенные ранее схемы уравнений, можно заметить, что на первый взгляд, закон сохранения массы в них не выполняется:
Видно, что в левой части схемы, атом углерода один, а в правой – их два. Атомов водорода поровну и в левой и правой частях их по четыре. Превратим данную схему в уравнение. Для этого необходимо уравнять количество атомов углерода. Уравнивают химические реакции при помощи коэффициентов, которые записывают перед формулами веществ. Очевидно, чтобы количество атомов углерода стало одинаковым слева и справа, в левой части схемы, перед формулой метана, необходимо поставить коэффициент 2:
Видно, что атомов углерода слева и справа теперь поровну, по два. Но теперь неодинаково количество атомов водорода. В левой части уравнения их 2∙4 = 8. В правой части уравнения атомов водорода 4 (два из них в молекуле ацетилена, и еще два – в молекуле водорода). Если поставить коэффициент перед ацетиленом, нарушится равенство атомов углерода. Поставим перед молекулой водорода коэффициент 3:
Теперь количество атомов углерода и водорода в обеих частях уравнения одинаковое. Закон сохранения массы выполняется! Рассмотрим другой пример. Схему реакции Na + H2O → NaOH + H2 необходимо превратить в уравнение. В данной схеме различным является количество атомов водорода. В левой части два, а в правой – три атома. Поставим коэффициент 2 перед NaOH.
Na + H2O → 2NaOH + H2
Тогда атомов водорода в правой части станет четыре, следовательно, коэффициент 2 необходимо добавить и перед формулой воды:
Na + 2H2O → 2NaOH + H2
Уравняем и количество атомов натрия:
2Na + 2H2O = 2NaOH + H2
Теперь количество всех атомов до и после реакции одинаковое. Таким образом, можно сделать вывод: чтобы превратить схему химической реакции в уравнение химической реакции, необходимо уравнять количество всех атомов, входящих в состав реагентов и продуктов реакции при помощи коэффициентов. Коэффициенты ставятся перед формулами веществ. Подведем итоги об Уравнения химических реакций
- Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции
- В схемах реакций используют обозначения, указывающие на особенности их протекания
- Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
- Схему химической реакции превращают в уравнение путем расстановки коэффициентов перед формулами веществ
Что обозначает буква t над стрелкой в уравнении реакций?
Химия | 5 — 9 классы
Что обозначает буква t над стрелкой в уравнении реакций?
Буква t над стрелкой показывает, что условия протекания данной реакции происходит при повышенной температуре.
Буква t обозначает то что реакция прошла под температурой.
РЕШИТЕ УРАВНЕНИЕ РЕАКЦИИ O0 + S (СТРЕЛКА) SO2 O2 + H2(СТРЕЛКА)H2O O2 + P(СТРЕЛКА)P2O5?
РЕШИТЕ УРАВНЕНИЕ РЕАКЦИИ O0 + S (СТРЕЛКА) SO2 O2 + H2(СТРЕЛКА)H2O O2 + P(СТРЕЛКА)P2O5.
Задание «цепочка» правила : 1?
Задание «цепочка» правила : 1.
Сколько стрелочек — столько и уравнений реакций 2.
Над каждой стрелочкой проставить условия 3.
Записать уравнения реакции : вещество до стрелки, вещество после стрелки, недостающие коэффициенты 4.
Назвать вещества и тип реакции.
Поставьте коэффициенты и Замените стрелки знаком равенства Прочитайте уравнения реакции?
Поставьте коэффициенты и Замените стрелки знаком равенства Прочитайте уравнения реакции.
Что обозначает эта стрелка ?
Что обозначает эта стрелка ?
Соединить стрелки уравнений химических реакцийЗадание номер 5?
Соединить стрелки уравнений химических реакций
Задание номер 5.
Составьте уравнения реакций, с помощью которых можно осуществить превращения, назовите вещества и укажите типы реакций : HG HgO (стрелка в право )O2 (стрелка в право )SO2( стрелка в право ) SO3?
Составьте уравнения реакций, с помощью которых можно осуществить превращения, назовите вещества и укажите типы реакций : HG HgO (стрелка в право )O2 (стрелка в право )SO2( стрелка в право ) SO3.
Составь Уравнения реакций :Ca(стрелка в право)СаоS(стрелка в право)SO2CH4(стрелка в право)CO2Fe(стрелка в право)Fe2O3?
Составь Уравнения реакций :
Ca(стрелка в право)Сао
S(стрелка в право)SO2
CH4(стрелка в право)CO2
Fe(стрелка в право)Fe2O3.
5)Уравнение реакции ВюрцаCH3CI + 2Na + CH3CI6)Уравнение реакции присоединенияC4H8 + H2(над стрелкой t и Ni)?
5)Уравнение реакции Вюрца
CH3CI + 2Na + CH3CI
6)Уравнение реакции присоединения
C4H8 + H2(над стрелкой t и Ni).
Напишите уравнения реакции с помощью которых можно осуществить цепочку превращенийPbO стрелка Pb(NO3)2 стрелка Pb(OH)2 стрелка Pbl2?
Напишите уравнения реакции с помощью которых можно осуществить цепочку превращений
PbO стрелка Pb(NO3)2 стрелка Pb(OH)2 стрелка Pbl2.
Что обозначает выражение демеркуризация?
Что обозначает выражение демеркуризация.
Составьте уравнение реакции.
Вы зашли на страницу вопроса Что обозначает буква t над стрелкой в уравнении реакций?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
CH3 — CH2 — CH2 — OH + CuO — > CH3 — CH2 — COH + Cu + H2O.
1) HCl — связь ковалентная полярная ответ : 3 2) Ba(OH)2 ответ : 2.
В пятой — шестой возможно не так как надо, но логически всё верно.
Я украинский не понимаю.
= kcl2 + h2 вот это.
ЭО2 пусть масса оксида 100г, тогда m(Me) = 69, 5 ; m(O) = 30, 5 m(Me) : m(O) = Э(Me) : Э(O) 69, 5 : 30, 5 = Э(Ме) : 8 Э(Ме) = 18 М(Ме) = 18 * 4 = 72г / моль — это германий.
Дано m(Fe) = 28 g — — — — — — — — — — — — — — — — — — — — — — — — — — m(CL2) — ? 28 X 2Fe + 3CL2 — — >2FeCL3 M(Fe) = 56 g / mol M(CL2) = 71 g / mol 2 * 56 3 * 71 X = 28 * 213 / 112 = 53. 25 g ответ 53. 25 г.
Урок 11. Химические уравнения
В уроке 11 «Химические уравнения» из курса «Химия для чайников» мы узнаем кем и когда был открыт закон сохранения массы веществ; познакомимся с химическими уравнениями и научимся правильно расставлять в них коэффициенты.
До сих пор при рассмотрении химических реакций мы обращали внимание на их качественную сторону, т. е. на то, как и при каких условиях исходные вещества превращаются в продукты реакций. Но в химических явлениях существует и другая сторона — количественная.
Закон сохранения массы веществ
Изменяется ли масса веществ, вступивших в химическую реакцию? В поиске ответа на этот вопрос английский ученый Р. Бойль еще в XVII в. провел множество опытов по прокаливанию свинца в запаянных сосудах. После окончания опытов он вскрывал сосуды и взвешивал продукты реакции. В результате Бойль пришел к выводу, что масса вещества после реакции больше массы исходного металла. Он объяснил это присоединением к металлу некой «огненной материи».
Опыты Р. Бойля по прокаливанию металлов повторил русский ученый М. В. Ломоносов в 1748 г. Прокаливание железа он проводил в специальной колбе (реторте) (рис. 56), которая была герметически запаяна. В отличие от Бойля после реакции он оставлял реторту запаянной. Взвешивание реторты после реакции показало, что ее масса не изменилась. Это свидетельствовало о том, что, хотя между металлом и веществом, содержащемся в воздухе, произошла химическая реакция, сумма масс исходных веществ равна массе продукта реакции.

М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте».
В 1789 г. французский химик А. Лавуазье доказал, что прокаливание металлов — это процесс их взаимодействия с одной из составных частей воздуха — кислородом. На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной.
Закон сохранения массы веществ можно проверить экспериментально. Для этого используют прибор, показанный на рисунке 57, а, б. Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.
Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Химические уравнения
Химические реакции можно изобразить, используя химический язык формул. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.
Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
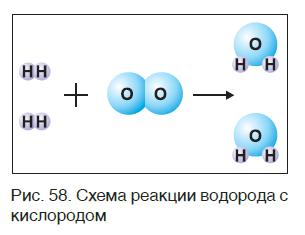
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции). Например (рис. 58):
При написании уравнений химических реакций знак «+» (плюс) соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=» (равно), который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэффициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02*10 23 ), то коэффициенты показывают и химические количества каждого из веществ:
При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:
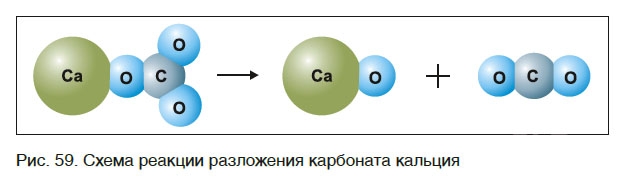
знак «↑», обозначающий, что вещество выделяется в виде газа (рис. 59):
Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электрический ток (↯) и др.
Краткие выводы урока:
- В химических реакциях соблюдается закон сохранения массы веществ: масса исходных веществ равна массе продуктов реакции.
- Сущность химической реакции состоит в перегруппировке атомов, из которых состояли исходные вещества, с образованием новых веществ.
- Число атомов каждого химического элемента до реакции должно быть равно их числу после реакции.
- Химическое уравнение — условная запись реакции при помощи химических формул и специальных знаков.
Надеюсь урок 11 «Химические уравнения» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
http://himia.my-dict.ru/q/7617354_cto-oboznacaet-bukva-t-nad-strelkoj/
http://himi4ka.ru/arhiv-urokov/urok-11-himicheskie-uravnenija.html