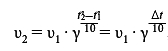КАК ВЫЧИСЛИТЬ ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ И СОСТАВИТЬ ЕЕ ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ
Вычислить тепловой эффект реакции важно для того, чтобы правильно организовать многие процессы на промышленных производствах. Это необходимо там, где используется подача энергии или где, наоборот, требуется ее отведение. Поскольку одни виды энергии могут превращаться в другие, то применение теплового эффекта химического взаимодействия позволяет превратить внутреннюю энергию веществ в работу (механическую, электрическую и т.д.).
С выделением или поглощением тепла идут процессы в живых организмах. Точный расчет тепловых эффектов превращения белков, жиров, углеводов и других веществ позволяет организовать правильную диету спортсменам, людям с теми или иными заболеваниями.
Содержание:
Что такое тепловой эффект химической реакции
Химические реакции практически всегда сопровождаются какими-либо тепловыми явлениями.
Так, горение, нейтрализация кислоты щелочью, реакция металла (например, магния) с хлором и т.д. происходят с выделением достаточного количества тепла. А вот, чтобы разложить мел (карбонат кальция), необходимо все время его нагревать. Если нагревание (то есть подвод тепла) прекратить, то и реакция тоже прекратится. Это говорит о том, что разложение карбоната кальция идет с поглощением тепла.
В чем же дело? Любое вещество является продуктом взаимодействия частиц (атомов или ионов). В ходе образования вещества энергия взаимодействия как бы прячется в химических связях (ковалентных, ионных). Это так называемая внутренняя энергия, которая частично высвобождается в ходе химического взаимодействия. Она же – тепловой эффект реакции. Измеряя его, можно судить о том, как изменилась внутренняя энергия вещества.
Тепловой эффект химической реакции обозначают буквой Q и измеряют в кДж (или в ккал в случае, когда речь идет об обеспечении энергией живых организмов).
Если в результате химического взаимодействия теплота выделяется, то это экзотермические реакции (+Q) ; если теплота поглощается – эндотермические (-Q) .
Как вычислить тепловой эффект реакции и
составить термохимическое уравнение
Взаимодействие веществ принято отражать (записывать) с помощью химического уравнения. Если в таком уравнении указан тепловой эффект, то тогда уравнение будет называться термохимическим .
Например, обычное уравнение реакции:
А это уже термохимическое уравнение данной реакции:
Уравнение говорит о том, что при взаимодействии 1 моля PbO с 1 молем СО, идущем с образованием 1 моля Pb и 1 моля CO2, выделяется 64 кДж теплоты.
Особенности термохимических уравнений:
1) указывается агрегатное состояние веществ (однако, если все вещества находятся в одном агрегатном состоянии, то его могут не указывать);
2) указывается тепловой эффект реакции в соответствии с ее стехиометрией (то есть, в соответствии с правильно расставленными коэффициентами);
3) тепловой эффект записывается в левой части уравнения;
4) если речь идет о горении вещества, то уравнение составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции называется теплотой сгорания:
5) если речь идет об образовании вещества, то уравнение также составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции будет называться теплотой образования:
А теперь разберем несколько задач, требованием которых является составление термохимического уравнения.
Что нужно сделать для решения таких задач?
1) записать условие задачи;
2) составить уравнение реакции;
3) вычислить ее тепловой эффект;
4) записать полученное значение теплового эффекта в уравнение реакции.
Пример 1. Кальций массой 8 г сгорает с выделением 127 кДж теплоты. Напишите термохимическое уравнение (тху) реакции.
Пример 2. При разложении 6,86 г оксида ртути (II) тратится 3,64 кДж тепловой энергии. Напишите термохимическое уравнение (тху) реакции.
Пример 3. Реакция 6 г углерода с водородом приводит к выделению 37,42 кДж теплоты. Напишите термохимическое уравнение (тху) реакции образования метана.
Расчеты по термохимическим уравнениям
В термохимических расчетах чаще используются уже готовые термохимические уравнения. Требуется найти массы/объемы образующихся/исходных веществ, количество выделившейся/поглощенной теплоты.
Рассмотрим несколько примеров.
Пример 4. По термохимическому уравнению: N2(г.) + O2(г.) = 2NO(г.) – 180,7 кДж вычислите тепловой эффект реакции, в которой участвует азот объемом 5,6 л (при н.у.).
Поскольку реакция эндотермическая, то поглотится 45,2 кДж энергии.
Пример 5. Тепловой эффект реакции горения этилена составляет 1400 кДж (в расчете на 1 моль этилена). Сколько этилена (при н.у.) необходимо сжечь, чтобы получить 560 кДж теплоты?
Пример 6. Пользуясь термохимическим уравнением сгорания пропана
определите количество выделившейся теплоты, если в реакцию вступит кислород: а) массой 16 г; б) объемом 67,2 л; в) количеством вещества 2,5 моль. Сколько оксида углерода (IV) по объему и по массе получится, если при горении пропана выделится 277,5 кДж теплоты?
Если вы готовитесь к выпускному экзамену ( ЕГЭ по химии ), то имейте ввиду, что вычислить тепловой эффект реакции требует задание № 27 (версия 2022 года ).
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию 
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
Решая которое, находим, что:
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/teplovoj-jeffekt-himicheskoj-reakcii-termohimicheskie-uravnenija
http://prosto-o-slognom.ru/chimia_primery/005-termochimicheskie_uravneniya.html