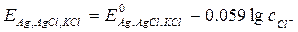Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Факторы, влияющие на величину электродного потенциала
Электродный равновесный потенциал зависит от следующих основных факторов.
От природы металла. Чем большей химической активностью обладает данный металл, тем в большей степени равновесие (4.1) смещено вправо, тем отрицательнее потенциал.
От концентрации ионов металла в растворе.Переход ионов металла в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие (4.1) смещается влево и потенциал становится более положительным.
От температуры. С повышением температуры потенциал становится более положительным, т.е. равновесие (4.1) смещается влево.
Зависимость величины потенциала от указанных факторов выражается уравнением Нернста:
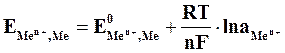
где 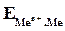
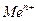
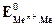
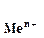
Если в уравнение (4.2) подставить значения постоянных R, F, принять температуру для стандартных условий (Т 0 = 298К) и перейти от натуральных к десятичным логарифмам, получим:
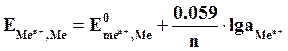
Из уравнения (4.3) следует, что стандартный электродный потенциал (E 0 ) – это потенциал электрода при стандартных условиях: 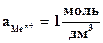
Величина (Е 0 ) характеризует химическую активность металла.
4.4. Типы электродов
В зависимости от свойств веществ, участвующих в электродных процессах, все электроды можно разделить на несколько типов.
Электроды первого рода. К этому типу относятся все металлические электроды в водородный электрод. Условное обозначение таких электродов: Ме|Ме n + , например Cu|Cu 2+ , водородный: (Pt)H2|H + . Вертикальная черта символизирует поверхность раздела фаз. Общим для этих электродов является то, что в равновесии на электроде участвуют нейтральные атомы (или молекулы) и один вид катионов. Такие электроды являются обратимыми относительно катионов.
Электроды второго рода.Такие электроды состоят из трех фаз: металл покрыт слоем труднорастворимой соли этого металла, а в растворе, куда он опущен, находятся те же анионы, которые входят в состав труднорастворимой соли.
Например, хлорсеребряный электрод: Ag, AgCl|KCl; каломельный электрод: Hg, Hg2Cl2|KCl.
Между твердой фазой и раствором на этих электродах возникают следующие равновесия:
Ag + Cl − − ē D AgCl
В отличие от электродов первого рода здесь в равновесии участвуют анионы, т.е. электроды второго рода обратимы относительно анионов. Величина потенциала этих электродов зависит от концентрации анионов:
Эти электроды в лабораторной практике обычно используют в качестве электродов сравнения.
Окислительно-восстановительные электроды. Эти электроды представляют собой пластинку из благородного металла (чаще всего платины), погруженную в раствор, содержащий ионы одного элемента в разной степени окисления. Например, Pt|Fe 3+ , Fe 2+ ; Pt|Sn 4+ , Sn 2+ .
На поверхности платины происходит обмен электронами между ионами и устанавливаются равновесия:
Sn 2+ − 2ē D Sn 4+
Платина в этих равновесиях не участвует и играет роль переносчика электронов. Величина потенциала может быть рассчитана по уравнению Нернста:
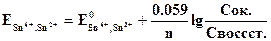
где 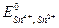
Величина стандартного окислительно-восстановительного потенциала характеризует свойства окислителей и восстановителей, а именно:
чем выше Е 0 , тем более сильным окислителем являются ионы в высшей степени окисления;
Дата добавления: 2015-09-28 ; просмотров: 12325 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://helpiks.org/5-38376.html