Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1e9aa28cc276b5 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
МОЛЕКУЛЯРНОСТЬ И КИНЕТИЧЕСКИЙ ПОРЯДОК РЕАКЦИИ
К элементарным реакциям применимо понятие «молекулярность реакции», которое характеризует число частиц, участвующих в элементарном взаимодействии.
Различают моно-, би- и тримолекулярные реакции, в которых участвуют соответственно одна, две и три частицы.
PCl5(г) ⇄ PCl3(г) + Cl2(г) (мономолекулярная) 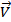
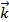
I2(г) + H2(г) ⇄ 2HI(г) (бимолекулярная) 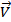
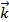
2NO(г) + Cl2(г) ⇄ 2NOCl(г) (тримолекулярная) 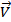
Столкновение четырех частиц одновременно невероятно. Максимально возможно столкновение трех частиц.
В случае сложных реакций совокупность элементарных стадий составляет механизм химической реакции. Стадия, имеющая наименьшую скорость, является определяющей и называется лимитирующей стадией реакции.
Порядок реакции определяет характер зависимости скорости от концентрации. Истинный порядок реакции определяется по уравнению, описывающему скорость лимитирующей стадии процесса, полученному из эксперимента. Таким образом, общий (суммарный) кинетический порядок реакции – сумма показателей степеней при концентрациях реагирующих веществ в уравнении лимитирующей скорости реакции, определенном экспериментально.
Так, если для реакции А + В + С 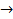
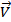
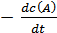
то n1 + n2 + n3 = n – общий кинетический порядок реакции; n1 , n2, n3 – порядок реакции по каждому из компонентов А, В, С; n1 , n2, n3 могут быть целыми или дробными числами.
Реакции, скорость которых не зависит от концентрации, имеют нулевой порядок.
Для элементарных процессов n1 , n2, n3 совпадают со стехиометрическими коэффициентами в уравнении реакции, т.е. молекулярность совпадает с общим кинетическим порядком реакции. Если уравнение реакции не отражает ее механизм, порядок реакции не зависит от стехиометрических коэффициентов.
Рассмотрим химическую реакцию:
Согласно уравнению реакции 
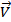
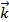
Поскольку порядок реакции не соответствует стехиометрическим коэффициентам ее полного уравнения, реакция не может протекать в одну стадию, которая включала бы столкновение между молекулами NO2 и CO. Установлено, что эта реакция протекает в две бимолекулярные стадии:
1) NO2(г) + NO2(г) → NO(г) + NO3(г) 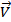
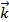
2) NO3(г) + CO(г) → NO2(г) + CO2(г) 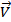
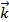
Каждая из этих стадий называется элементарной реакцией. На первой стадии происходит столкновение двух молекул NO2, в результате чего атом кислорода переходит от одной из молекул NO2 к другой. Образовавшийся NO3 затем быстро передает атом кислорода молекуле CO, в результате чего получается молекула CO2 и молекула NO2.
Первая стадия является лимитирующей. Она определяет скорость процесса. Суммарный порядок полной реакции определяется молекулярностью лимитирующей стадии.
Частица NO3(г) является интермедиатом (промежуточным
продуктом) поскольку она не входит ни в число реагентов, ни в число продуктов, а лишь образуется в одной элементарной реакции и поглощается в следующей. В этой реакции показатели степени при концентрациях реагентов (два для диоксида азота и нуль для монооксида углерода) со стехиометрическими коэффициентами не совпадают. Они отражают молекулярность (и стехиометрию) лимитирующей стадии (1) и отсутствие влияния участников второй быстрой стадии на скорость реакции в целом. Энергетическая диаграмма этого процесса представлена на рис.1.
| координата реакции |
| Eа1 |
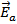 |
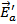 |
| NO2 + CO |
| ПС1 |
| NO3 + NO |
| ПС2 |
| NO + CO2 |
Рис.1 Энергетическая диаграмма двухстадийной реакции
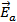
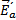
Дата добавления: 2015-07-24 ; просмотров: 904 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Напишите кинетическое уравнение ( влияние скорости) для следующих реакций CO2 + C = 2CO 2NO + O2 = 2NO2?
Химия | 10 — 11 классы
Напишите кинетическое уравнение ( влияние скорости) для следующих реакций CO2 + C = 2CO 2NO + O2 = 2NO2.
Напишите уравнения химических реакций по следующим описаниям?
Напишите уравнения химических реакций по следующим описаниям.
Кинетическое уравнение (влияние скорости) для следующих реакций : ) 2CO + O2 = 2CO2б) 2NO2 = N2O4?
Кинетическое уравнение (влияние скорости) для следующих реакций : ) 2CO + O2 = 2CO2
Помогите пожалуйста?
Напишите уравнения реакций следующих превращений.
Помогите составить кинетическое уравнение реакции?
Помогите составить кинетическое уравнение реакции.
Напишите уравнения реакций для следующих превращений ?
Напишите уравнения реакций для следующих превращений :
Напишите выражение кинетического закона действующих масс для следующей реакции : СО(г) + Cl2(г) → COCl2(г)?
Напишите выражение кинетического закона действующих масс для следующей реакции : СО(г) + Cl2(г) → COCl2(г).
Напишите уравнения след?
Напишите уравнения след.
Напишите уравнения реакций, протекающих при осуществлении следующих превращений?
Напишите уравнения реакций, протекающих при осуществлении следующих превращений.
Напишите уравнения реакций, позволяющих осуществить следующие превращения ?
Напишите уравнения реакций, позволяющих осуществить следующие превращения :
Напишите кинетические уравнения химических реакций для следующих процессов?
Напишите кинетические уравнения химических реакций для следующих процессов.
На этой странице находится ответ на вопрос Напишите кинетическое уравнение ( влияние скорости) для следующих реакций CO2 + C = 2CO 2NO + O2 = 2NO2?, из категории Химия, соответствующий программе для 10 — 11 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
Радиус атома уменьшается.
6. 2 и 4 если я не ошибаюсь.
Пишем схему реакции и расставляем степени окисления над окислителем и восстановителем Составляем баланс В соответствии с балансом ставим коэффициенты .
С помощью схемы например возьмём водород — Н + 1(заряд ядра, по порядковому номеру)Н(обозначение хим. Элемента) дальше идут энергетические уровни, схема выглядит так + 1Н) ¹ē или + 14Si ) ) ) 2ē 8ē 4ē.
Атом состоит из атомного ядра и электронной оболочки. Ядро атома состоит из протонов (p + ) и нейтронов (n0). У большинства атомов водорода ядро состоит из одного протона. Число протонов N(p + ) равно заряду ядра (Z) и порядковому номеру элемента ..
1) Азот / элемент N / молекула N2 2) Фтор / элемент F / молекула F2 3) Аргон / элемент Ar / молекула Ar 4) Кислород / элемент О / молекула О2 Ответ 3) Аргон.
Поваренная соль — белый кристаллический порошок, без запаха, хорошо растворим в воде. Соль — имеет вкус соленый. Соль естественый минерал не ограничный продукт. Соль бывает океаническая, морская и которая добывается в рудниках. Отличается микроэл..
Кристаллические соль лёд.
В кристаллических веществах атомы расположены в строгом порядке — в узлах кристаллической решетки. В аморфных веществах атомы расположены беспорядочно, так же, как и в жидкостях. Кристаллические вещества имеют строго определенную температуру плавле..
CaCO3 — — — >CaO + CO2 это обратная реакция.
http://helpiks.org/4-29524.html
http://himia.my-dict.ru/q/2679995_napisite-kineticeskoe-uravnenie-vlianie-skorosti-dla/









