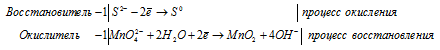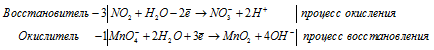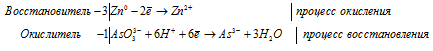Используя метод электронного баланса, составьте уравнение реакции: Cr2O3 + … + KOH → KNO2 +K2CrO4 + … Определите окислитель и восстановитель.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Cr2O3 + KNO3 + KOH
Cr2O3 + KNO3 + KOH ? ? Домашняя работа.
Слайд 24 из презентации «Составление уравнений окислительно- восстановительных реакций Химия, 11 класс»
Размеры: 720 х 540 пикселей, формат: .jpg. Чтобы бесплатно скачать слайд для использования на уроке, щёлкните на изображении правой кнопкой мышки и нажмите «Сохранить изображение как. ». Скачать всю презентацию «Составление уравнений окислительно- восстановительных реакций Химия, 11 класс.pptx» можно в zip-архиве размером 1054 КБ.
Реакции
«Смещение химического равновесия» — Костанта равновесия. Температура. Обратимые реакции. Реакции, протекающие в данных условиях одновременно в двух противоположных направлениях. Давление. Состояние равновесия в природе. Формирование на межпредметном уровне представлений. Совершенствовать интеллектуальные умения. Тесты с выбором одного правильного ответа.
«Химические реакции практическая работа» — 3)Образуется красно-бурый раствор. 2)Чистый Н2 взрывается с глухим хлопком, Н2 с примесями- лающий звук. Выделяющийся газ собрать в 2 стакана. Выделяющийся газ пропустить через CuO. Практическая работа №5. Н2 – Газ , без цвета, запаха, легче воздуха. 4)В О2 уголь горит ярко-желтым пламенем, Ca(OH)2 мутнеет.
«Органическая химия» — Электроны принял ион MnO4-. Ион MnO4- является окислителем. Ион MnO4 превратился в Mn2+. Преимущества метода полуреакций. Степень окисления в органической химии. Метод электронного баланса. Ион MnO4 полностью потерял 4 атома кислорода. Метод полуреакций. ОВР в органической химии. Рассмотрим, что произошло с ионом MnO4-.
«Скорость реакции» — Площадь соприкосновения. Концентрация реагирующих веществ. Определите тип реагирующих систем. Что мы изучали? Площадь соприкосновения реагирующих веществ. Природа реагирующих веществ. Влияние температуры. 2. Запишите кинетическое уравнение для реакции: 2Н2 +О2= 2Н2О. Отчёт групп. Температура. Влияние концентрации реагирующих веществ (для гомогенных систем) 3ряд.
«Химические реакции 11 класс» — Кроссворд. Распад вещества на ионы. Биологически активные катализаторы. Реакции, в которых указан тепловой эффект. CuO – Класс соединения. Реакция обмена с водой. NaOH +HCl = NaCl +H2O Тип реакции. Вещества, имеющие одинаковый состав, но разные свойства. 2NaNO3 ? 2NaNO2 + O2 Тип реакции. Вещества, замедляющие скорость химических реакций.
«Превращения веществ» — Раствор йода. Вещества находятся в 3 агрегатных состояниях. Подвести учащихся к пониманию термина «вещество». Закрепление материала. Тела и вещества. Химия . Здесь вы видите конверт. Смешали соду, кислоту. Тела . Вода. Добро пожаловать в мастерскую научного волшебства. Подведение итогов практической работы.
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-631-632
http://900igr.net/prezentacija/khimija/sostavlenie-uravnenij-okislitelno-vosstanovitelnykh-reaktsij-khimija-11-klass-261784/cr2o3-kno3-koh-24.html