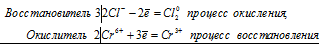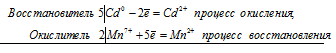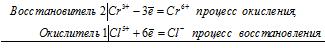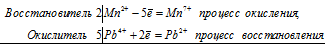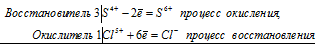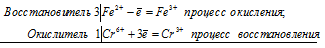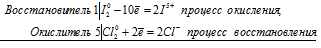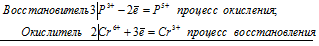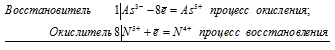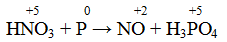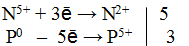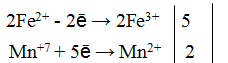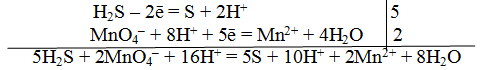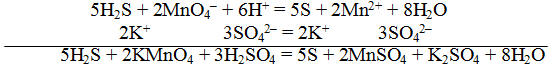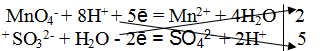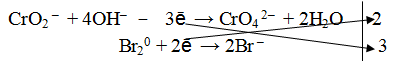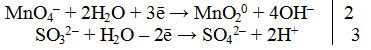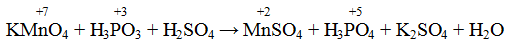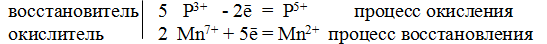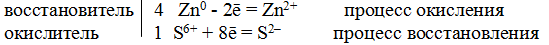Правильное составление электронных уравнений реакций
Решение задач на составлении электронных уравнений химических реакций
Задание 236.
Реакции выражаются схемами:
HCl + CrO3 ⇔ Cl2 + CrCl3 + H2O;
Cd + KMnO4 + H2SO4 ⇔ CdSO4 + MnSO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а) HCl + CrO 3 ⇔ Cl2 + CrCl 3 + H 2 O
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, CrO3 – окислитель; HCl окисляется до Сl2, CrO3 – восстанавливается до CrCl3.
5Сd 0 + 2Mn 7+ = Cd 2+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cd – восстановитель, KMnO 4 – окислитель; Cd окисляется до CdSO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 237.
Реакции выражаются схемами:
Cr2O3 + KClO3 + KOH ⇔ K2CrO4 + KCl + H2O;
MnSO4 + PbO2 + HNO3 ⇔ HMnO4 + Pb(NO3)2 + PbSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + Cl 5+ = 2Cr 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cr2O3 – восстановитель, KClO3 – окислитель; Cr2O3 окисляется до K2CrO4, KClO3 – восстанавливается до KCl.
5Pb 4+ + 2Mn 2+ = 5Pb 2+ + 2Mn 7+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 5 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: PbO2 – восстановитель, MnSO4 – окислитель; PbO2 окисляется до Pb(NO3)2, MnSO4 – восстанавливается до HMnO4.
Задание 238.
Реакции выражаются схемами:
H2SO3 + HClO3 ⇔ H2SO4 + HCl;
FeSO4 + K2Cr2O7 + H2SO4 ⇔ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H2SO3 – восстановитель, HClO3 – окислитель; H2SO3 окисляется до H2SO4, HClO3 – восстанавливается до HCl.
3Fe 2+ + Cr 6+ = 3Fe 3+ + Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов три. Разделив это число на 3, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 3 на 1 получаем коэффициент 3 для восстановителя и продукта его окисления. Учитывая, что в схеме реакции указаны вещества, содержащие железо и хром с двумя атомами в молекулах Fe2(SO4)3 и Cr2(SO4)3], умножим коэффициенты при окислителе и восстановителе на 2, получим молекулярное уравнение реакции:
Задание 239.
Реакции выражаются схемами:
I2 + Cl2 + H2O ⇔ HClO3 + HCl;
K2Cr2O7 + H3PO3 + H2SO4 ⇔ Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
I 2 0 + 5Cl2 0 ⇔ 2I — + 10Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 10 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: I2 – восстановитель, Cl2 – окислитель; I2 окисляется до HIO3, Cl2 – восстанавливается до HCl.
3P 3+ + 2Cr 6+ = 3P 5+ + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H 3PO 3 – восстановитель, K 2Cr 2O 7 – окислитель; H 3PO 3 окисляется до H 3PO 4, K 2Cr 2O 7 – восстанавливается до Cr 2(SO 4) 3.
Задание 240.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВг; б) K2Cr2O7 и Н3PO3; в) HNO3 и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
АsH3 + НNO3 ⇔ Н3AsO4 + NO2 + Н2O
Решение:
а) Степень окисления в РH3 n(Р) = -3 (низшая), в HBr n(Br) = -1 (низшая). Так как и фосфор, и бром находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в K2Cr2O7 n(Сr) = +6 (высшая); в Н3PO3 n(Р) = +5 (высшая). Так как и хром, и фосфор находятся в своей высшей степени окисления, то оба вещества проявляют только окислительные свойства и взаимодействовать друг с другом не могут;
в) в HNO3 n(N) = +5 (высшая); в H2S n(S) = -2 (низшая). Следовательно, взаимодействие этих веществ возможно, причём HNO3 является окислителем, а H2S – восстановителем.
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
As 3- + 8N 5+ = As 5+ + 8N 4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 1, получаем коэффициент 8 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Хром. Химия хрома и его соединений
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии :
+24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 

3s 


Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Температура плавления 1890 о С, температура кипения 2680 о С, плотность хрома 7,19 г/см 3 .
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
Качественные реакции
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами . При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Например , хлорид хрома (II) взаимодействует с гидроксидом натрия:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами . При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Например , хлорид хрома (III) взаимодействует с гидроксидом калия:
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Обратите внимание , если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс:
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr 2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4 +
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr 3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4 +
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
1.3. Хром взаимодействует с фосфором . При этом образуется бинарное соединение – фосфид хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000 о С с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Например , хром бурно реагирует с соляной кислотой :
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
2.5. Растворы щелочей на хром практически не действуют.
2.6. Однако хром способен вытеснять многие металлы , например медь, олово, серебро и др. из растворов их солей.
Например , хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди:
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Например , при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия:
Хлорат калия и нитрат калия также окисляют хром:
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами :
1. Термическим разложением гидроксида хрома (III):
2. Разложением дихромата аммония:
3. Восстановлением дихромата калия углеродом (коксом) или серой:
Химические свойства
Оксид хрома (III) – типичный амфотерный оксид . При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами.
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
Например , оксид хрома (III) взаимодействует с оксидом натрия:
2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—хромиты, а в растворе реакция практически не идет . При этом оксид хрома (III) проявляет кислотные свойства.
Например , оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды:
3. Оксид хрома (III) не взаимодействует с водой.
4. Оксид хрома (III) проявляет слабые восстановительные свойства . В щелочных расплавах окислителей окисляется до соединений хрома (VI).
Например , оксид хрома (III) взаимодействует с нитратом калия в щелочной среде:
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Озоном или кислородом:
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами .
Например , оксид хрома (III) реагирует с серной кислотой:
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Например , оксид хрома (III) реагирует с алюминием (термит):
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната калия:
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом . Все соединения хрома (II) – сильные восстановители.
2. При высоких температурах оксид хрома (II) диспропорционирует :
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами .
Например , оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниями и основными оксидами .
Например , оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия:
Или с оксидом лития с образованием хромата лития:
3. Оксид хрома (VI) – очень сильный окислитель : окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Например , сера окисляется до оксида серы (IV):
Оксид хрома (VI) также окисляет сложные вещества, например , сульфиты:
И некоторые органические веществ, например , этанол:
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например , хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например , хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами . При этом образуются средние соли.
Например , гидроксид хрома (III) взаимодействует с соляной кислотой с образованием хлорида хрома (III):
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли . При этом гидроксид хрома (III) проявляет кислотные свойства.
Например , гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
4. Г идроксид хрома (III) разлагается при нагревании :
5. Под действием окислителей в щелочной среде переходит в хромат.
Например , при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
Например , хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II) и хлорида аммония:
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
Например , хлорид хрома (II) реагирует с гидроксидом калия с образованием гидроксида хрома (II) и хлорида калия:
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид хрома (II) проявляет основные свойства . В частности, реагирует с растворимыми кислотами .
Например , гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II). Соли хрома (II) окрашивают раствор в синий цвет.
2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II):
3. Гидроксид хрома (II) – сильный восстановитель.
Например , под действием кислорода воздуха гидроксид хрома (II) окисляется до гидроксида хрома (III):
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например , хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например , хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III) . Например , хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства . окисляются под действием сильных окислителей в щелочной среде.
Например , бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например , гексагидроксохроматы окисляются бромом в щелочи:
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Например , цинк реагирует с хлоридом хрома (III):
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например , при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например , хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например , хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например , хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например , дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например , дихромат калия реагирует с сульфитом натрия в нейтральной среде:
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например , хромат калия окисляет гидросульфид аммония в щелочной среде:
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например , дихромат калия окисляет сероводород в присутствии серной кислоты:
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
Составление уравнений окислительно-восстановительных реакций
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Составление уравнений окислительно-восстановительных реакций.
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает характер химической связи в молекуле и наличие тех ионов, которые в действительности существуют в растворе, например, MnO4 – , SO4 2- , Cr2O7 2- . При реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, поэтому число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. При составлении уравнений окислительно-восстановительных реакций для того, чтобы правильно написать продукты реакции, необходимо знать свойства реагирующих веществ.
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
Следовательно, молекулярное уравнение реакции имеет следующий вид:
2) Определить величину и знак степени окисления элементов до реакции и после реакции.
3) Составить электронный баланс
4) Подставить найденные коэффициенты в уравнение реакции.
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
Составляем уравнения электронного баланса
Подставляем найденные коэффициенты в уравнение реакции. Подсчитываем количество групп в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие -группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства.
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
8.3.2. Ионно-электронный метод.
При составлении электронно-ионных уравнений следует исходить не из изменения степени окисления элементов в реагирующих веществах, а нужно учитывать действительно существующие ионы в водном растворе с точки зрения теории электролитической диссоциации. Например, если реакция происходит с участием перманганата калия, то в реакции окислителем будут ионы MnO4 – , а не ионы Mn 7+ , так как перманганат калия в водном растворе диссоциирует KMnO4↔K + +MnO4 – . При этом вещества неионного характера и недиссоциирующие изображаются в электронных уравнениях в виде молекул: NH3, CO, NO2, SiO2, P.
В окислительно-восстановительных реакциях могут получаться различные продукты реакции в зависимости от характера среды – кислой, щелочной, нейтральной. Для таких реакций в молекулярной схеме необходимо указывать окислитель, восстановитель и вещество, характеризующее реакцию среды (кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо руководствоваться правилами стяжения, указывать ионы, характеризующие реакцию среды: H + , OH – , H2O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O +2 образует с ионами H + молекулы воды:
2. В нейтральной или щелочной среде избыток ионов O 2- образует с молекулами воды гидроксид – ионы:
3. В щелочной среде недостаток ионов O 2– компенсируется двумя ионами OH – , одновременно образуется одна молекула воды:
| Реакция среды | Избыток ионов О 2– | Недостаток ионов О 2– |
| окислитель | восстановитель | |
| Кислая | Н + Н2О | Н2O 2Н + |
| изб. O 2– + 2H + = Н2О | Н2О 2Н + + O 2– | |
| Нейтральная | H2O OH – | Н2O 2Н + |
| изб. О 2– + Н2О 2OН – | Н2О 2Н + + О 2– | |
| Щелочная | Н2O ОН – | 2OН – Н2О |
| изб. О 2– + Н2O 2OН – | 2OН – Н2О + О 2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО – 4 (он имеет малиновую окраску) в ион Mn 2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO – 4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO – 4 + 8H + +5e – = Mn 2+ +4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO – 4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:
Сократив на 10 Н + , окончательно получим
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая
1. Составить схему реакции
Из опытных данных знаем, что окислителем является КМnO4. Ион MnO4 – восстанавливается в кислой среде до Мn 2+ (фиолетово-малиновая окраска иона MnO4 – становится бесцветной, переходя в Мn 2+ – ион), следовательно, ион SO3 2 – будет являться восстановителем, переходя в ион SO4 2- .
2. Составить электронно-ионные уравнения
а) для окислителя
Из ионной схемы видно, что, ион MnO4 – – превращается в ион Мn 2+ , при этом освобождаются ионы О 2- , которые по правилу стяжения в кислой среде связываются ионами Н + , образуя молекулы Н2O.
б) для восстановителя
Из ионной схемы видно, что ион SO3 2- превращается в ион SO4 2- . Для этого превращения необходимо добавить ион О 2- , который берется из молекулы H2O (реакция протекает в водной среде), при этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4 – + 8H + + 5ē = Mn 2+ + 4H2O
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
6. Сократить в левой и правой части уравнения 10 Н + и 5Н2O. Получается ионное уравнение:
7. По ионному уравнению составить молекулярное уравнение реакции:
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
Окислителем в данной реакции является молекула брома, следовательно, восстановителем будет являться метахромит калия, а именно ион СrO2 – .
2. Составить электронно-ионное уравнение
а) для окислителя
б) для восстановителя
Из ионной схемы видно, что ион CrO2 – превращается в ион СгО4 2– . Каждый недостающий ион О 2– берется по правилу стяжения из двух гидроксильных ионов (среда щелочная ОН – ), при этом одновременно образуется одна молекула воды.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
Окислителем является КМnO4, так как ион элемента в своей высшей степени окисления не способен более отдавать электроны (Мn +7 ). Восстановителем является сульфит калия K2SO3.
2. Составить электронно-ионное уравнение
а) для окислителя
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
Из ионной схемы видно, что ион SО3 2- превращается в ион SO4 2- , для этого необходимо добавить один ион О 2- , который берется из молекулы Н2O (реакция протекает в водной среде). При этом освобождаются два иона Н + .
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S), соответственно, равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn), соответственно, равна: + 4 (промежуточная), +7 (высшая). Отсюда: NН3, H2S — только восстановители; HNO3, H2SO4, КMnО4 — только окислители; НNО2, Н2SО3, MnO2 — окислители и восстановители.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
а) Степень окисления в Н2S n(S) = -2; в HI n(I) = -1. Так как и сера и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная).
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
в) в Н2SO3 n(s) = +4 (промежуточная); в НС1O4 n(Сl) = +7 (высшая). Взятые вещества могут взаимодействовать, Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
Составляем уравнение реакции:
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn 2+ .
http://chemege.ru/chrom/
http://farmf.ru/lekcii/sostavlenie-uravnenij-okislitelno-vosstanovitelnyh-reaktsij/