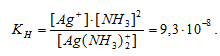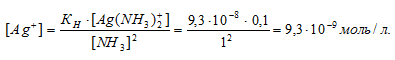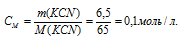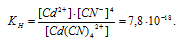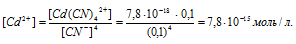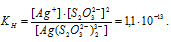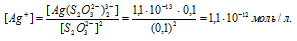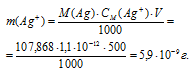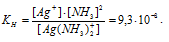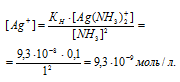Cu hg no3 2 уравнение реакции ионное
Вопрос по химии:
Помогите составить молекулярное уравнение,полное и сокращенное ионное уравнение реакции
Cu+Hg2(No3)2
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Cu + Hg₂(NO₃)₂ = Cu(NO₃)₂ + Hg
Cu²⁺ + 2Hg⁺ + 2NO₃⁻ = Cu(NO₃)₂ + Hg⁺
Cu²⁺ + 2NO₃⁻ = Cu(NO₃)₂
Вроде так)
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
K3[Cu(CN)4]+Hg(NO3)2→…. Установите, произойдет ли взаимодействие между растворами указанных электролитов. Ответ обоснуйте. Напишите уравнения реакций в молекулярной и ионно-молекулярной форме






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Установите, произойдет ли взаимодействие между растворами указанных электролитов. Ответ обоснуйте. Напишите уравнения реакций в молекулярной и ионно-молекулярной форме, вещества назовите, для комплексных соединений напишите выражение констант нестойкости:
Решение:
| Если вам нужно решить химию, тогда нажмите ➔ помощь по химии. |
| Похожие готовые решения: |
- Сколько граммов бромида натрия и диоксида марганца и какой объем серной кислоты с массовой долей H2SO4 12 % и плотностью 1,08 г/мл затрачивается на получение 200 граммов брома при выходе реакции 90 %?
- Сколько граммов Na2S2O3•5H2O способно вступить в реакцию с 250 мл 0,2 н раствора йода, если известно, что продуктами реакции являются тетратионат натрия (Na2S4O6) и йодид натрия?
- Какой объем однонормального раствора гидроксида калия необходимо добавить к 100 мл раствора хлорида олова (II) с концентрацией 4 % и плотностью 1,03 г/мл, чтобы перевести хлорид олова (II)
- Составьте координационные формулы следующих комплексных соединений кобальта: CoCl3 . 6NH3; CoCl3 . 5NH3; CoCl3 . 4NH3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Уравнения химических реакций комплексных соединений в молекулярной и ионно-молекулярной форме
Задача 729.
Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнения реакций в молекулярной и ионно-молекулярной форме:
а) К2[HgI4] + KBr;
б) К2[HgI4] + KCN;
в) [Ag(NH3)2]Cl + K2S2O3;
г) K[Ag(CN)2] + KBr;
д) K[Ag(CN)2] + NH3;
е) K[Ag(NO2)2] + NH3;
ж) [Ag(NH3)2]Cl + NiCl2;
з) K3[Cu(CN)4] + Hg(NO3)2.
Решение:
а) К2[HgI4] + KBr
Реакция не протекает так как Kн(K2[HgI4] 2- ) 2- ),
При диссоциации К2[HgI4] и KBr образуются ионы К +, Br — и [HgI4] 2- , который обладает большой устойчивостью:
2K + + [HgI4] 2- + K + + Br — = 3K + + [HgI4] 2- + Br — — реакция не протекает.
б) К2[HgI4] + KCN
Реакция протекает так как Kн(K2[HgI4]) > Kн(K2[Hg(CN)4], получим:
K2[HgI4] + 4KCN = K2[Hg(CN)4] + 4KI (молекулярная форма);
2K + + [HgI4] 2- + 4K + + 4CN — = 2K + + [Hg(CN)4] 2- + 4K + + 4I — (полная ионная форма);
[HgI4] 2- + 4CN — = [Hg(CN)4] 2- + 4I — (сокращенная ионная форма).
г) K[Ag(CN)2] + KBr;
Реакция не протекает так как при диссоциации K[Ag(CN)2] и KBr образуются ионы К+, Br- и [Ag(CN)2]-, который обладает большой устойчивостью.
д) K[Ag(CN)2] + NH3
Реакция не протекает так как Kн([Ag(CN)2] — ) + ). При диссоциации K[Ag(CN)2] образуются ионы К + и [Ag(CN)2] — , который ведет себя в обменных реакциях как неразрывное целое:
K[Ag(CN)2] + NH3 = K + + [Ag(CN)2] — + NH3.
е) K[Ag(NO2)2] + NH3
При диссоциации K[Ag(NO2)2] образуются ионы K + и [Ag(NO2)2] — , который обладает большой устойчивостью:
K[Ag(NO2)2] = K + и [Ag(NO2)2] — . Реакция не протекает, так как ион [Ag(NH3)2] + не образуется, потому что Kн([Ag(NO2)2] — ) + .
ж) [Ag(NH3)2]Cl + NiCl2
Как электролиты обе соли диссоциируют:
[Ag(NH3)2]Cl = [Ag(NH3)2] + + Сl — ;
NiCl2 = N1 2+ + 2Cl — .
Ионы Ag + и Cl — соединяясь друг с другом образуют нерастворимое соединение AgCl, а ион Ni 2+ с NH3 образует комплекс [Ni(NH3)6] 2+ , так как Kн (Ni(NH3)6] 2+ ) + ), получим:
3[Ag(NH3)2]Cl + NiCl2 = [Ni(NH3)6]Сl2 + 3AgCl↓ (молекулярная форма);
3[Ag(NH3)2] + + Cl — + Ni 2+ + 2Cl — = [Ni(NH3)6] 2+ + 2Сl — + 3AgCl↓ (полная ионная форма);
3[Ag(NH3)2] + + Ni 2+ + 3Cl — = [Ni(NH3)6] 2+ + 3AgCl↓ (сокращенная ионная форма).
Задача 730.
Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -8 . Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag + + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
Ответ: 9,3 . 10-8 моль/л.
Задача 731.
Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л КCN.
Решение:
M(KCN) = 65г/моль. Рассчитаем концентрацию цианида калия:
Константа нестойкости иона [Cd(CN)4] 2+ равна 7,8 . 10 -18 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов CN — , создаваемого в результате диссоциации КCN (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов CN — , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Сd 2+ ] = С(соли) = 0,01 моль/л. По той же причине равновесная концентрация ионов [Cd(CN)4] 2- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Сd 2+ :
Ответ: 7,8 . 10-15 моль/л.
Задача 732.
Найти массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора дитиосульфатоаргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
Решение:
М(Ag) = 107,868г/моль. Константа нестойкости иона [Ag(S2O3)2] 3- равна 1,1 . 10 -13 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов S 2 O 3 2- , создаваемого в результате диссоциации К2S2O3 (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов S 2 O 3 2- , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Ag + ] = С(К2S2O3) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(S2O3)2] 3- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).По условию задачи:
Отсюда выражаем концентрацию ионов Ag + :
Теперь рассчитаем массу серебра, находящуюся в виде ионов в количестве 1,1 . 10 -12 моль/л в растворе комплексной соли:
Ответ: 5,9 . 10 -9 г.
Задача 733.
Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 м раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 1 . 10 -5 моль КВг; б) 1 . 10 -5 моль КI? ПР(AgBr) = 6 . 10 -13 ; ПР(AgI) = 1,1 . 10 -16 .
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -9 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
а) Уравнение реакции имеет вид:
Из уравнения реакции следует, что из 1 моль КBr и 1 моль [Ag(NH 3 ) 2 ]NO 3 образуется 1 моль AgBr. Так как [Ag + ] = 9,3 . 10 -9 моль/л; [Br — ] =1 . 10 -5 моль/л, то произведение концентраций ионов Ag + и Br — будет равна: (9,3 . 10 -9 ) . (1 . 10 -5 ) = 9,3 . 10 -14 . Так как 9,3 . 10 -14 > 1,1 . 10 -16 , то осадок бромида серебра не образуется.
http://natalibrilenova.ru/k3cucn4hgno32-ustanovite-proizojdet-li-vzaimodejstvie-mezhdu-rastvorami-ukazannyih-elektrolitov-otvet-obosnujte-napishite-uravneniya-reaktsij-v-molekulyarnoj-i-ionno-molekulyarnoj-forme/
http://buzani.ru/zadachi/khimiya-glinka/1248-khimicheskie-reaktsii-kompleksnykh-soedinenij-za9-733