ГДЗ (ответы) Химия 9 класс Попель П.П., Крикля Л.С., 2017 ПРАКТИЧЕСКАЯ РАБОТА №3 Свойства уксусной (этановой) кислоты
Действие уксусной кислоты на индикатор
кислоты на полоску
Уксусная кислота имеет
Наличие ионов Гидрогена,
которые образуются при
диссоциации ее молекул,
является причиной изменения
Уравнение электролитической диссоциации уксусной кислоты:
ОПЫТ 2
Реакция уксусной кислоты с металлом
В пробирку с гранулой
цинка наливаем 2 мл
На поверхности гранулы
Составляем уравнения реакций в молекулярной и ионно-молекулярной формах .
ОПЫТ 3
Реакция уксусной кислоты с оснвным (амфотерным) оксидом
В пробирку с порошком
купрум (II) оксида
Составляем уравнения реакций в молекулярной и ионно-молекулярной формах .
2CH 3 COOH + СuO -> 2CH 3 COO — + Cu 2+ + H 2 O
ОПЫТ 4
Реакция уксусной кислоты со щелочью
| Действия | Наблюдение | Выводы | ||||||||||||||||||||||||||||||||||||||||||||||
| Действия | Наблюдения | Выводы | |||||||||||||||||||||||||||||||||||||||||||
| Действия | Наблюдения | Выводы | ||||||||||||||||||||||||||||||||||||||||
| Ацетат меди (II) | |
|---|---|
| Систематическое наименование | Ацетат меди (II) |
| Традиционные названия | Уксуснокислая медь |
| Хим. формула | C4H6CuO4 и Cu2(CH3CO2)4(H2O)2 |
| Рац. формула | (CH3COO)2Cu |
| Состояние | твёрдое |
| Молярная масса | 181.65(безводный) 199.67(моногидрат) г/моль |
| Плотность | 1.882 г/см³ |
| Температура | |
| • плавления | 115 °C |
| • кипения | 240 °C |
| • разложения | 290 °C |
| Растворимость | |
| • в воде | 7.2\20(холодная\горячая вода) |
| • в этаноле | растворим |
| • в ацетоне | малорастворим (0.28г на 100г при 15°С) |
| Рег. номер CAS | 142-71-2 |
| PubChem | 8895 |
| Рег. номер EINECS | 205-553-3 |
| SMILES | |
| ChemSpider | 8555 и 21169880 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат меди (II) (ярь-медянка; (CH3COO)2Cu) — сложное химическое соединение, медная соль уксусной кислоты.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 3.1 Диссоциация
- 3.2 Реакции обмена
- 3.3 Реакции замещения
- 4 Применение
- 6 Фото
Физические свойства
Ацетат меди (II) представляет собой тёмно-сине-зелёные кристаллы моноклинной сингонии, растворимые в воде (7,1 г/100г воды), растворим также в спиртах, эфире.
Ацетат меди не горит, но окрашивает пламя в нежно-салатовый цвет.
Получение
Ацетат меди (II) получают взаимодействием гидроксида меди (II) c уксусной кислотой:
Карбоната меди(II) c уксусной кислотой:
Так же можно получить смешиванием сульфата меди (II) c гидрокарбонатом натрия, и затем, после промывания осадка основного карбоната меди от сульфата натрия, добавить уксусной кислоты:
Практически получается и растворением опилок металлической меди в уксусной эссенции при доступе кислорода воздуха. Процесс происходит медленно и на дне ёмкости по мере реакции вырастают крупные ровные кристаллы:
Химические свойства
Диссоциация
Как и все растворимые соли, ацетат меди в водных растворах диссоциирует.
Реакции обмена
Ацетат меди реагирует с сильными основаниями с образованием студенистого голубого осадка гидроксида меди (II) и соответствующей соли-ацетата.
Реакции замещения
Ацетат меди реагирует с металлами, стоящими левее меди в электрохимическом ряду активности металлов.
Применение
Моногидрат ацетата меди (II) (CH3COO)2Cu·H2O — фунгицид, пигмент для керамики, реагент для обнаружения углеводов и селективно — глюкозы, катализатор полимеризации (стирола и др.), стабилизатор искусственных волокон.
Кристаллы ацетата меди (II) на медной проволоке
Водный раствор ацетата меди (II)
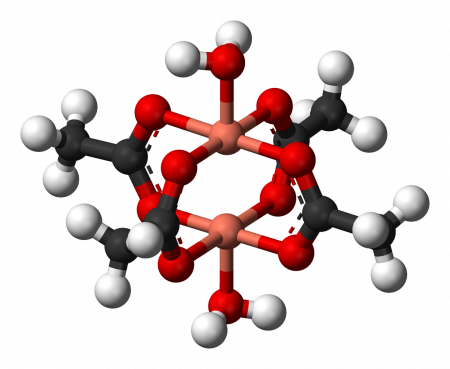
Молекулярная структура дигидрата тетраацетата димеди(II)
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e18c41d6cf097a0 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://chem.ru/acetat-medi-ii.html
http://gomolog.ru/reshebniki/10-klass/eremin-2019/15/3.html