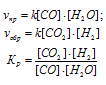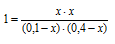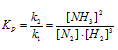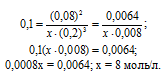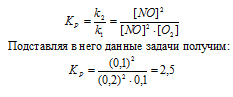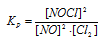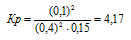Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de2f5c508e315fe • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Вычисление константы равновесия системы
Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
Kp = [CO2] . [H2]/ [CO] . [H2O]
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40.
Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P= 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Обозначаем за «х» моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л; [Н2О]исх = 0,40 — х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 0,10 — х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
Задание 138.
При некоторой температуре равновесие гомогенной системы
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л): [NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Смещение равновесия схимической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:




Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:

б) Уравнение реакции:
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:




Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
Подставляя в данное выражение равновесные концентрации веществ, получим:
Ответ: Кр = 4,17.
Тест по теме «Химическое равновесие»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
1. Химическое равновесие в системе
2 NO (г) + O 2 (г) = 2 NO 2 (г) + Q
смещается в сторону образования продукта реакции при
1) повышении давления
2) повышении температуры
3) понижении давления
4) применении катализатора
2. Состояние химического равновесия характеризуется
1) прекращением протекания прямой и обратной химической реакций
2) равенством скоростей прямой и обратной реакций
3) равенством суммарной массы продуктов суммарной массе реагентов
4) равенства суммарного количества вещества продуктов суммарному количеству вещества реагентов
3. При изменении давления химическое равновесие не смещается в реакции
4. Введение катализатора в систему, находящуюся в состоянии динамического равновесия
1) увеличит скорость только прямой реакции
2) увеличит скорость только обратной реакции
3 ) увеличит скорость как прямой, так и обратной реакции
4) не оказывает влияние на скорость ни прямой, ни обратной реакции
5. Давление не влияет на состояние химического равновесия следующей химической реакции
6. Химическое равновесие в системе
можно сместить в сторону продуктов реакции при
1) повышении давления
2) повышении температуры
3) понижении давления,
4) использовании катализатора
7. В какой системе увеличение давления и понижение температуры смещает химическое равновесие в сторону продуктов реакции?
8. Изменение давления оказывает влияние на смешение равновесия в системе:
9. При одновременном повышении температуры и понижении давления химическое равновесие сместится вправо в системе
10. На смешение химического равновесия в системе N 2 + 3Н 2 ↔2 NH 3 + Q
не оказывает влияния
1) понижение температуры
2) повышение давления
3) удаление аммиака из зоны реакции
4) применение катализатора
11. Давление не влияет на равновесие в реакции
12. В равновесной системе
С (т) + Н 2 О (г) ↔ Н 2(г) + СО (г) — Q равновесие сместится в сторону исходных веществ при:
1) повышении температуры и повышении давления
2) понижении температуры и повышении давления
3) повышении температуры и понижении давления
4) понижении температуры и понижении давления
1) повысив давление
2) повысив температуру
3) понизив концентрацию Н 2 О
4) применив катализатор
1. Обратимая химическая реакция
1) гидролиз сложного эфира
4) затвердевание цемента
2. Для увеличения выхода сложного эфира в химическом процессе
1) добавить воды
2) уменьшить концентрацию уксусной кислоты
3) увеличить концентрацию эфира
4) увеличить температуру
3. При понижении давления химическое равновесие смещается в сторону
1) эндотермической реакции
2) экзотермической реакции
3) уменьшения объема реакционной смеси
4) увеличения объема реакционной смеси
4. Химическое равновесие сместится в одну сторону при повышении давления и понижении температуры в системе:
5. При понижении давления химическое равновесие смещается в сторону исходных веществ в системе
6. Химическое равновесие в системе
сместится в сторону продуктов реакции при:
1) повышении давления
2 ) понижении давления
3 ) повышении температуры
4) использовании катализатора
7. При повышении давления равновесие смешается вправо в системе:
8. Обратимой реакции соответствует уравнение
1) КОН + НС1 ↔ KCI + Н 2 О
3) FeCl 3 + 3 NaOH ↔ Fe ( OH ) 3 + 3 NaCl
4) Na 2 О + 2 HCI ↔ 2 NaCl + H 2 О
9. Химическое равновесие в системе
можно сместить в сторону продуктов реакции
1) повышением температуры и повышением давления
2) повышением температуры и понижением давления
3) понижением температуры и повышением давления
4) понижением температуры и понижением давления
10. Химическое равновесие в системе
сместится вправо при
1) повышении давления
2) понижении температуры
3) повышении концентрации СО
4) повышении температуры
увеличить выход С 3 Н 8 можно:
1) повысив температуру
2) применив катализатор
3) понизив концентрацию водорода
4) повысив давление
12. Равновесие сместится в сторону продуктов реакции при повышении температуры и понижении давления в системе
13 . Смещению равновесия в сторону образования исходных веществ в системе
1) повышение температуры и повышение давления
2) понижение температуры и повышение давления
3) понижение температуры и понижение давления
4) повышение температуры и понижение давления
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 949 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 48 человек из 28 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 565 524 материала в базе
Другие материалы
- 16.11.2017
- 2090
- 2
- 16.11.2017
- 3749
- 49
- 16.11.2017
- 19990
- 54
- 16.11.2017
- 30762
- 304
- 16.11.2017
- 8552
- 72
- 16.11.2017
- 5377
- 15
- 16.11.2017
- 587
- 3
- 16.11.2017
- 1330
- 3
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 16.11.2017 57633
- DOCX 24.3 кбайт
- 528 скачиваний
- Рейтинг: 1 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Лаврушина Елена Евгеньевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет
- Подписчики: 0
- Всего просмотров: 220728
- Всего материалов: 32
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
У 76% российских учителей оклад ниже МРОТ
Время чтения: 2 минуты
Объявлен конкурс дизайн-проектов для школьных пространств
Время чтения: 2 минуты
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Онлайн-конференция о создании школьных служб примирения
Время чтения: 3 минуты
В России могут объявить Десятилетие науки и технологий
Время чтения: 1 минута
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
http://buzani.ru/zadachi/khimiya-shimanovich/920-konstanty-ravnovesiya-zadacha-135-140
http://infourok.ru/test-po-teme-himicheskoe-ravnovesie-2295343.html