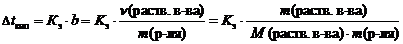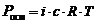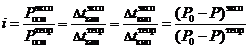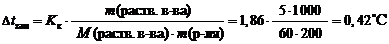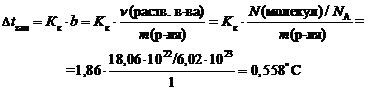Давление пара растворителя над раствором описывается уравнением
Коллигативные свойства растворов
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя.
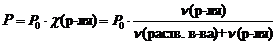
где Р – давления насыщенного пара растворителя над раствором, Па;
Р0 – давления насыщенного пара над растворителем, Па;
c (р-ля) – мольная доля растворителя;
n (раств. в-ва) – количество растворенного вещества, моль;
n (р-ля) – количество вещества растворителя, моль.
Иногда закон Рауля определяют следующим образом. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
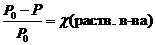
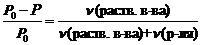
где c (раств. в-ва) – мольная доля растворенного вещества.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:
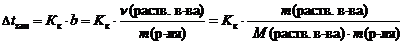
где D t кип – повышение температуры кипения раствора, ° С;
D t зам – понижение температуры замерзания раствора, ° С;
К э – эбуллиоскопическая константы растворителя, (кг ×° С)/моль;
К к – криоскопическая константы растворителя, (кг ×° С)/моль;
b – моляльная концентрация, моль/кг;
n (раств. в-ва) – количество растворенного вещества, моль;
m (р-ля) – масса растворителя, кг;
m (раств. в-ва) – масса растворенного вещества, г;
М (раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и D t можно рассчитать температуры кипения и замерзания растворов:
Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора .
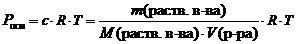
где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;
R – универсальная газовая постоянная, 8,314 Дж/(моль × К);
Т – абсолютная температура, К;
V (р-ра) – объем раствора, л.
Осмос – односторонняя диффузия вещества через полупроницаемую мембрану.
Осмотическое давление – сила, обуславливающая осмос. Оно равно внешнему давлению, при котором осмос видимо прекращается.
Указанные законы справедливы для разбавленных растворов неэлектролитов . Их можно применять и к растворам электролитов, но в этом случае необходимо вводить изотонический коэффициент Вант-Гоффа ( i ). Это поправочный коэффициент, который учитывает увеличение числа частиц в растворе электролита из-за диссоциации на ионы.
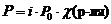
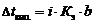
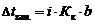
Значение изотонического коэффициента Вант-Гоффа рассчитывают как частное от деления экспериментальных и теоретических значений осмотического давления, изменения температур кипения и замерзания растворов и понижения давления растворителя над раствором:
Пример 1. Вычислите температуру кристаллизации раствора мочевины, содержащего 5 г мочевины CH 4 N 2 O в 200 г воды. Криоскопическая константа воды равна 1,86 (кг ×° С)/моль.
Пример 2. Вычислите температуру замерзания раствора, если он содержит 18,06 × 10 22 молекул неэлектролита и 1000 мл воды. Криоскопическая константа воды равна 1,86 (кг ×° С)/моль.
m ( H 2 O ) = V ( H 2 O ) × r ( H 2 O ) = 1000 мл × 1 г/мл = 1000 г = 1 кг
Пример 3. Вычислите массовую долю нафталина С10Н8 в бензольном растворе, если он кипит при температуре 81,45 ° С. Эбуллиоскопическая константа бензола равна 2,57 (кг ×° С)/моль. Температура кипения чистого бензола 80,2 ° С.
Решение . Допустим, что в растворе содержится 100 г растворителя (бензола).
М (С10Н8) = 12 × 10 + 1 × 8 = 128 г/моль
Коллигативные свойства растворов
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
где C — молярная концентрация раствора, моль/м 3 ,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Давление пара растворителя над разбавленными растворами неэлектролитов
Давление пара растворителя над растворами ниже давления его пара над чистым растворителем при той же температуре.
Согласно I закону Рауля, давление пара растворителя над раствором равно давлению пара над чистым растворителем при данной температуре, умноженному на отношение числа молей растворителя к общему числу молей:
где, P0 – давление насыщенного пара над растворителем;
P – давление насыщенного пара над раствором;
N(X) молярная доля вещества (X) которая определяется по формуле:
где, n(X) количество вещества (Х);
nрастворителя – количество вещества растворителя;
Пример № 3
Вычислите давление насыщенного пара над раствором, содержащим 6,4 г нафталина (C10H8) в 90 г бензола (C6H6). Давление насыщенного пара над бензолом 9953,82 Па.



Ответ: давление насыщенного пара над раствором равно 9535, 75 Па.
Температуры кипения и кристаллизации разбавленных растворов неэлектролитов.
Растворы кипят при температуре более высокой, чем чистые растворители. Если приготовить раствор из 1000 г растворителя и 1 моль неэлектролита, то числовое значение увеличения температуры кипения такого растворителя называют молярным повышением температуры кипения данного растворителя (или его эбуллиоскопической константой) Екип. Эбуллиоскопическая константа воды равна 0,52 град·кг/моль; это значит, что растворы, содержащие 1 моль любого неэлектролита на 1000 г воды, закипают при 100,52 °С.
Растворы замерзают при температуре более низкой, чем чистый растворитель. Если приготовить раствор из 1000 г растворителя и 1 моль неэлектроилита, то числовое значение уменьшение температуры замерзания такого растворителя называют молярным понижением температуры кристаллизации данного растворителя (или его криоскопической константой) Ккр.. Криоскопическая константа воды составляет 1,86 град·кг/моль, это значит, что растворы, содержащие 1 моль любого неэлектролита в 1000 г воды, начинают замерзать при температуре -1,86°С.
Зная эбуллиоскопическую и криоскопическую константы растворителя, можно вычислить температуры кипения и кристаллизации растворов, если известны их концентрации.
Согласно II закону Рауля:
где, ∆Т кип. – повышение температуры кипения раствора;
Е(H2O) – эбуллиоскопическая константа воды 0,52 град·кг/моль;
∆Т зам. – понижение температуры замерзания раствора;
К (H2O) –криоскопическая константа для воды 1,86 град·кг/моль;
Сm(X) – моляльная концентрация вещества (Х);
Пример № 4
Вычислить температуру кипения и замерзания водного раствора фруктозы (ω фруктозы = 5%).


∆Т кип. = 0,52 · 0,29 = 0,15°С;
tкип. = 100°С + 0,15°С = 100,15°С;
Ответ: 5% водный раствор фруктозы будет закипать при температуре 100,15°С, а замерзать -0,54°С.
Пример №5
Вычислите молярную массу неэлектролита, если его водный раствор с массовой долей 1,96% замерзает при -0,248°С.
По условию задачи концентрация неэлектролитасосталяет 1,96%, т.е в 100 г раствора содержится 98,04 г воды и 1,96 г неэлектролита.
Отсюда, 

Ответ: молярная масса неэлектролита149,9 г/моль.
Пример № 6
Какова концентрация водного раствора глицерина в массовых долях, если он замерзает при -0, 52°С.
Решение. Понижение температуры замерзания раствора
Cm = 

Переход от моляльной концентрации к массовой доле осуществляется по формуле:
Пусть ω = х, тогда х = 


x = 
Ответ: массовая доля глицерина в водном растворе 2,51%.
http://zadachi-po-khimii.ru/obshaya-himiya/kolligativnye-svojstva-rastvorov.html
http://allrefrs.ru/1-24568.html