Расщепление пероксида водорода ферментом каталазой Цель работы: показать действие фермента каталаза на пероксид водорода (Н202)
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Ферментативное расщепление пероксида водорода в тканях организма
Разделы: Биология
1. В ходе лабораторной работы ознакомить учащихся с действием фермента каталазы на пероксид водорода.
2. Закрепить умения работать с лабораторным оборудованием, проводить опыты и объяснять резузульты.
3. Закрепить знания по теме в форме проверочного теста.
1. Таблица «Белки. Уровни организации белковой молекулы»,
2. Штатив с пробирками, 3% раствор пероксида водорода,
3. Картофель сырой и варёный;
4. Мясо сырое и варёное.
I Организация класса.
В микроскопической клетке содержится несколько тысяч веществ, которые участвуют в разнообразных химических реакциях. Все имеющиеся в клетке соединения можно разбить на две группы.
— Какие органические вещества вы знаете?
На первом месте по количеству и значению стоят белки. На уроке мы изучили химический состав белков, уровни организации белковой молекулы, свойства белков, познакомились с одной из важнейших функций этих веществ. И теперь с помощью теста «Волна» проверим, как вы усвоили изученный материал. Если зачитанное утверждение верно и вы с ним согласны, то волну рисуем вверху линии, если утверждение не верно, и вы с ним не согласны, то волну рисуете внизу линии.
1).В состав белков входят аминокислоты, прочно связанные между собой водородными связями. (Нет)
2).Пептидной называется связь между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты. (Да)
3).Белки составляют основную часть органических веществ клетки (Да).
4). Белок-мономер. (Нет)
5).Денатурация-разрушение белка. (Нет)
6).Существует белок, который переносит кислород. (Да)
7).Водородные связи «прошивают» соседние витки спирали во вторичной структуре белка (Да).
8).Протеиды состоят только из аминокислот (Нет).
9). Аминокислоты не все синтезируются в организме (Да).
10).Третичная структура белка имеет вид глобулы (Да).
Среди веществ белковой природы выделяется особая группа-это ферменты или энзимы. На прошлом уроке мы говорили о них.
— Что такое ферменты?
— Какое значение они имеют в клетках?
— Что общего между белками-катализаторами и неорганическими катализаторами?
— Чем отличаются ферменты и неорганические катализаторы?
Если бы не было в клетке ферментов, то при тех условиях, которые в ней существуют, реакции протекали бы очень медленно или не происходили бы вовсе. Для убедительности послушайте пример: если поместить белок в пробирку с водой, исключить попадание в неё микроорганизмов, то результат реакции белок + вода =аминокислоты можно дождаться не менее чем через 100 лет. Расщепление белка до аминокислот можно получить при кипячении его в 20% растворе HCL .На это уходит 10-15 часов. Если добавить в пробирку с белком несколько капелек фермента, расщепляющего белок (трипсин, субтилин и др.), то полное расщепление белка на аминокислоты закончится за 50-80 минут. С помощью ферментов происходит расщепление не только белков, но и углеводородов и других соединений, а также их образование.
В каждой клетке содержится столько ферментов, сколько необходимо для протекания в ней многочисленных реакций. Так, в высокоактивных клетках печени насчитывается около 10 тысяч ферментов, в малоактивных жировых клетках — около 800.
Сегодня в мы рассмотрим ферментативное действие ферментов и в ходе лабораторной работы познакомимся с действием одного из них — каталазы на пероксид водорода. (Запись темы урока).
Пероксид водорода (перекись) — это вещество, постоянно образующееся в клетке в ходе обменных процессов и обладающее высокими окислительными свойствами. Избыточное содержание в клетке этого вещества губительно для неё. Однако накопление пероксида водорода в клетке не происходит т.к в ней имеется фермент, разлагающий пероксид водорода до воды и кислорода 2 H2O2=2H2O+O2 Одна молекула фермента за минуту расщепляет до 5 млн. молекул H2O2. (слайд №2)
Приступаем к лабораторной работе.
III Лабораторная работа(Приложение 1)
- Знакомство с оборудованием.
- Инструктаж по выполнению.
- Подведение итогов (работа по вопросам в инструкционной карточке).
IV Изучение нового материала.
— Все ли белки обладают ферментативными свойствами?
Первым доказал опытным путём белковую природу ферментов Луи Пастер.
В большинстве случаев ферменты катализируют превращение веществ размеры молекул которых по сравнению с молекулами фермента очень малы. Например: фермент каталаза имеет молекулярную массу 250000, а пероксид водорода, который она катализирует всего 34.
— Какой вывод можно сделать из этого сравнения?
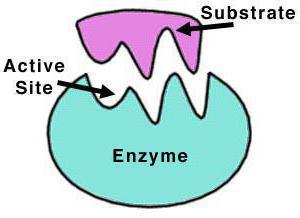
Каталитическая активность фермента определяется не всей его молекулой, а только небольшим участком — активным центром фермента. В нём происходит соединение фермента с субстратом (веществом, которое подлежит превращению). Это соединение возможно благодаря геометрическому соответствию структур активного центра фермента и молекулы вещества. Они подходят друг к другу как «ключ и замок».
Процесс действия фермента можно разделить на 3 стадии: (слайд №3)
1. Фермент распознаёт субстрат и связывается с ним.
2. Образуется активный комплекс, состоящий из фермента и субстрата.
3. Отделение продуктов, которые образовались в результате ферментативной реакции.
Активный центр может располагаться на поверхности фермента или во внутренней части молекулы. Кроме активного центра в молекуле фермента различают ещё аллостерический центр-центр, где происходит связывание низкомолекулярных соединений не сходный по строению с субстратом.
Ферменты локализуются в цитоплазме или в тех или иных органоидах клетки. В частности ферменты окисления жирных кислот располагаются в митохондриях, расщепления углеводов — в цитоплазме, синтез нуклеиновых кислот — в ядре, синтез углеводов — в хлоропластах.
1) О каких веществах говорили на уроке?
2) Вспомним основные термины, прозвучавшие на уроке (работа с терминами в презентации)
Закончим наш урок словами академика Павлова о ферментах. Ферменты — «это возбудители жизни и первый акт жизненной необходимости». (слайд №5)
V Домашнее задание. (слайд №6)
Учебник Полянского стр.154-155 (1-2 абзац)
Учебник Захарова параграф 3.2.1 стр. 95-97
1. «История открытия ферментов»
2. «Значения ферментов в промышленности и хозяйстве».
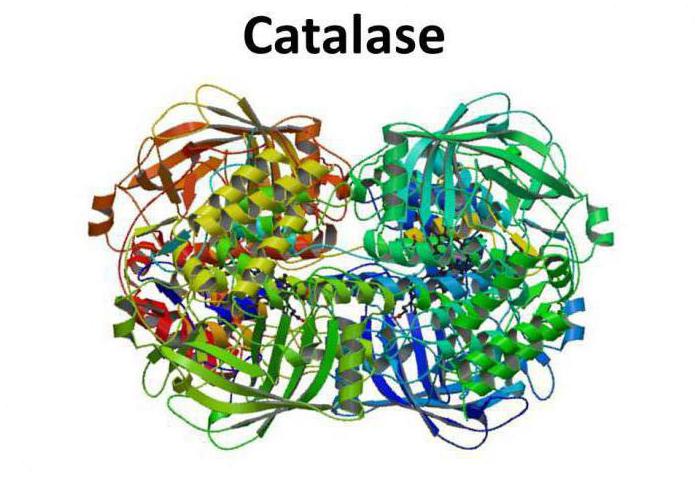
Фермент каталаза: основные особенности
Каталаза – фермент, обнаруженный почти во всех живых организмах. Основная его функция – катализировать реакцию разложения перекиси водорода до безвредных для организма веществ. Каталаза имеет большое значение для жизнедеятельности клеток, так как защищает их от разрушения активными формами кислорода.
Общие сведения
Фермент каталаза относится к оксидоредуктазам – обширному классу ферментов, которые катализируют перенос электронов от молекулы-восстановителя (донора) к молекуле-окислителю (акцептору).
Оптимальный pH для работы каталазы в человеческом организме около 7, однако, скорость реакции существенно не изменяется при значениях показателя водорода от 6,8 до 7,5. Оптимальное значение рН для других каталаз колеблется от 4 до 11, в зависимости от вида организма. Оптимальная температура также различается, для человека это около 37 о С.
Каталаза — один из самых быстрых ферментов. Всего одна его молекула способна превращать миллионы молекул перекиси водорода в воду и кислород за секунду. С точки зрения энзимологии это значит, что для фермента каталазы характерно большое число оборотов.
Структура фермента
Каталаза представляет собой тетрамер из четырех полипептидных цепей, каждая из которых имеет длину более 500 аминокислот. Фермент имеет в составе четыре группы порфирового гема, благодаря которым и вступает в реакцию с активными формами кислорода. Окисленный гем представляет собой простетическую группу каталазы.
История открытия
Каталаза не была известна ученым до 1818 года, пока Луи Жак Тенар, химик обнаруживший в живых клетках перекись водорода, не предположил, что ее разрушение связано с действием ранее неизвестного биологического вещества.
В 1900 году немецкий химик Оскар Лев первым ввел термина «каталаза» для обозначения таинственного вещества, разлагающего перекиси. Он же сумел ответить на вопрос, где содержится фермент каталаза. В результате многочисленных экспериментов Оскар Лев выявил, что данный фермент характерен почти для всех животных и растительных организмов. В живой клетке, как и многие другие ферменты, каталаза содержится в пероксисомах.
В 1937 году впервые удалось кристаллизоваться каталазу из говяжьей печени. В 1938 году была определена молекулярная масса фермента – 250 кДа. В 1981 году ученые получили изображение трехмерной структуры бычьей каталазы.
Катализ перекиси водорода
Несмотря на то, что пероксид водорода – продукт многих нормальных метаболических процессов, для организма он не является безвредным.
Реакция разложения пероксида водорода в живых тканях:
Молекулярный механизм расщепления перекиси водорода ферментом каталазой пока точно не изучен. Предполагается, что реакция проходит в два этапа — на первом этапе железо в составе простетической группы каталазы связывается с атомом кислорода перекиси, при этом выделяется одна молекула воды. На втором этапе окисленный гем взаимодействует с другой молекулой перекиси водорода, в результате чего образуется еще одна молекула воды и одна молекула кислорода.
Благодаря такому действию фермента каталазы на пероксид водорода, наличие этого активного вещества в образцах ткани легко определить. Для этого достаточно добавить к исследуемому образцу небольшое количество перекиси водорода и наблюдать за реакцией. О наличии фермента говорит формирование пузырьков кислорода. Эта реакция хороша тем, что не требует никакого специального оборудования или инструментов — ее можно наблюдать невооруженным глазом.
Стоит заметить, что ион любого тяжелого металла может выступать как неконкурентный ингибитор каталазы. Кроме того, всем известный цианид ведет себя как конкурентный ингибитор каталазы, если в тканях много перекиси водорода. Арсенаты играют роль активаторов.
Применение
Разлагающее действие фермента каталазы на пероксид водорода нашло применение в пищевой промышленности – с помощью этого фермента из молока удаляется Н2О2 до приготовления сыра. Еще одно применение – специальные пищевые упаковки, которые защищают продукты от окисления. Каталаза также применяется в текстильной промышленности для удаления пероксида водорода из тканей.
Она в небольших количествах используется в гигиене контактных линз. Некоторые дезинфицирующие средства имеют в составе перекись водорода, и каталаза используется для расщепления этого компонента перед повторным использованием линз.
Активность
Активность фермента каталазы зависит от возраста организма. В молодых тканях активность фермента значительно выше, чем в старых. С возрастом и у людей, и у животных активность каталазы постепенно снижается как результат старения органов и тканей.
Согласно недавним исследованием, снижение активности каталазы является одной из возможных причин поседения волос. Перекись водорода постоянно образуется в человеческом организме, однако не приносит вреда — каталаза быстро разлагает ее. Но если уровень этого фермента снижен, очевидно, что не вся перекись водорода катализируется ферментом. Таким образом, она обесцвечивает волосы изнутри, растворяя естественные красители. Это неожиданное открытие сейчас проверяется исследователями, и, возможно, сыграет роль в разработке препаратов, приостанавливающих поседение волос.
http://urok.1sept.ru/articles/621795
http://fb.ru/article/325833/ferment-katalaza-osnovnyie-osobennosti