Прямая и обратная задача химической кинетики
Определение на основании экспериментальных данных о зависимости концентраций от времени проведения процесса параметров кинетического уравнения – порядка реакции и значения константы скорости – составляет так называемую обратную задачу химической кинетики.
Знание кинетического уравнения реакции в дифференциальной форме позволяет определить время достижения некоторой заданной концентрации реагирующего вещества (или продукта реакции).
Пусть, например, протекает реакция
aA + bB + … → продукты,
кинетическое уравнение которой:
Тогда время достижения некоторой концентрации вещества А можно определить, интегрируя кинетическое уравнение реакции в дифференциальной форме:
Решая дифференциальное уравнение
можно получить зависимость концентрации реагирующего вещества (или продукта реакции) от времени проведения процесса – так называемых кинетических кривых.
Определение – на основании феноменологической модели процесса – концентраций реагентов от времени проведения реакции составляет прямую задачу химической кинетики.
Отметим сразу, что аналитически не всегда удаётся решить дифференциальное уравнение, особенно в случае сложной кинетики.
В этом случае прибегают к численным методам решения и использование компьютерной математики. В частности, применение математических пакетов, например, таких, как Mathcad, становится незаменимым инструментом в исследовательской практике и в процессе обучения.
Реакция первого порядка
Реакция первого порядка может быть записана в общем виде:
Примером такой реакции может служить реакция разложения диметилового эфира:
Кинетическое уравнение реакции первого порядка можно представить дифференциальным уравнением

Тогда время t достижения некоторой концентрации диметилового эфира CH3OCH3 можно определить, интегрируя соотношение (1.5):

где С и C0 – концентрация CH3OCH3 в момент времени t и t=0.
Интегрирование приводит к выражению



Из (1.7) следует, что концентрация исходного вещества со временем изменяется по экспоненциальному закону:
Проиллюстрируем изменение концентрации в зависимости от времени на примере реакции первого порядка
с начальной концентрацией 


Рис.1. Зависимость концентрации
от времени в реакции первого порядка.
и, в логарифмических координатах, согласно зависимости
 |
 |
 |
Рис.2. Зависимость логарифма концентрации
исходного вещества от времени в реакции
и скорость реакции по веществу А определяется как

то зависимость скорости реакции первого порядка можно выразить соотношением

иллюстрацией которого служит рис.3.


Рис.3.Зависимость скорости реакции первого
порядка от времени протекания процесса.
Здесь можно посмотреть Mathcad документ >>>>>>>>
Итак, если реакция протекает по первому порядку, то концентрация реагирующего вещества во времени меняется по уравнению (1.7)

Графически в координатах (lnc, t) эта зависимость линейна с тангенсом угла наклона, равным tgά= – 
Немного преобразовав (1.7)


Соотношение (1.10) позволяет определить время достижения некоторой заданной концентрации исходного вещества при протекании реакции первого порядка.
Рассчитаем период полупревращения (или полураспада) τ1/2, т.е. время, необходимое для того, чтобы прореагировала половина исходного количества вещества.
Подставляя C =(1/2)C0 в (1.9), получим

Степень превращения 



Таким образом, степень превращения определяет долю исходного вещества, прореагировавшую к моменту времени 
Тогда текущую концентрацию реагента в момент времени 

и кинетическое уравнение реакции первого порядка
можно выразить через степень превращения

Соотношение (1.13) позволяет определить время достижения некоторой заданной степени превращения исходного вещества при протекании реакции первого порядка

После интегрирования (1.13) получим:

Степень превращения в зависимости от времени проведения процесса изменяется согласно

Особенностью реакции первого порядка является независимость периода полупревращения от концентрации реагента.
Обратная величина константы скорости реакции первого порядка имеет физический смысл средней продолжительности жизни отдельной молекулы.
Попробуйте доказать это положение.
Рассмотрим применение выведенных соотношений на конкретном примере.
Здесь можно посмотреть Mathcad документ >>>>>>>
Реакция разложения глюкозы является реакцией первого порядка, и ее кинетическое уравнение в дифференциальной форме при 350К описывается соотношением:
Или через степень превращения
Кинетическое уравнение в интегральной форме
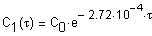
где 
Или через степень превращения
можно определить время достижения некоторой заданной степени превращения:

Теперь, согласно уравнению
определим зависимость степени превращения от времени проведения реакции:
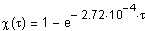
Определим зависимость времени достижения степени превращения 
 |
Ввод степени превращения – исследуется
зависимость времени достижения степени
превращения

Вывод результата счёта.

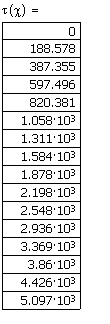
Рис.4. Зависимость времени достижения заданной степени превращения глюкозы от степени превращения в реакции ее разложения при температуре 350К.
Определим зависимость степени превращения от времени проведения реакции согласно (1.16)
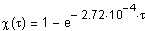
используя возможности, предоставляемые Mathcad.
Здесь можно посмотреть Mathcad документ >>>>
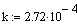 |
Ввод значения константы
 |
Ввод временного интервала,
в течении которого будем
исследовать изменение степени
превращения в зависимости от
времени проведения процесса.

Вывод результат счёта.


Рис.5. Зависимость степени превращения
глюкозы от времени проведения процесса
в реакции её разложения при 350К.
Реакции второго порядка
К таким реакциям относят реакции, скорость которых пропорциональна концентрации каждого из реагирующих веществ или квадрату концентрации одного из них.
Рассмотрим вначале достаточно простой случай реакций вида
тогда скорость такой реакции можно описать кинетическим уравнением


Пусть 


Начальная концентрация, 
Прореагировало к 

моменту
Концентрация C
в момент
и уравнение (1.17) можно записать

Или через степень превращения вещества А
И после упрощений

Если начальные концентрации веществ А и В равны, т.е., если 

Сравнив кинетические уравнения первого
и второго порядка

вы, наверное, обратили внимание, что размерность константы скорости реакции зависит от порядка реакции. Размерность константы скорости реакции второго порядка 
Найдем кинетическое уравнение реакции второго порядка в интегральной форме, т.е. зависимость концентрации реагирующих веществ от времени протекания процесса.
Если начальные концентрации реагирующих веществ реакции
A + B -à Продукты
равны, то, как мы показали
И после интегрирования получим

Соотношение (1.22) позволяет определить время достижения некоторой заданной концентрации исходного вещества при протекании реакции второго порядка – по-прежнему мы пока ограничиваемся случаем равенства начальных концентраций исходных веществ:

И тогда время полупревращения для реакции второго порядка (подставляя C =(1/2)C0 в 1.23))

и в отличие от реакции первого порядка зависит от начальной концентрации.
Подставив в (1.22)
найдём зависимость степени превращения от времени протекания процесса:

Напомним, что такой результат мы получим только в случае равенства начальных концентраций веществ А и В.
Проиллюстрируем изменение концентрации в зависимости от времени на примере реакции второго порядка
с начальной концентрацией 
Согласно (1.22) зависимость концентрации исходного вещества от времени проведения процесса определяется соотношением:
Нетрудно заметить, что в координатах «обратная концентрация- – время» зависимость линейна.

Тогда зависимость обратной концентрации от времени:
и зависимость скорости реакции от времени
Иллюстрацией полученных зависимостей служат рис. 6-8.
Рис. 6. Зависимость концентрации исходного вещества от времени проведения процесса
Рис.7. Зависимость обратной концентрации исходного вещества
от времени проведения процесса
Рис.8. Зависимость скорости реакции второго порядка от времени проведения процесса.
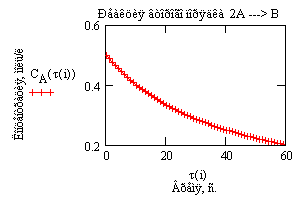
Сравним ход зависимостей концентрации исходного вещества от времени проведения процесса для реакции первого и второго порядка, разумеется, при одинаковых значениях начальных концентраций и одинаковых числовых значениях констант скоростей.
 |
 |
 |
исходного вещества от времени
для реакции первого
 |
и второго порядка
 |
 |
Рис.9 Зависимость концентрации исходного вещества от времени проведения процесса.  — реакция первого порядка A —>B — реакция первого порядка A —>B 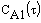 — реакция второго порядка 2A —>B Начальные концентрации исходных веществ — реакция второго порядка 2A —>B Начальные концентрации исходных веществ  =0.5моль/л. Константы скорости численно равны 0.05 =0.5моль/л. Константы скорости численно равны 0.05 |
Такой ход зависимостей концентрации от времени становится понятным после сравнения зависимостей скорости реакций от времени проведения процесса.
 |
 |
 |
исходного вещества от времени
для реакции первого
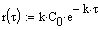 |
и второго порядка
 |
 |
Рис.10. Зависимость скорости реакции от времени проведения процесса.  — реакция первого порядка A —>B — реакция первого порядка A —>B  — реакция второго порядка 2A —>B Начальные концентрации исходных веществ — реакция второго порядка 2A —>B Начальные концентрации исходных веществ  =0.5моль/л. Константы скорости численно равны 0.05 =0.5моль/л. Константы скорости численно равны 0.05 |
Сравним теперь зависимости степени превращения от времени в реакции первого
Здесь можно посмотреть Mathcad документ >>>>>>>>>>>
Ввод константы скорости реакции и начальной концентрации:

Ввод временного интервала, в котором будет исследована зависимость
степени превращения от времени проведения процесса:
Расчётные соотношения, определяющие зависимость степени превращения в
реакции первого 


Вывод результата счёта.
Зависимость степени превращения от времени проведения процесса в реакции первого 




Рис.11. Зависимость степени превращения от времени проведения процесса в реакции первого 

Если начальные концентрации реагирующих веществ не равны, необходимо интегрировать уравнение (1.14)

Интегрирование (1.14) по частям или методом неопределённых коэффициентов приводит к выражению:


где 
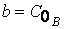
Заметим попутно, что наличие современных компьютерных математических пакетов, например, таких, как Mathcad, практически устраняет трудности, возникающие при решении подобных задач.
Проиллюстрируем это небольшим примером.
Как уже упоминалось, в случае неравенства начальных концентраций при протекании процесса
кинетическое уравнение имеет вид (1.14)
 |
и время, за которое прореагирует x молей, может быть рассчитано по соотношению
Тогда с помощью символьного процессора Mathcad этот интеграл легко вычисляется.
Для вычисления неопределенного интеграла от некоторого выражения, например, рассматриваемого
по определенной переменной (в нашем случае переменной является Х) выделяют в этом выражении переменную и выполняют команду Symbolcs/Variable/Integrate.
После выполнения команды появляется вычисленное аналитическое представление неопределенного интеграла:
Сравните это выражение с полученными ранее соотношениями (1.21) или (1.22)
Расчеты, основанные на аналитическом интегрировании соотношения
представлены в >>>>>>> Здесь можно посмотреть Mathcad документ
Рассмотрим еще один подход к решению задач по определению зависимости концентрации реагирующих веществ от времени проведения процесса.
Рассмотрим реакцию омыления эфира в щелочном растворе >>>>> Здесь можно посмотретьMathcad документ
Исследуемая реакция является типичной реакций второго порядка, а, значит, ее скорость описывается кинетическим уравнением (введя обозначения 
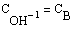
При 298К константа скорости равна
Пусть начальные концентрации равны 
Рассчитаем изменение концентраций реагирующих веществ в зависимости от времени протекания процесса.
Запишем кинетические уравнения:
Решим систему дифференциальных уравнений, т.е. найдем зависимость концентраций исходных веществ и продуктов реакции в зависимости от времени.
Определим систему через формальную запись в Mathcad.

где 

Определим начальные условия
Введем значение константы скорости исследуемой реакции
Результаты решения (с помощью имеющейся в Mathcad встроенной функции, позволяющей решать систему методом Рунге-Кутты с фиксированным шагом) представлены в матрице результатов и на рис.12.
В левом столбце матрицы находятся значения аргумента 
щие интервал на равномерные шаги, в остальных столбцах — значения 
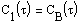


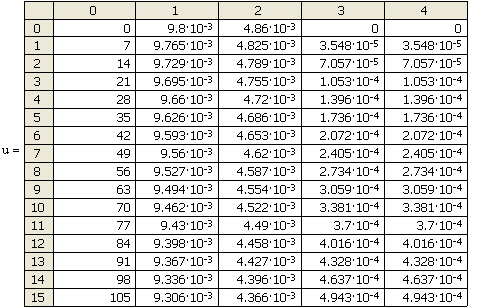 |
В левом столбце матрицы находятся значения аргумента 

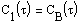


 |
Рис.12. Зависимость концентрации реагирующих веществ от времени




в реакции омыления эфира 
Начальные концентрации эфира 
Здесь можно посмотреть Mathcad документ >>>>>>>>>>>
Период полупревращения для реакции второго порядка найдем из (1.20)
Подставив C = ½ C0, получим
Откуда время полупревращения для реакции второго порядка в случае равенства начальных концентраций веществ А и В

Для реакции второго порядка время полураспада обратно пропорционально начальной концентрации исходного вещества.
Рассмотрим общий случай реакции второго порядка:
pA + qB ——> ПРОДУКТЫ,
причём
pA + qB ——> ПРОДУКТЫ,
моль/л 
момент 
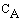
Поскольку для реакции
aA + bB + . > cC + dD + .
скорости, измеренные по компонентам реакции равны

то для рассматриваемого процесса
pA + qB ——> ПРОДУКТЫ
Тогда система кинетических уравнений в дифференциальной форме:

решение которой даёт возможность исследовать изменение концентраций реагирующих веществ в зависимости от времени протекания процесса.
Для решения воспользуемся возможностями, которые предоставляет математический пакет Mathcad.
Для формальной записи в Mathcad. введём обозначения:
концентрация вещества 
 |
 |
| Ввод начальных концентраций реагентов. |
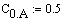 |
 |
| Ввод числа шагов, на которых численный метод находит решение. |
 |
| Ввод системы кинетических уравнений в дифференциальной форме. |
 |
| Ввод начальных концентраций. |
 |
| Ввод значения константы скорости реакции. |
 |
 |
 |
Вывод решения — здесь: 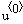 — время, — время, 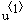 — концентрация вещества А — концентрация вещества А   — концентрация вещества B — концентрация вещества B  |
Рис.13. Зависимость концентраций исходных веществ от времени протекания процесса в реакции pA + qB ——> ПРОДУКТЫ 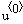
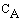

Исследуем теперь зависимость степени превращения исходных веществ от времени протекания процесса
pA + qB ——> ПРОДУКТЫ
Поскольку текущие концентрации связаны со степенью превращения

кинетические уравнения можно представить:
Для формальной записи в Mathcad системы дифференциальных уравнений введём обозначения:
степень превращения вещества A 
Решим систему дифференциальных уравнений и тем самым найдём зависимость степени превращения исходных веществ от времени протекания процесса
pA + qB ——> ПРОДУКТЫ
Ввод стехиометрических коэффициентов.


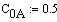
Ввод системы кинетических уравнений в дифференциальной форме



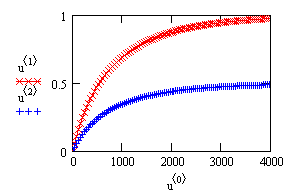
Вывод решения — здесь: 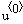 — время, — время, 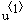 — степень превращения вещества А — степень превращения вещества А   — степень превращения вещества B — степень превращения вещества B  |
Рис. 14. Зависимость степени превращения исходных веществ от времени проведения процесса
pA + qB ——> ПРОДУКТЫ
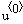
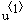


Определим теперь время достижения некоторой степени превращения 
pA + qB ——> ПРОДУКТЫ
Кинетическое уравнение реакции
Интегрируя кинетическое уравнение, найдём соотношение, определяющее связь между степенью превращения и временем её достижения:
| Ввод стехиометрических коэффициентов. |
 |
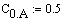 |
 |
| Ввод значения константы скорости реакции. |
| Ввод начальных концентраций реагентов. |
Ввод соотношения, определяющего интервал степени превращения  . Степень превращения изменяется от 0 до . Степень превращения изменяется от 0 до  =0.95 с шагом 0.05 =0.95 с шагом 0.05 |
 |
Ввод соотношения, определяющего связь между степенью превращения и временем её достижения.
 |
 |
| Вывод результата — время достижения некоторой степени превращения |
Вывод результата — время достижения степени превращения  Разумеется, вы можете вывести результат и при другом значении степени превращения. Разумеется, вы можете вывести результат и при другом значении степени превращения. |
 |
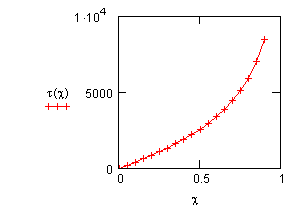
Рис. 15. Зависимость времени достижения степени превращения 
pA + qB ——> ПРОДУКТЫ
То, что соотношение между начальными концентрациями влияет на степень превращения, следует из анализа кинетического уравнения реакции. Однако степень влияния можно установить только в результате расчёта.
Исследуем влияние соотношения начальных концентраций на время достижения некоторой заданной степени превращения при протекании реакции
pA + qB ——> ПРОДУКТЫ
Соотношение, определяющее связь между степенью превращения вещества A и временем её достижения:
| Ввод стехиометрических коэффициентов. |

| Ввод начальной концентрации вещества A. |
| Ввод константы скорости реакции. |
| Ввод степени превращения |
Ввод соотношения, определяющего связь между временем достижения степени превращения c и соотношением начальных концентраций  . . |
Вывод результата: время достижения степени превращения c = 0.5 при соотношением начальных концентраций  |
Вывод результата — время достижения некоторой степени превращения c = 0.5 иc = 0.8 при изменении соотношения начальных концентраций  от n = 0.5 до n = 5. от n = 0.5 до n = 5. |
 |
 |
 |
Рис. 16. Влияние соотношения начальных концентраций 
pA + qB ——> ПРОДУКТЫ
Реакции других порядков
Реакции третьего порядка встречаются достаточно редко, поэтому мы не будем их рассматривать подробно.
Отметим только, что для реакции третьего порядка
A + B + C → продукты
кинетическое уравнение имеет вид
Некоторые реакции, осложнённые адсорбционными стадиями, имеют дробный порядок

причём 
Поскольку для реакции
aA + bB + . > cC + dD + .
скорости, измеренные по компонентам реакции равны

то для рассматриваемого процесса
pA + qB ——> ПРОДУКТЫ
Тогда система кинетических уравнений в дифференциальной форме:
Задача сводится к решению системы этих дифференциальных уравнений.
Решение системы даёт возможность исследовать изменение концентраций реагирующих веществ в зависимости от времени протекания процесса.
Конечно, можно проинтегрировать соотношение

хотя во многих случаях это и сопряжено со значительными трудностями.
(Чтобы убедиться в этом, попробуйте проинтегрировать самостоятельно и потом из полученного выражения «вытащить» зависимость концентрации от времени проведения процесса 
Однако, мы «пойдём другим путём» и для решения системы
воспользуемся возможностями, которые предоставляет математический пакет Mathcad.
Введём обозначения для формальной записи в Mathcad:
концентрация вещества 
Дифференциальные и интегральные уравнения скорости для необратимых реакций нулевого и первого и второго порядков
Дифференциальные и интегральные уравнения скорости для необратимых реакций нулевого и первого и второго порядков. Константа скорости. Кинетические кривые. Период полупревращения. Методы определения порядков реакции
Показатель степени, в которой концентрация реагента входит в кинетическое уравнение, называют порядком реакции по данному реагенту. Общий порядок q реакции есть алгебраическая сумма показателей степеней при концентрациях всех
реагентов, которые входят в кинетическое уравнение: q=n+m Для элементарной реакции порядок по данному реагенту равен числу частиц данного реагента, участвующих в элементарном химическом акте. Например для элементарной реакции :
2N О + Сl2 ® 2NО Сl
молекулярность равна 3 (количество молекул, участвующих в реакции). Порядок реакции по NО равен 2, а по Сl – 1. общий порядок реакции равен 3, всегда положителен и целочислен.
Показатель степени, в которой концентрация реагента входит в кинетическое уравнение, называют порядком реакции по данному реагенту (для элементарных реакций — это коэффициент, стоящий перед реагентом в уравнении реакции). Общий порядок реакции равен сумме порядков по каждому компоненту.
В качестве критерия скорости реакции нередко используется период полупревращения t1⁄2 , равный времени, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией.
Под кинетической кривой понимают график зависимости концентрации реагента или продуктов реакции от времени
Наиболее часто встречаются реакции нулевого, первого, второго, иногда третьего порядков.
Скорость химической реакции. Дифференциальные уравнения
В настоящее время актуальной является проблема профильного обучения в старших классах. При этом необходима дифференциация в обучении одному и тому же предмету классов различных профилей. Требуется особая подготовка в подборе материала для классов с углубленным изучением математики, учащиеся которых хотят до конца проследить причинно-следственные связи не только в математике, но и в других науках, понять логику химических явлений. Для них часто неприемлемы «театрализованные» уроки.
С одной стороны, школьный курс химии довольно слабо использует математический аппарат, и огромное количество учебного материала носит полуописательный характер. С другой стороны, изучаемая математика иногда кажется ученикам оторванной от жизни, просто тренировкой ума.
Решить эту проблему помогают интегрированные уроки.
Предлагаемый мною материал опробован в классах физико-математического профиля гимназии № 42 г. Барнаула, имеющей сложившиеся традиции в углубленном преподавании математики. Результатом таких уроков является повышение интереса учащихся и к химии, и к математике, а также изменение взглядов учеников на эти науки.
Данный урок можно проводить совместно с учителем математики, или, при достаточной математической подготовке, такой урок может провести один учитель химии.
Эпиграф (записывается на доске, проецируется на экране через кодоскоп или проектор):
– Г-голубчики, – сказал Федор Семионович озадаченно, разобравшись в почерках. – Это же п-проблема Бен Б-бецалеля. К-калиостро же доказал, что она не имеет р-решения.
– Мы сами знаем, что она не имеет решения, – сказал Хунта, немедленно ощетиниваясь. – Мы хотим знать, как ее решать. (А. и Б.Стругацкие, «Понедельник начинается в субботу».)
Цель. Показать большое практическое значение математических операций дифференцирования и интегрирования на примере изучения раздела химии «кинетика химических реакций».
Задачи. Обучающие: повторить и обобщить знания о скорости химической реакции и факторах, влияющих на нее; дать научное понятие скорости химической реакции как дифференциала концентрации от времени и изучить зависимость скорости химической реакции от концентрации («закон действующих масс»); ввести понятие «дифференциальные уравнения» и научить решать простейшие дифференциальные уравнения методом разделения переменных.
Развивающие: повысить интерес к химии и математике; развивать умение находить причинно-следственные связи; стимулировать самостоятельное изучение отдельных разделов химии и математики.
Подготовительная работа учащихся. Самостоятельно повторить материал по следующим темам: «Скорость химической реакции и факторы, влияющие на нее», «Дифференциальное и интегральное исчисления».
Оборудование. Кодоскоп или проектор для демонстраций рисунков и схем.

Учитель. На сегодняшнем уроке мы продолжим изучение химических реакций, их протекание во времени. Раздел химии, изучающий протекание реакций во времени, называется химической кинетикой. Наверное, в химии нет другого раздела, где так широко используется математический аппарат. Вы увидите практическое применение ваших теоретических знаний по дифференциальному и интегральному исчислению. Также на примерах из химической кинетики вы познакомитесь с дифференциальными уравнениями и одним из приемов их решения.

Учитель. Что такое скорость вообще и скорость химической реакции в частности? В чем различие протекания гомогенных и гетерогенных реакций? Как будет выглядеть математическое выражение скорости химической реакции для гомогенной реакции?
Ученики повторяют и обобщают имеющиеся знания по теме, в том числе формулу:
Учитель. Поскольку условия протекания химической реакции постоянно изменяются (уменьшаются концентрации исходных веществ и др.), скорость химической реакции также непрерывно изменяется (рис. 1).
 |
 |

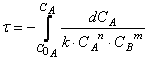
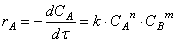
























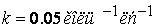








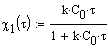










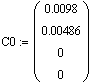































 ср. А как найти скорость химической реакции в какой-либо момент времени?
ср. А как найти скорость химической реакции в какой-либо момент времени?

 = 2–4.
= 2–4.
 Реакция:
Реакция:







