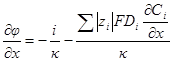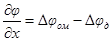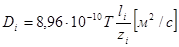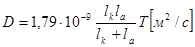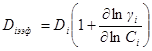Диффузия ионов и неэлектролитов
Диффузия представляет собой спонтанное движение растворенного вещества в сторону понижения концентрации. Диффузионные законы определяют движение незаряженных веществ в объеме (на любых расстояниях при отсутствии конвекции), перенос ионов в неперемешиваемых слоях у поверхности мембран, а также движение ионов на малых расстояниях.
Формула Стокса–Эйнштейна связывает коэффициент диффузии D с температурой T, вязкостью среды η и радиусом диффундирующих частиц r (k – константа Больцмана). Например, вязкость воды при 20°С составляет ηH2O= 10 –3 Па∙с (1 Па = 1 Н/м 2 ).
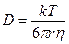
Пользуясь (4.1), можно оценить коэффициент диффузии в воде для малых молекул с радиусом
0,2 нм (10 –5 см 2 /с) или для молекул другого размера. На движение ионов в растворе влияет электрическое поле. Коэффициент диффузии иона зависит от его заряда (z):
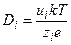
где u – подвижность иона, имеющая размерность м 2 ·с –1 ·В –1 (см 2 ·с –1 ·В –1 ), е – заряд электрона. Например, подвижности ионов K + и Na + равны 7,6·10 –4 и 5,2·10 –4 см 2 ·с –1 ·В –1 , соответственно. Из (4.1) и (4.2) получаем уравнение для расчета подвижности иона по его радиусу и заряду.
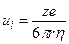
Подвижность численно равна скорости движения ионов (см/с) при напряженности поля 1 В/см.
Законы Фика описывают скорость диффузии вещества, а также пространственное распределение концентрации диффундирующего вещества в различные моменты времени.
Первый закон Фика связывает поток вещества J с коэффициентом диффузии D и градиентом концентрации (dc/dx). Размерность потока – моль∙см –2 ∙с –1 ).
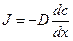
В случае диффузии через тонкую мембрану
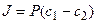
где P=Dg/h – проницаемость, h – толщина мембраны, g – коэффициент распределения вещества между водной и липидной фазами, а 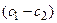
Второй закон Фика описывает направление изменений концентрации вещества во времени (dc/dt) в зависимости от знака второй производной (d 2 c/dx 2 ), определяющей вогнутость или выпуклость профиля концентрации по координате x:
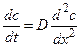
Из (4.6) в частности следует, что в случае одномерной стационарной диффузии (т.е. при dc/dt=0) профиль концентрации линеен: 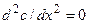
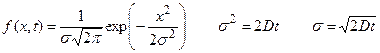
где x – координата, f(x,t) – функция распределения, σ – среднеквадратичное отклонение для нормального распределения вещества относительно исходной точки при x = 0, σ 2 – дисперсия, а t – время. Область, расположенная между координатами ±σ, содержит более 68% от общего количества диффундирующего вещества. Согласно уравнению Эйнштейна, величина σ, обозначаемая также 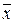
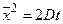
где 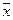
Пример 4.1. После инъекции в клетку некоторого вещества до концентрации co, клетку отмывают средой, не содержащей этого вещества. Какое время инкубации необходимо, чтобы внутренняя концентрация вещества понизилась в 10 раз, если проницаемость мембраны для этого вещества составляет 10 –4 см/с? Решить задачу для клетки сферической формы с диаметром 200 мкм и для цилиндрической клетки с диаметром 200 мкм и длиной 1 см.
Решение: При записи первого закона Фика учтем, что диффузия происходит через тонкую мембрану и, что концентрация во внешнем растворе равна нулю.
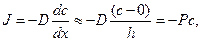
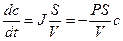
Решение этого дифференциального уравнения описывает кинетику изменения концентрации вещества внутри клетки:
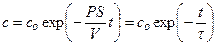
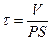
Уравнение решают методом разделения переменных и интегрирования по времени от нуля до t при соответствующем изменении концентрации от co до c.
Для ответа на вопрос задачи удобно перейти к десятичным логарифмам:
Отношение S/V определяется геометрией клетки. Для сферы и цилиндра оно составляет соответственно
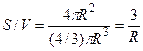
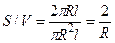
С учетом условия задачи c/co = 0,1 и R = 0,01 см, находим искомое время t:
Аналогичный подход используется для случаев, когда в момент времени t = 0 в наружный раствор добавляют проникающее вещество, которое начинает поступать внутрь клетки, причем наружная концентрация остается постоянной (co = const) из-за большого объема среды по сравнению с объемом клеток. В таком опыте моменту времени t = 0 соответствует внутренняя концентрация с = 0, а произвольному моменту времени t соответствует внутренняя концентрация с. В этом случае интегрирование дифференциального уравнения приводит к следующему решению:
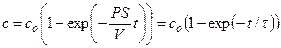
Пример 4.2. Предположим, что через калиевый канал с устьем R = 10 Å протекает ток I силой 10 пА (рис. 4.1.). При этом концентрация К + в устье повышается по сравнению с объемом раствора. Найти концентрацию в области устья канала, если концентрация К + в объеме составляет 10 мМ. При расчете принять, что коэффициент диффузии К + в воде
Решение: На выходе из канала суммарный поток переносимых ионов диффундирует во всех направлениях, ограничиваемых полусферой. Выделим элемент поверхности полусферы и запишем поток через единицу поверхности, пользуясь первым законом Фика.
Суммарный поток вещества J связан с электрическим током I соотношением 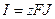
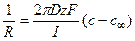
Следовательно, перепад концентрацией между устьем канала и объемом раствора составит
Соответственно, концентрация в устье канала cx составит 26 мМ.
Пример 4.3. Концентрация Са 2+ в питательном растворе на расстоянии 300 мкм от поверхности корня составляет 100 мкМ, а у поверхности корня с диаметром 200 мкм – 80 мкМ. Оценить диффузионный поток Са 2+ к поверхности корня на 1 см его длины (моль·с –1 ), а также поток Са 2+ на единицу поверхности корня (моль·см –2 ·с –1 ) в предположении, что коэффициент диффузии D = 5·10 –6 см 2 /с.
Решение: Обозначим суммарный диффузионный поток для сегмента корня длиной l символом J0. Поток Са 2+ направлен радиально из объема среды к центру корня. Поток через единичный участок цилиндрической поверхности неперемешиваемого слоя на расстоянии R от центра корня составит J0/(2πRl). Запишем уравнение первого закона Фика в радиальных координатах:
Решая уравнение, находим формулу для расчета потока по концентрациям на разном удалении от центра корня (концентрации с1 и с2 для радиальных расстояний R1 и R2).
В расчете на единицу поверхности корня поток составит
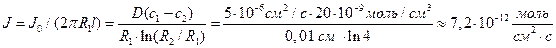
Биофизика. Тест 2 по теме 11 Физич процессы в мембранах без ответов. Физические процессы в биологических мембранах
| Название | Физические процессы в биологических мембранах |
| Анкор | Биофизика |
| Дата | 14.05.2020 |
| Размер | 58.4 Kb. |
| Формат файла |  |
| Имя файла | Тест 2 по теме 11 Физич процессы в мембранах без ответов.docx |
| Тип | Документы #122801 |
| Подборка по базе: 4 прак. раб. Гигиена .ХИМИЧЕСКИЙ СОСТАВ И ФИЗИЧЕСКИЕ СВОЙСТВА ВО, Переходные процессы вариант 14 -1.docx, Термические процессы переработки нефти и газа.pdf, Лекция ГОСТ Р ИСО_МЭК 12207. Основные процессы и взаимосвязь меж, Лекция ГОСТ Р ИСО_МЭК 12207. Основные процессы и взаимосвязь меж, ОСТ 36-28-78 Система стандартов безопасности труда. Процессы про, Базовые информационные процессы.docx, Опасные природные процессы Солодовникова.docx, Общие проблемы малой группы. Динамические процессы в малой групп, Романов. Д.В. Базовые информационные процессы и технологии_ИК.do ФИЗИЧЕСКИЕ ПРОЦЕССЫ В БИОЛОГИЧЕСКИХ МЕМБРАНАХ 1. Основу структуры биологических мембран составляют: г) аминокислоты; д) двойная спираль ДНК. 2. Диффузию незаряженных частиц через мембраны описывает уравнение: a) J = -D(dc/dx); б) Q = Δр/Х; в) F = η(dv/dx)S; 3. Для возникновения трансмембранной разности потенциалов необходимо и достаточно: а) наличие избирательной проницаемости мембраны; б) различие концентраций ионов по обе стороны от мембраны; в) наличие избирательной проницаемости и различие концентраций ионов по обе стороны от мембраны; г) появление автоволновых процессов; д) повышенная проницаемость для ионов. 4. Активный транспорт ионов осуществляется за счёт… а) энергии гидролиза макроэргических связей АТФ; б) процессов диффузии ионов через мембраны; в) переноса ионов через мембрану с участием молекул — переносчиков; г) латеральной диффузии молекул в мембране; д) электродиффузии ионов. 5. Латеральной диффузией молекул в мембранах называется . а) вращательное движение молекул; б) перескок молекул поперек мембраны — из одного монослоя в другой; в) перемещение молекул вдоль плоскости мембраны; г) активный транспорт молекул через мембрану; д) пассивный транспорт молекул через мембрану. 6. Вязкость липидного слоя мембран близка к вязкости: а) воды; б) этанола; в) ацетона; г) растительного масла. 7. Плотность потока вещества J имеет размерность: а) моль/(м 3 ·с); б) моль/(м 2 ∙с); в) моль/(м∙с); г) моль/с; д) моль/м. 8. Коэффициент проницаемости Р вещества через мембрану имеет размерность: а) м/с; б) с/м 2 ; в) моль/(м 2 ∙с); г) дм 3 /(моль∙см); д) кДж/м 2 . 9. Уравнение Нернста-Планка показывает, что . а) потенциал покоя возникает в результате активного транспорта; б) перенос ионов определяется неравномерностью их распределения (градиентом концентрации) и воздействием электрического поля (градиентом электрического потенциала); в) главная роль в возникновении потенциала покоя принадлежит ионам калия; г) мембраны обладают избирательной проницаемостью; д) коэффициент проницаемости веществ через мембрану определяется их подвижностью. 10. Коэффициентом распределения вещества называют… а) соотношение концентраций катионов внутри клетки и снаружи; б) равновесное соотношение концентраций исследуемого вещества в мембране и окружающей водной среде; в) соотношение концентраций исследуемого вещества в окружающей клетку водной среде и в цитоплазме; г) параметр, характеризующий скорость проникновения вещества через мембрану; д) соотношение концентраций катионов и анионов внутри биологических мембран. а) напряженность электрического поля в биологических мембранах; б) способность мембран к активному транспорту; в) вероятность возникновения каналов проницаемости в мембране; г) способность исследуемого вещества растворяться в биологических мембранах; д) соотношение скоростей переноса катионов и анионов через мембраны. 12. Укажите, при каких условиях пассивный перенос катионов через мембрану может происходить из раствора, где его концентрация ниже, в более концентрированный раствор: ? б) если вязкость мембраны низкая; в) при наличии в мембране интегральных белков; г) если мембрана обладает избирательной проницаемостью для катионов. 13. Пассивный перенос ионов описывается уравнением Нернста-Планка. Как модифицируется это уравнение, если ион превратится в незаряженную частицу? а) Уравнение Норнста-Планка превратится в уравнение Гольдмана-Ходжкина-Катца; б) Уравнение утратит смысл; в) Уравнение не изменится; г) Уравнение Нернста-Планка превратится в уравнение Фика. 14. При условии, что мембрана проницаема только для ионов калия, уравнение Гольдмана-Ходжкина-Катца трансформируется в уравнение… а) Нернста-Планка для ионов калия; б) Нернста для ионов калия; в) Фика для диффузии ионов калия. 15. Укажите, при каких условиях при решении дифференциального уравнения б) Если мембрана проницаема только для одного вида ионов и для этих ионов J=0; в) Если мембрана одинаково проницаема для катионов и анионов; г) Если градиент концентрации и градиент потенциала равны нулю. 1. 1) Структурной основой биологической мембраны являются белки. 2) Обязательным структурным компонентом биологических мембран являются соединения, состоящие из полярной «головки» и неполярного «хвоста», например, фосфолипиды. 3) Латеральная диффузия липидов и белков в биомембранах осуществляется значительно быстрое, чем диффузия поперёк мембраны — из слоя в слой. 4) Латеральная диффузия липидов и белков в биомембранах осуществляется значительно медленнее, чем диффузия поперек мембраны — из слоя в слой. 2. 1) Вязкость липидного бислоя биомембран близка к вязкости воды. 2) Вязкость липидного бислоя биомембран значительно выше вязкости воды и близка к вязкости растительного масла. 3) Вещество диффундирует через мембрану тем легче, чем выше его коэффициент распределения. 3. 1) Вещество диффундирует через мембрану тем легче, чем меньше его коэффициент распределения. 2) Облегчённая диффузия — это перенос ионов специальными молекулами — переносчиками. 3) Облегчённой называют диффузию веществ, имеющих высокие значения коэффициента распределения. 4. 1) Диффузия заряженных частиц через мембрану подчиняется уравнению Фика. 2) Диффузия заряженных частиц через мембрану подчиняется уравнению Нернста-Планка. 3) Диффузия незаряженных частиц через мембрану подчиняется уравнению Нернста-Планка. 5. 1) Коэффициент проницаемости мембраны для ионов калия выше, чем для ионов натрия или хлора, когда на мембране клетки генерируется потенциал покоя. 2) При возникновении потенциала действия коэффициент проницаемости мембраны для ионов натрия имеет самое высокое значение. 3) При возникновении потенциала действия коэффициент проницаемости мембраны для ионов хлора имеет самое высокое значение. 6. 1) Уравнение Гольдмана-Ходжкина-Каца описывает возникновение только потенциала покоя, но не потенциала действия. 2) Уравнение Гольдмана-Ходжкина-Каца описывает возникновение только потенциала действия, но не потенциала покоя. 3) Уравнение Гольдмана-Ходжкина-Каца описывает возникновение трансмембранной разности потенциалов на мембранах как в случае генерации потенциалов покоя, так и потенциалов действия. 1. 1) Плотность потока вещества a) P=Dk/I ; 2) Коэффициент проницаемости , б) dc/dx ; 3) Градиент концентрации в) J= — D. 1) напряженностью поля и градиентом потенциала 2) потоком и плотностью потока вещества 3) плотностью потока и градиентом концентрации 2) Облегченная диффузия происходит б) через липидный слой; 3) Диффузия через канал происходит в) в комплексе с переносчиком. 2) Активный транспорт происходит б) без затраты энергии; 3) Облегченная диффузия ионов происходит в) при участии калий-натриевого насоса. 2) Диффузия ионов подчиняется б) уравнению Гольдмана-Ходжкина-Катца; 3) Диффузия незаряженных частиц подчиняется в) уравнению Нернста-Планка. 1) коэффициент проницаемости а) моль/(м 2 с); 2) плотность потока вещества б) В/м; 3) градиент потенциала в) м/с; 4) коэффициент диффузии г) безразмерная величина; 5) коэффициент распределения д) м 2 /с. 1. Коэффициент проницаемости мембран определяется выражением P=Dk/l, где D- коэффициент диффузии paccматриваемых частиц в… А. 1) омывающем мембрану растворе; 2) веществе самой мембраны; Б. k -… 1) коэффициент, характеризующий избирательную проницаемость мембраны; 2) Коэффициент распределения, характеризующий соотношение равновесных концентраций диффундирующего вещества в мембране и в окружающем растворе; 3) постоянная Больцмана; В. l -. 1) толщина мембраны; 2) размер диффундирующей через мембрану молекулы; 3) размер канала в мембране, по которому осуществляется диффузия. А. 1) Фика; 2) Нернста-Планка; 3) Эйнштейна; 4) Ньютона; Б. Диффузия вещества через мембрану осуществляется тем легче, чем . . . У) больше значение коэффициента проницаемости; 2) больше толщина мембраны; 3) меньше значение коэффициента распределения; Д. и тем трудное, чем . . . Трменьшс значение коэффициента распределения; 2) больше толщина мембраны; 3) больше значение коэффициента проницаемости. ГУ. . . транспорт вещества через мембрану т? Пассивный; 2) Активный; 1) в результате латеральной диффузии; 2) благодаря её емкостным свойствам; 3) без затраты энергии. 3. А. Для возникновения трансмембранной разности потенциалов необходимо и достаточно выполнения следующих двух условий. 1) мембрана должна содержать интегральные белки; 2) мембрана должна содержать поверхностные белки; |>)должна существовать избирательная проницаемость ионов через мембрану; ?) концентрации ионов по обе стороны от мембраны должны различаться; Б. При возникновении стационарного трансмембранного потенциала . . . Шшотность потока каждого иона равна нулю; ^^Х^уммарная плотность потока ионов равна нулю, но плотности потоков отдельных ионов не равны нулю; 3) плотность потока анионов равна нулю. В. Возникновение потенциала покоя обусловлено, главным образом, высокой избира-юпьной проницаемостью мембран для ионов . . . J/калия; 2) натрия; 3) хлора. Г. Возникновение потенциала действия обусловлено, главным образом, высокой избирательной проницаемостью для ионов . . . 1) калия; /йГЬатрия; 3) хлора. 4. А. Если мембрана ^дбладает . . . проницаемостью 1) одинаковой; \ 2) избирательной; 3)низкой; 1)воды; 2))эдного вида ионов; 3) незаряженных молекул; В. и их концонтра*1Д1Я по обе стороны мембраны 1) высокая; 2)7/разная; 3) одинаковая; Г. то на мембране 4 /. . . -1J,будет происходить латеральная диффузия белков; (^’возникнет разность электрических потенциалов; 3) прекратится латеральная диффузия фосфолипидов. 5 А. . . . транспорт ионов через мембраны >г$У\ктивный; ^рЧассивный; Тэ. осуществляется за счет . . . 1) латеральной диффузии белков; 2) градиента их концентрации и градиента потенциала электрического поля; 3) явления «флип-флопа»|Г»у>химичоской энергии. В. Такие процессы описываются уравнением . . . 6. А. Трансмембранная разность . 1) осмотического давления; 2ЬЬлектрических потенциалов; 3) концентраций ионов; Нернста-Планка; 2) Фика; 3) Гольдмана-Ходжкина-Катца; и возникает в результате . . . переноса ионов. I) пассивною; 2) латерального; 3) активного. Г. Для её возникновения необходимо, чтобы мембрана обладала . . . проницаемостью для разных ионов неодинаковой; 2) одинаковой; 3) высокой; 4) низкой; Д. и чтобы концентрации ионов . по разные стороны мембраны. 1) не различались; 2) равнялись нулю; 3) различались. Задание 5. Решите задачу и укажите правильный ответ: 1. Пусть трансмембранная разность потенциалов составляет 58 мВ при 20°С. Чему она станет равна, если температуру увеличить до 35°С? 1) не изменится; 2) 61 мВ; 3) 116 мВ; 4) 29 мВ. 2. Пусть отношение концентраций ионов калия по разные стороны от мембраны равно 10 и мембрана избирательно проницаема для калия. Возникающая при этом трансмембранная разность потенциалов равна 60 мВ. Чему будет равна разность потенциалов, если заменить ионы калия ионами кальция в тех же концентрациях и сделать мембрану избирательно проницаемой для кальция? 1)120мВ; 2)60мВ; 3) 30 мВ; 4)0. 3. Потенциал покоя нерва конечности краба равен 89 мВ. Чему равна концентрация ионов калия внутри нерва, если снаружи она составляет 12 мМ? Принять температуру равной 20°С. ДИФФУЗИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВПроцессы диффузии, как и электрическая проводимость, связаны с движением ионов. Однако в первом случае ионы разного знака двигаются в одном направлении под действием градиента концентрации (активности), а во втором — в противоположные под действием градиента электрического потенциала. И в том, и в другом процессах электронейтральность раствора не нарушается. Если диффундирующие частицы не несут электрического заряда, то скорость диффузии wiдопределяется градиентом химического потенциала, если же частицы заряжены — градиентом электрохимического потенциала где w’iд — скорость перемещения компонента (или данного сорта попов) вдоль оси х при градиенте, равном единице. Знак минус в выражении означает, что диффузия протекает в направлении, противоположном увеличению градиента электрохимического потенциала. Продифференцируем выражение для электрохимического потенциала (см. 2.6) по х и подставим полученное выражение для где ∂φ / ∂x — градиент электрического потенциала. Умножая правую и левую части уравнения на концентрацию компонента Сi, получим где Ji — поток компонента, кмоль/(м 2 ∙с). Допустив, что активность компонента равна его концентрации, получим; Сравнивая это выражение с уравнением первого закона диффузии Фика Абсолютная скорость движения w 0 iиона связана с его коэффициентом диффузии соотношением: Подставим выражение для w’iд в выражение для Di: Умножим числитель и знаменатель правой части уравнения на число Фарадея где li = w 0 iF – подвижность иона или ионная электрическая проводимость (см. 5.1.2). Таким образом, уравнение для потока компонента может быть записано в виде: Общее уравнение для потока диффузии, выраженное через концентрацию компонента, имеет вид: Подставляя в него выражение для Если раствор содержит только один 1—1-валентный электролит, то |zk| = |za| и Ск = Са = С. Следовательно, уравнения для скорости движения ионов получим в виде: На ранней стадии процесса диффузии скорость движения одного из ионов обычно выше, чем другого. Это вызывает появление градиента потенциала ∂φ/∂x, который будет стремиться выравнять скорости движения ионов. Градиент потенциала сначала растет, а затем, когда скорости движения уравняются, становится постоянным. Следовательно, в стационарном состоянии диффузии wk = wa и из уравнений скоростей движения ионов получаем: Подставляя последнее уравнение в выражение для скорости переноса катиона (wк.д) или аниона (wа.д), получим: Выражение для потока примет вид: При сравнении этого выражения с уравнением для потока из закона Фика видно, что диффузию электролита в отсутствие других ионов можно характеризовать эффективным коэффициентом диффузии: Подставив в эту формулу вместо Dк и Da их выражения через w 0 k и w 0 a, получим: Это уравнение применимо лишь к разбавленным растворам электролитов. Необходимо отметить, что при диффузии механизм движения ионов иной, чем при протекании тока. При диффузии катионы и анионы двигаются в одном направлении, причем более быстрые частицы тормозятся более медленными, а более медленные ускоряются более быстрыми ионами. Поэтому в отличие от движения в электрическом поле при диффузии отсутствует релаксационный эффект, а катафоретический эффект имеет другое значение. При движении ионов в электрическом поле катионы и анионы двигаются в противоположных направлениях и поэтому всегда тормозят друг друга. и выражая поток вещества Ji в токовых единицах для общей плотности тока, протекающего через раствор, получим: Из последнего уравнения следует: Тая как Из уравнения видно, что падение потенциала в электролите при прохождении электрического тока связано с омическим падением потенциала Δφом = i/κ, которое зависит от тока, протекающего через раствор, и диффузионным потенциалом Δφд, определяемым различием в скоростях движения диффундирующих частиц. По-скольку диффузионный потенциал не зависит от тока, то он сохраняется и после выключения тока до тех пор, пока не прекратится процесс диффузии. Таким образом, диффузионный потенциал, возникающий при прохождении электрического тока, зависит от общей электрической проводимости электролита и при ее увеличении уменьшается. Поэтому в растворах, содержащих фоновый электролит, значение диффузионного потенциала невелико и диффузия ионов подчиняется простому уравнению Фика. Аналогичное явление происходит и при самодиффузии, т. е. в условиях, когда частицы вещества диффундируют в растворе этого же вещества. Процессы самодиффузии можно исследовать, если в раствор какого-либо вещества ввести его изотоп. Если коэффициенты диффузии изотопа и простого иона равны, то при самодиффузии диффузионный потенциал не возникает и процесс подчиняется закону Фика. Коэффициенты диффузии ионов в разбавленных растворах могут быть вычислены из уравнений, а также определены экспериментально, например из полярографических измерений. В табл. 5.4 приведены значения коэффициентов диффузии некоторых ионов, измеренные в различных фоновых электролитах. Подставляя в уравнение для Di численные значения постоянных, получим: Коэффициенты диффузии, рассчитанные из уравнения и полу- ченные из полярографических измерений, обычно удовлетворительно совпадают. Коэффициент диффузии 1 — 1 -валентного электролита можно рассчитать по уравнению, непосредственно получающемуся из приведенной выше формулы, если в нее подставить значения постоянных: В табл. 5.5 приведены значения коэффициентов диффузии, рассчитанные из электрических проводимостей при бесконечном разведении (Dрассч) и экспериментально измеренные при различных концентрациях электролита (Dэксп). Как видно из таблицы, коэффициенты диффузии несколько уменьшаются с увеличением концентрация электролита и, что Таблица 5.4. Коэффициенты диффузии (D∙10 9 , м 2 /с) некоторых ионов в разл
вполне естественно, ниже рассчитанных при бесконечном разведении. В растворах, содержащих общий анион, например для хлоридов и нитратов щелочных металлов, коэффициент диффузии возрастает при переходе Li →Cs, что связано с уменьшением сольватации катионов и увеличением их подвижности. Зависимость коэффициентов диффузии от вязкости ηраствора подобна зависимости электрической проводимости от вязкости, Таблица 5.5. Коэффициенты диффузии (D∙10 9 , м 2 /с) 1 — 1-валентных электролитов в водных растворах при 25 °С (Робинсон и Стокс)
если не происходит изменения эффективного радиуса ионов или их ассоциации. В таких растворах должно выполняться правило: Однако измерения подвижности ионов в электролите, искусственно загущенном глицерином или сахарозой, показали, что экспериментально выполняется соотношение где р — коэффициент, меньший единицы. Следовательно, предыдущее уравнение следует записать в виде: ичных фоновых электролитах
Для больших катионов, например иона тетраамиламмония, р ≈1. Таким образом, зависимость коэффициента диффузии от концентрации электролита может быть обусловлена изменением вязкости раствора и межионных взаимодействий. В разбавленных растворах изменение вязкости незначительно, поэтому основным эффектом в снижении коэффициента диффузии является увеличение межионных взаимодействий. Зависимость коэффициента диффузии от концентрации раствора можно получить, используя уравнение первого закона Фика для реальных растворов. Этот вопрос уже рассмотрен в разд. 2.6. Эффективный коэффициент диффузии изменяется с концентрацией гораздо меньше, чем Di, что указывает на существенное влияние сил межионного взаимодействия. Однако при высоких концентрациях электролита (более 0,1 кмоль/м 3 ) обычно приходится использовать либо экспериментально определенные коэффициенты диффузии, либо рассчитанные по эмпирическим уравнениям. Значение коэффициента диффузии изменяется с температурой по формуле Аррениуса. источники: http://topuch.ru/fizicheskie-processi-v-biologicheskih-membranah/index.html http://lektsii.org/8-40271.html |
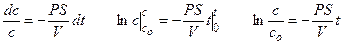
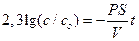
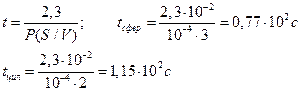
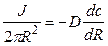
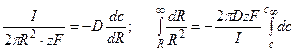
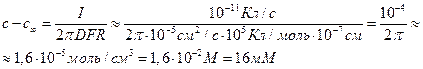
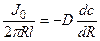
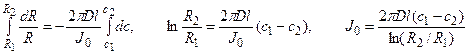
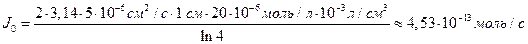
 (уравнения Нернста-Планка) получается уравнение
(уравнения Нернста-Планка) получается уравнение (уравнение Нернста)?
(уравнение Нернста)?





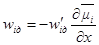
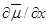 в уравнение скорости диффузии:
в уравнение скорости диффузии: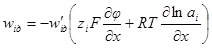
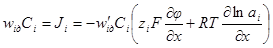
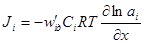
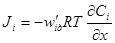
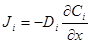
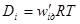
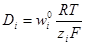 .
.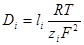
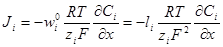
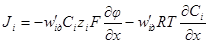
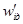 через коэффициент диффузии и абсолютную скорость движения, получим:
через коэффициент диффузии и абсолютную скорость движения, получим: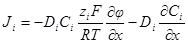
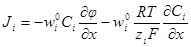

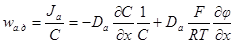
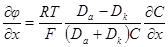
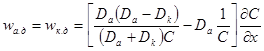
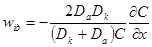
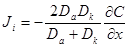
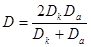
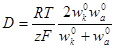
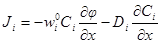
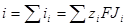
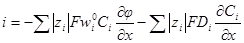
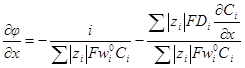
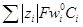 = κ(см. 5.1. 2), то окончательно имеем:
= κ(см. 5.1. 2), то окончательно имеем: