Законы Фика | Основы диффузии
Итак, в основе любой теории диффузии (красителей в волокнистых материалах, компонентов в пластических массах, обмена ионов в ионообменных материалах, а также частиц в кристаллических веществах, включающих металлы, полупроводники, оксиды, керамику, стекла и т.д.), лежат законы Фика. Существуют два закона Фика – первый и второй.
Первый закон Фика
Первый закон Фика описывает квазистационарные процессы, когда проницаемая для обменивающихся местами частиц мембрана (пластинка) разделяет две среды (которые могут быть жидкими или газообразными) с существенно постоянными условиями на границах раздела. Эта мембрана может быть инертной по отношению в диффундирующим веществам (например, пористое стекло, разделяющее водные солевые растворы различной концентрации или солевого состава) или активной по отношению к одному или нескольким диффундирующим компонентам (например, палладиевая мембрана, пропускающая через себя водород при высокой температуре из-за специфических процессов сорбции на ее границе и практически не пропускающая другие газы).
Уравнение, описывающее первый закон Фика, имеет следующий вид:
где j – поток вещества через единицу поверхности, D – коэффициент диффузии (в общем случае – коэффициент взаимодиффузии), C — концентрации по толщине мембраны, равная разнице концентраций переносимого вещества по обе стороны мембраны, x — толщина мембраны.
Очевидно, что к обсуждаемым нами процессам образования цинкового покрытия это уравнение неприменимо, поскольку изучаемые нами процессы являются нестационарными.
Второй закон Фика описывает нестационарные процессы, и именно его необходимо применять для описания закономерностей, с которыми имеют дело как металлурги, так и работники других специальностей, соприкасающиеся с проблемами массопереноса в твердых телах.
Рассмотрим его действие на следующем примере. Возьмем два одинаковых образца, имеющих плоскую поверхность и состоящих из металла, который под воздействием нейтронного облучения способен создавать радиоактивные атомы той же природы. Облучим нейтронным потоком один из двух образцов с тем, чтобы создать в нем радиоактивность, соединим плотно по поверхностям облученный и необлученный образцы между собой и для убыстрения процесса будем выдерживать эту композицию при повышенной температуре. Вследствие теплового движения радиоактивные атомы из одной части образца будут диффундировать во вторую его часть, причем этот процесс будет продвинут тем более, чем более высока температура и чем больше время опыта. Затем образцы разъединим, и в каждом образце послойно измерим радиоактивность (технология этого типа эксперимента разработана очень хорошо). В результате эксперимента получаются кривые, изображенные на рис. 7.38, которые соответствующим образом обрабатываются для расчета эффективных коэффициентов диффузии. Концентрация радиоактивных ионов на межфазной границе будет равна половине той, что была в исходном левом образце, а сам процесс диффузии будет описываться уравнением:
Метод обработки таких кривых, как следует из литературы, был предложен физиком по фамилии Матано, и, как правило, называется методом Матано и иногда методом Матано- Больцмана (вероятно, из-за того, что метод возник как результат анализа решений уравнений диффузии, полученных одним из великих физиков теперь уже позапрошлого века Больцманом).
Если поверхность образца контактирует с какой-либо средой в жидкой форме, то на границе раздела концентрация данной среды, как правило, остается постоянной, но на форме фронта в железном образце эта особенность эксперимента при условии постоянства эффективного коэффициента диффузии сказывается достаточно мало (рис.7.39).
Для процесса цинкования необходимо смоделировать именно такую картинку. В этом случае концентрация диффундирующего вещества на границе двух сред является практически постоянной, и диффузия вещества в другую среду будет идти до тех пор, пока не достигнет стационара.
Рис. 7.38. Форма фронта диффузии при контакте двух твердых образцов, в одном из которых (в данном случае слева) методом нейтронного облучения созданы радиоактивные атомы, для двух значений времени эксперимента.
Рис. 7.39. Ожидаемая форма фронта в поглощающей среде при диффузии из среды с постоянной концентрацией на границе.
Второй закон Фика
Уравнение нестационарной диффузии описывается, как было уже сказано, вторым законом Фика, который для диффузии с постоянной концентрацией на границе двух фаз имеет следующий вид:
где n = 2, 1 или 0 – для шара, бесконечного цилиндра и бесконечной пластины.
Для бесконечной пластины уравнение имеет вид:
Ниже приведены соответствующие решения для степени завершения обмена как функции времени при постоянных коэффициентах диффузии:
для шара:
для пластины:
и для бесконечного цилиндра:
μ — корни функции Бесселя нулевого порядка, Bt = π 2 F0
N — степень завершения процесса обмена
F0 = D*t / l 2 — безразмерный параметр, где (D — коэффициент диффузии, t — время, l — линейный параметр)
Эти уравнения показывают, какая доля атомов (от максимально возможной) накапливается в поглощающей части образца.
Анализ показывает, что получаемые кривые, изображенные на рис. 7.39, никоим образом не напоминают типичный фронт сорбции цинка поверхностью железа, картинку которого можно видеть на рис. 7.40. Если верить кривой, полученной на рис. 7.39, наибольшей толщиной должны обладать ζ— и Г1-фазы, а δ-фаза должна иметь промежуточную толщину (о η-фазе мы поговорим несколько позже). Аналогичные результаты (то есть не совпадающие с фронтом, изображенным на рис. 7.39) были получены в значительном количестве исследований, и вот отсюда начинается игра ума.
Одни начинают искать причину в том, что поскольку изучаемое тело имеет кристаллическую структуру, то коэффициенты диффузии в различных направлениях являются различными. Действительно, на монокристаллах в ряде случаев это доказано. Но вот беда: сталь – это поликристаллическое тело, и для процесса цинкования этим вряд ли можно объяснить упомянутые выше экспериментальные закономерности.
Другие ищут причину отклонения от теоретической зависимости в методе Матано в том, что необходимо в уравнении второго закона Фика использовать не градиент концентрации, а градиент химического потенциала. В этом случае уравнение значительно усложняется, и неизвестно, какие результаты – отражающие или не отражающие действительность – будут получены.
Наконец, третьи пошли логически более правильным путем. На самом деле, при диффузии в металле с примесью (сплаве) диффундирует не один вид частиц, а, как минимум, два. Эти два вида частиц диффундируют навстречу друг другу, к тому же обладают различной подвижностью. Если отсчитывать скорость их передвижения от некоторой воображаемой плоскости (рис 7.41), то будет обнаружено, что через некоторое время эксперимента эта плоскость передвинется в сторону той части образца, которая содержит более быстрые частицы (эффект Киркендаля).
Рис. 7.40. Форма фронта, рассчитанная из содержания цинка в каждой из фаз внутри цинкового покрытия.
Рис. 7.41. Сущность эффекта Киркендаля. Пластина из латуни окружена слоем меди, нанесенной электролитически, причем на границе латунного образца предварительно закреплены метки из молибденовой проволоки. В результате выдерживания образца в течение нескольких сотен часов при повышенной температуре метки передвинулась внутрь образца.
Когда анализируют данные по кинетике образования цинк- железного покрытия на образце, исследуются дотошно любые факты, включая тип и структуру образующихся железо-цинковых сплавов, но ни в одной статье до настоящего времени не анализировалась форма фронта цинка в покрытии. Между тем, именно форма фронта говорит о многом, и именно выяснение причин ее образования может стать ключом к количественному описанию скорости образования железо-цинковых слоев.Обратим внимание на следующее. Почти во всех исследованиях в низкотемпературной области (достоверных сведений о форме фронта в высокотемпературной области нами не найдено) образуется форма обрывного фронта, близкая к изображенной на рис. 7.40. Эта форма не сильно зависит от температуры процесса, толщины образующегося покрытия и наличия или отсутствия в образце кремния (фосфора). Между тем имеется очень мало процессов, которые характеризуются такой формой фронта. Одним из таких процессов является процесс горения с быстрым отводом образующихся продуктов горения от поверхности. Для горящего шара, например, процесс горения описывается уравнением:
где R — радиус шара до начала горения, r — радиус координаты горения, D — коэффициент диффузии.
Очевидно, что если мы сделаем плоский образец с защитой боковых поверхностей, то процесс горения будет происходить только на одной из поверхностей без изменения ее реальной площади, то есть скорость уменьшения толщины образца будет пропорциональна времени. Пример такого процесса – «курение сигареты» автоматическим курильщиком с постоянной скоростью просасывания воздуха через образец.
Между тем, в огромном большинстве исследований наблюдается обратноквадратичная зависимость скорости образования слоя (скорости вымывания железа в расплав) от времени, то есть выполняется зависимость:
Однако необходимо тщательно проверить последнее утверждение, прежде чем принимать его за аксиому.
На рис. 7.42 и 7.43 приведены данные по зависимости скорости накопленияжелеза в расплаве от времени при различных температурах. В книге утверждается, что при построении этих данных в координатах получаются прямые линии для всех температур, кроме данных при 510°С, где наблюдается прямолинейная зависимость. Проверим это утверждение.
Рис. 7.42. Зависимость скорости накопления железа в расплаве с течением времени от температуры в высокотемпературной области.
Рис. 7.43. Зависимость скорости накопления железа в расплаве от времени в низкотемпературной области.
Таблица № 7.5. Определение формального порядка реакции методом сравнения с базисной зависимостью для данных по скорости вымывания железа из образца в течение процесса цинкования.
Тема №10 Кинетика диффузионных процессов в твердых телах. Определение диффузии. Первое и второе уравнения Фика
Кинетика диффузионных процессов в твердых телах.
Определение диффузии. Первое и второе уравнения Фика.
Определим диффузию как процесс переноса вещества из одной части системы в другую, происходящий под действием градиента концентрации. Отметим, однако, что градиент концентрации – важная, но не единственная причина, вызывающая перенос вещества в системе.
При свободной диффузии не взаимодействующих между собой частиц (в отсутствии приложенных внешних сил) в однородном и изотропном твердом теле поток диффузионных частиц 


где 

где 

В случае независимости коэффициента диффузии от концентрации легирующих частиц, применение закона сохранения вещества при диффузии в форме уравнения непрерывности для потока частиц позволяет перейти ко второму уравнению Фика, устанавливающему связь между концентрацией диффундирующих частиц в различных точках тела и временем диффузии:

Для трехмерного случая:


где 

Второй закон Фика, как закон сохранения вещества, можно записать в форме уравнения непрерывности:

Размерность плотности потока вещества зависит от размерности концентрации. Если 

Одним из основных параметров диффузии является коэффициент диффузии, вводимый как коэффициент пропорциональности между потоком и градиентом концентрации вещества в уравнении (10.1). В зависимости от условий проведения диффузионного опыта, различают несколько типов коэффициента диффузии.
1. Для описания взаимной диффузии при контакте двух образцов неограниченно растворимых один в одном, пользуются понятием коэффициента взаимной диффузии 
2. Подвижность каждого компонента в свою очередь характеризуется собственным коэффициентом диффузии 



3. Кроме того, подвижность 


Порциальные коэффициенты можно определить как для собственной, так и для взаимной диффузии. Все введенные до сих пор коэффициенты являются коэффициентами гитеродиффузии (химической диффузии), т. е. такой диффузии, которая имеет место при наличии только градиента концентрации.
Диффузия в реальных кристаллах происходит вследствие четырех основных механизмов:
1. Для идеальных кристаллов процесс диффузии предполагает простой обмен местами между соседними атомами вещества. В этом случае необходимо затратить значительную энергию (порядка энергии связи между соседними атомами решетки).
2. Для примесей внедрения характерно перемещение атомов по междоузлиям из-за наличия в системе некоторой концентрации дефектов.
3. При вакансионном механизме диффузии один из соседних атомов занимает близлежащую вакансию. Вакансии могут образовываться вследствие того, что некоторые атомы, совершающие тепловые колебания около положения равновесия, могут иметь энергию, значительно превышающую среднюю энергию связи. Такие атомы уходят из узлов решетки в междуузельное пространство, образуя вакансию. Такая вакансия перемещается в кристалле путем последовательного заполнения ее другими атомами.
4. Возможна также диффузия по междоузлиям путем вытеснения, когда атом выталкивает одного из ближайших соседей в междоузлие, а сам занимает его место в решетке.
Таким образом, мы видим, что в твердых телах благодаря тепловому движению происходит непрерывное перемешивание частиц. Скорость перемешивания зависит от среднего времени 

где 






В большинстве случаев коэффициент диффузии в твердых телах увеличивается с ростом температуры по закону, имеющему вид уравнения Аррениуса:

где 
Процессы взаимной диффузии в поликристаллических пленках металлов приводят к образованию интерметаллидов. При этом можно выделить следующие изменения их свойств:
1. Образуются металлические слои, структура которых имеет большое количество дефектов, через которые возможна диффузия примесей и газов.
2. Электронные характеристики пленок металлов из-за образования твердых растворов металлов и соединений изменяются.
3. Меняется толщина и состав переходного слоя.
4. Возможно развитие неоднородностей в слоях металлов и в переходном слое из-за неравномерности взаимной диффузии металлов через границу раздела.
Отмеченные выше процессы приводят к деградации электрических параметров и зависят от количества продиффундированного в структуру вещества. Поэтому особенно важно уметь находить зависимости распределения концентрации диффундирующих примесей в структурах от времени и температуры процесса диффузии. Это можно сделать, решив второе уравнение Фика или уравнение диффузии.
Уравнение диффузии представляет собой дифференциальное уравнение в частных производных и для его решения необходимо сформулировать начальные и граничные условия, которым должна удовлетворять концентрация и первоначальное распределение диффундирующего вещества. Эти условия определяют на основе анализа конкретной ситуации, в которой происходит процесс диффузии. Здесь важно отметить, что внутри твердого тела концентрация является непрерывной функцией координат и времени, а ее первая производная по времени 



Начальное распределение концентрации 


Уравнение диффузии (в физике его чаще называют уравнением теплопроводности) можно решить различными методами. Обычно в практике пользуются следующими методами его решения:
1. Метод разделения переменных (Фурье).
2. Операторный метод (Лапласа – Карсона – Хевисайда).
3. Метод источника (метод функций Грина).
4. Численные методы.
5. Метод Монте – Карло.
Следует отметить, что в настоящее время сам процесс диффузии в технологии изготовления полупроводниковых приборов и ИМС усовершенствован до такой степени, что можно создавать 
Контрольные вопросы
1. Что такое диффузия?
2. Как записывается первое уравнение Фика?
3. Как записывается второе уравнение Фика?
4. Что такое коэффициент диффузии?
5. Какие различают типы коэффициентов диффузии?
6. Как записывается зависимость изменения коэффициента диффузии от температуры в твердом теле?
7. Как процессы взаимной диффузии и образование при этом интерметаллидов изменяют свойства пленок металлов?
8. Как можно задавать начальное распределение концентрации и граничные условия (условия на поверхности) при решении уравнения диффузии?
ОСНОВНЫЕ ЗАКОНЫ МАССОПЕРЕДАЧИ
В процессах массопередачи следует различать несколько случаев массообмена: между потоком газа или пара и потоком жидкости; между потоками жидкости; между потоками жидкости и твердой фазой; между потоками газа или пара и твердой фазой.
Основными законами массопередачи являются закон молекулярной диффузии (первый закон Фика), закон массоотдачи (закон Ньютона — Щукарева) и закон массопроводности.
Закон молекулярной диффузии (первый закон Фика), основанный на том, что диффузия в газах и растворах жидкостей происходит в результате хаотического движения молекул, приводящего к переносу молекул распределяемого вещества из зоны высоких концентраций в зону низких концентраций, гласит: количество вещества, перенесенного путем диффузии, пропорционально градиенту концентраций, площади, перпендикулярной направлению диффузионного потока, и продолжительности процесса:
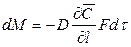
где: dM – количество вещества, перенесённого путём диффузии; D – коэффициент пропорциональности, или коэффициент диффузии; 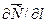
Коэффициент диффузии показывает, какое количество вещества диффундирует через поверхность в 1 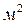
Знак «минус» в правой части уравнения показывает, что при молекулярной диффузии концентрация убывает.
Если единицы измерений [М] = [кг], [Р] = [ 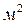
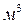
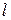
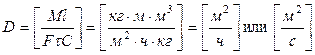
Значения коэффициента диффузии обычно берут из справочников или находят по следующим формулам:
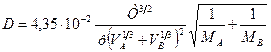
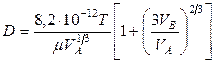
где: Т – температура, К; 
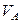
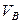
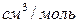

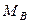
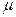
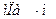
Коэффициенты диффузии зависят от агрегатного состояния систем. Для газов коэффициенты диффузии имеют значения (0,1. 1,0)10 -4 
Коэффициенты диффузии в газах почти не зависят от концентрации, в то время как коэффициенты диффузии в жидкостях изменяются с изменением концентрации диффундирующего вещества.
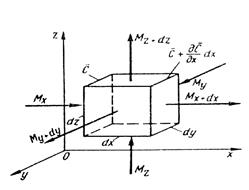
Дифференциальное уравнение молекулярной диффузии (второй закон Фика) получают, рассмотрев материальный баланс по распределяемому веществу для элементарного параллелепипеда, выделенного мысленно в потоке одной из фаз (рис. 12.3).
Рис. 12.3. К выводу дифференциального уравнения молекулярной диффузии
Пусть через этот элементарный параллелепипед за счет молекулярной диффузии перемещается вещество. Если через грани 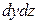
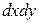
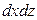
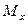
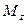


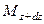

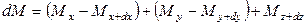
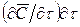
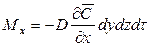
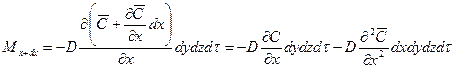

Аналогично найдем разности между количествами вещества, прошедшего через другие противоположные грани параллелепипеда.
Общее количество приобретенного вещества

Это же количество вещества можно найти умножением объема параллелепипеда на изменение концентрации диффундирующего вещества за время 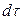

Приравнивая уравнения (12.12) и (12.13), получим дифференциальное уравнение молекулярной диффузии
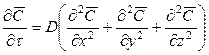
Основной закон массоотдачи, который является аналогом закона Ньютона, был установлен русским ученым Щукаревым при изучении растворения твердых тел. Этот закон формулируется так: количество вещества, перенесенного потоком от поверхности раздела фаз (контакта фаз) в воспринимающую фазу или в обратном направлении, прямо пропорционально разности концентраций у поверхности контакта фаз и в ядре потока воспринимающей фазы, площади поверхности контакта фаз и продолжительности процесса.
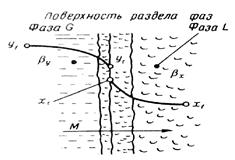
Согласно теории диффузионного пограничного слоя распределяемое вещество переносится из ядра потока жидкости к поверхности раздела фаз непосредственно конвективными потоками жидкости и молекулярной диффузией. В рассматриваемой системе (рис. 12.4) различают ядро потока и приграничный диффузионный слой. В ядре перенос вещества осуществляется преимущественно потоками жидкости или газа. В условиях турбулентного течения потоков концентрация распределяемого вещества в данном сечении в условиях стационарного режима сохраняется постоянной. По мере приближения к пограничному диффузионному слою турбулентный перенос снижается и начинает увеличиваться перенос за счет молекулярной диффузии. При этом появляется градиент концентрации распределяемого вещества, растущий по мере приближения к границе. Таким образом, область пограничного диффузионного слоя — это область появления и роста градиента концентрации, область увеличения влияния скорости молекулярной диффузии на общую скорость массопередачи.
Рис.12.4. К выводу уравнения массоотдачи
Примем, что распределяемое вещество М переходит из фазы G, в которой его концентрация выше равновесной, в фазу L.
Если концентрации вещества в ядрах фаз принять равными 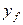
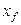
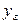

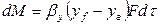
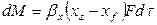
где: 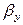
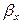
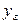



Размерность коэффициента массоотдачи 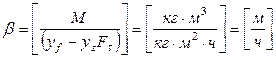
Коэффициент массоотдачи показывает, какое количество вещества передается от поверхности контакта фаз площадью в 1 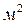
По физическому смыслу коэффициенты массоотдачи отличаются от коэффициентов массопередачи, но выражаются в одинаковых единицах.
Для установившегося процесса 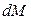
Для этого случая уравнение (12.15) перепишется так:
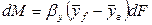
Если 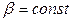
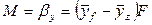
Если рассмотреть вновь элементарный объем фазы (см. рис. 12.3), перемещающийся в пограничном слое, то можно утверждать, что концентрация распределяемого вещества в нем меняется не только за счет молекулярной диффузии, но также и за счет турбулентного переноса его. В этом случае концентрация распределяемого вещества будет функцией не только координат и времени, как в случае только молекулярной диффузии, но и скорости перемещения.
Соответственно этому изменение концентрации G выразим через субстанциональную производную:
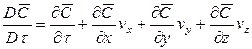
В этом уравнении сумма членов 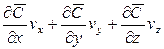
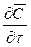
Увеличение количества распределяемого вещества за счет молекулярной диффузии определяется уравнением (12.14). Приравнивая уравнение (12.17) к (12.14) и заменяя локальное изменение концентрации 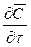
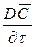
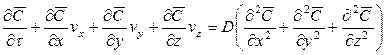
Для полного математического описания процесса это уравнение должно быть дополнено уравнением, характеризующим условие на границе раздела фаз.
Количество вещества, передаваемого из фазы в фазу у границы, определяется основным законом конвективной диффузии (12.15). У поверхности раздела фаз вещество переходит из фазы в фазу, как было установлено выше, за счет молекулярной диффузии [см. уравнение (12.9)]. Приравнивая эти уравнения, получим
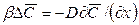
где: 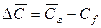
Уравнение (12.19) характеризует условие массообмена на границе фазы и дополняет уравнение (12.18), являясь вместе с ним математическим описанием процесса конвективной диффузии.
Критериальные уравнения конвективной диффузии получают из уравнений (12.18) и (12.19).
Для получения диффузионных критериев, подобия воспользуемся методами теории подобия. Из уравнения (12.19) получим безразмерный комплекс 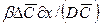
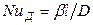
который характеризует условия на границе рассматриваемой фазы, т. е. выражает отношение интенсивности переноса вещества в ядре фазы конвективной диффузией 
Из дифференциального уравнения конвективной диффузии (12.18), разделив все члены на 
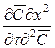
и соответственно диффузионный критерий Фурье
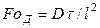
и диффузионный критерий Пекле
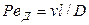
Критерий 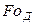
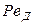

Диффузионный критерий Прандтля 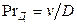
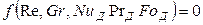
Критерий Нуссельта в этом уравнении является определяемым в отличие от других критериев, которые являются определяющими, т. е. составленными целиком из параметров, входящих в условие однозначности. Коэффициент массоотдачи, входящий в критерий Нуссельта, не входит в условие однозначности и является искомой величиной.
В явном виде уравнение (12.23) перепишется так:
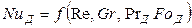
Критерий Грасгофа в этом уравнении характеризует конвективную диффузию в условиях естественной конвекции.
В случае стационарных процессов из общего критериального уравнения исключается критерий Фурье и оно приобретает вид
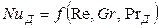
При вынужденном движении можно пренебречь естественной конвекцией. В этом случае из уравнения (12.25) выпадает критерий Грасгофа и уравнение приобретает вид

Конкретные критериальные уравнения приводятся в соответствующих главах этой части.
По значениям критерия Нуссельта, найденным по критериальным уравнениям, определяют коэффициент массоотдачи

Между переносом теплоты, массы и механической энергии существует, как отмечалось ранее, аналогия, эти процессы описываются однотипными дифференциальными уравнениями.
При рассмотрении движения потока жидкости в трубе различают пограничный слой и ядро потока. В ядре турбулентного потока происходит выравнивание скоростей по нормали к вектору скорости, в пограничном же слое происходит резкое изменение скорости потока до нуля. Такое же выравнивание температур и концентраций происходит в процессах тепло- и массопередачи. Таким образом, имеет место аналогия между этими процессами.
Исходя из этой аналогии, можно приближенно определять коэффициенты массоотдачи по данным о трении жидкостного потока или о скорости переноса теплоты.
На основании гидродинамической аналогии можно определить отношение коэффициента массоотдачи 
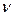

Критерий Стантона характеризует подобие полей концентраций и скоростей при массоотдаче в турбулентных потоках.
Существует связь между коэффициентом массопередачи и коэффициентами массоотдачи. Рассмотрим процесс массопередачи при переходе распределяемого вещества из фазы G в фазу L при условии линейных зависимостей между рабочими и равновесными концентрациями (см. рис. 12.4). Примем, что на границе раздела фаз достигается равновесие.
Количество вещества, перемещающегося из фазы G к поверхности на границе раздела фаз, может быть определено по уравнению
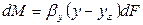
где: 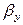
Количество распределяемого вещества, перемещающегося от элемента поверхности в фазу L, может быть вычислено также по фазе L по уравнению (12.15). В этом случае движущую силу следует выразить разностью 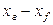
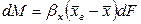
где: 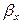
Так как известна равновесная зависимость 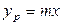
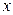
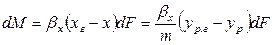
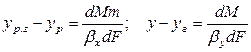
Сложим левые и правые части этих уравнений
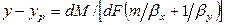
так как 
Из основного уравнения массопередачи (12.4) получим
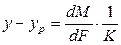
Приравнивая правые части уравнения, получим
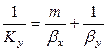
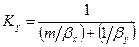
Рассуждая аналогично, для фазы L будем иметь
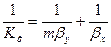
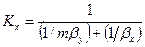
Левые части этих уравнений представляют собой общее диффузионное сопротивление переносу, а их правые части — сумму диффузионных сопротивлений массоотдаче в фазах. Зависимости (12.28) и (12.29) являются поэтому уравнениями аддитивности фазовых сопротивлений.
Коэффициенты 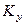
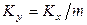
Дата добавления: 2015-03-14 ; просмотров: 4873 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://pandia.ru/text/80/099/45272.php
http://helpiks.org/2-105082.html