—> Детская Энциклопедия —>
Уравнение состояния
И химику, и теплотехнику, и физику, и конструктору новых космических кораблей мало знать общие закономерности поведения системы вообще. Им нужно рассчитывать совершенно конкретные задачи: один хочет знать, с помощью какой химической реакции он сможет получить новое соединение дешевле и проще; другому необходимо еще более повысить коэффициент полезного действия у двигателя; физик, например, мечтает достичь настолько высоких температур, чтобы можно было осуществить начало термоядерной реакции; космонавтам необходимы еще более тяжелые космические корабли, и им нужно новое топливо, еще более мощное и с большим тяговым усилием.
Это примеры очень важных, имеющих огромное значение процессов, в них принимают участие определенные реальные вещества. И свойства этих веществ должны входить в термодинамические расчеты.
Для этого нужно знать уравнение состояния вещества. Его нельзя получить при помощи термодинамики. Оно должно быть найдено другим, независимым путем — либо точными измерениями, либо теоретически.
Уравнение состояния необходимо термодинамике знать заранее, без него она ничего не может рассчитать. Оно позволяет рассчитать для определенного вещества любую из четырех важнейших величин — количество вещества (т), его объем (v), давление (р) или температуру (Т), если известны три остальные величины:
Удобнее рассматривать всегда один моль газа, тогда уравнение состояния будет проще:
Каждый школьник знает уравнение состояния идеальных газов, его вывел впервые петербургский профессор француз Клапейрон:
Такое допущение определяет область, в которой применяется это уравнение: при низком давлении газ занимает настолько большой объем, что объемом самих молекул можно смело пренебречь, а при высокой температуре молекулы обладают такой большой энергией и такой большой скоростью, что взаимное притяжение не влияет на их движение.
Конечно, в действительности нельзя пренебрегать ни собственными размерами молекул, ни их взаимным притяжением. 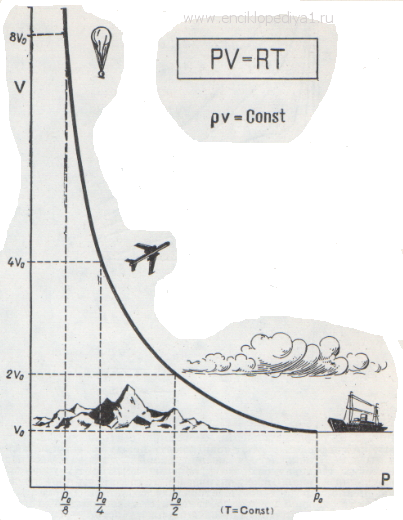
Эти поправки ввел в уравнение идеального газа голландский ученый Ван-дер-Ваальс. Он предложил уравнение
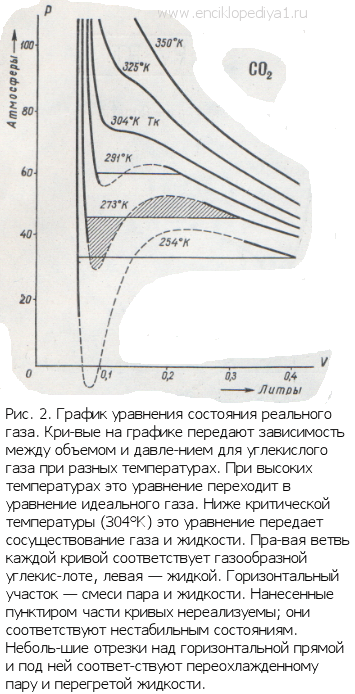
Таким образом, в совокупности свойств, характеризующих состояние системы, нельзя
произвольно менять значения всех свойств. Эти значения связаны между собой уравнением. Уравнение состояния обязательно нужно знать, только при этом условии возможно успешно использовать замечательный математический аппарат термодинамики.
Для чего нужно уравнение состояния?
Читайте также:
| ||||
 | ||
 | ||

1) y=2; 2) y=0,5x; 3) x=4; 4) y= 
2.2. Физическая разминка.
1. Выразить величину из формулы:
А) выразить m 0 из формулы 
Б) выразить m из формулы 

В) выразить V из формулы 
2. Чему равна температура по шкале Кельвина, если по шкале Цельсия она равна 27º?
3. Рассчитать молярную массу бутана C 4 H 10 .
3. Изучение нового материала.
3.1. Вывод уравнения состояния идеального газа.















Получаем
Какие параметры газа из этого уравнения могут изменяться?
Соберем все изменяющиеся параметры в одну часть уравнения. Получим уравнение Клапейрона или универсальный газовый закон.

В жизни открытия уравнений было с точностью до наоборот. Судьба этих гениальных ученых удивительным образом переплетена. Француз Бенуа Поль Эмиль Клапейрон старше Дмитрия Ивановича Менделеева на 35 лет. Но они работали в одном Институте путей сообщения в Петербурге, правда, в разное время. Сначала в 1834 году Клапейрон открыл свое уравнение для идеального газа, а 40 лет спустя в 1874 году Менделеев обобщил все газовые законы в общее уравнение, которое назвал уравнением состояния или уравнением Менделеева-Клапейрона. А вообще история открытий газовых законов растянулась более, чем на 200 лет. Первым был открыт закон Бойля-Мариотта в 1662 году.
Для чего нужно уравнение состояния? Знать уравнение состояния необходимо при исследовании тепловых явлений. Оно позволяет полностью или частично ответить на три группы различных вопросов:
1) Уравнение состояния позволяет определить одну величин, характеризующих состояние, например, температуру, если известны две другие величины. Это используется в термометрах.
2) Зная уравнение состояния можно сказать, как протекают процессы при определенных внешних условиях: например, как будет меняться давление газа, если увеличить его объем при неизменной температуре.
3) Зная уравнение состояние, можно определить, как меняется состояние системы, если она совершает работу, или получает теплоту от окружающих тел.
Проанализируем уравнение Клапейрона.
1) Если давление газа увеличить в 2 раза и объем тоже увеличить в 2 раза. Что произойдет с температурой?
2) Если давление увеличить в 4 раза, а температуру увеличить в 2 раза, что произойдет с объемом?
3) Если объем увеличить в 3 раза и температуру увеличить в 3 раза, что произойдет с давлением?
1. P=const 

V=const 

T=const 

2. Для более глубокого и детального изучения изопроцессов заполним сравнительную таблицу и построим графики. Откройте учебники на странице 120.
http://mybiblioteka.su/2-2752.html
http://infourok.ru/urok-po-fizike-v-10-klasse-uravnenie-sostoyaniya-idealnogo-gaza-gazovye-zakony-5141583.html

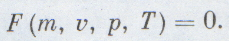
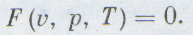
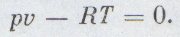
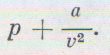
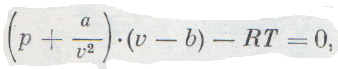

 Задачи
Задачи Б)
Б)  В)
В) 
 2. Установить соответствие. Для каждого графика найти соответствующую ему функцию.
2. Установить соответствие. Для каждого графика найти соответствующую ему функцию.
 х
х



