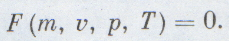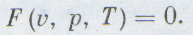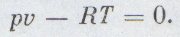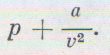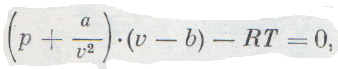Для чего нужно уравнение состояния?
Читайте также:
|
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза |  |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул |  |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы |  |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
—> Детская Энциклопедия —>
Уравнение состояния
И химику, и теплотехнику, и физику, и конструктору новых космических кораблей мало знать общие закономерности поведения системы вообще. Им нужно рассчитывать совершенно конкретные задачи: один хочет знать, с помощью какой химической реакции он сможет получить новое соединение дешевле и проще; другому необходимо еще более повысить коэффициент полезного действия у двигателя; физик, например, мечтает достичь настолько высоких температур, чтобы можно было осуществить начало термоядерной реакции; космонавтам необходимы еще более тяжелые космические корабли, и им нужно новое топливо, еще более мощное и с большим тяговым усилием.
Это примеры очень важных, имеющих огромное значение процессов, в них принимают участие определенные реальные вещества. И свойства этих веществ должны входить в термодинамические расчеты.
Для этого нужно знать уравнение состояния вещества. Его нельзя получить при помощи термодинамики. Оно должно быть найдено другим, независимым путем — либо точными измерениями, либо теоретически.
Уравнение состояния необходимо термодинамике знать заранее, без него она ничего не может рассчитать. Оно позволяет рассчитать для определенного вещества любую из четырех важнейших величин — количество вещества (т), его объем (v), давление (р) или температуру (Т), если известны три остальные величины:
Удобнее рассматривать всегда один моль газа, тогда уравнение состояния будет проще:
Каждый школьник знает уравнение состояния идеальных газов, его вывел впервые петербургский профессор француз Клапейрон:
Такое допущение определяет область, в которой применяется это уравнение: при низком давлении газ занимает настолько большой объем, что объемом самих молекул можно смело пренебречь, а при высокой температуре молекулы обладают такой большой энергией и такой большой скоростью, что взаимное притяжение не влияет на их движение.
Конечно, в действительности нельзя пренебрегать ни собственными размерами молекул, ни их взаимным притяжением. 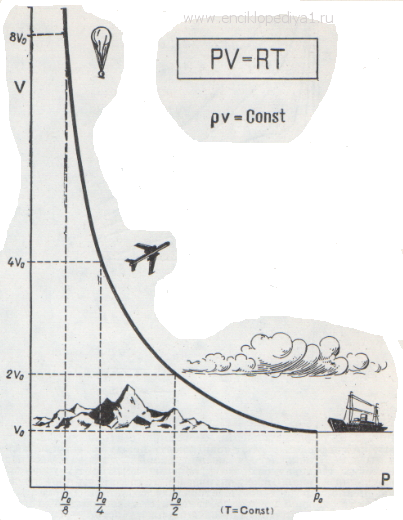
Эти поправки ввел в уравнение идеального газа голландский ученый Ван-дер-Ваальс. Он предложил уравнение
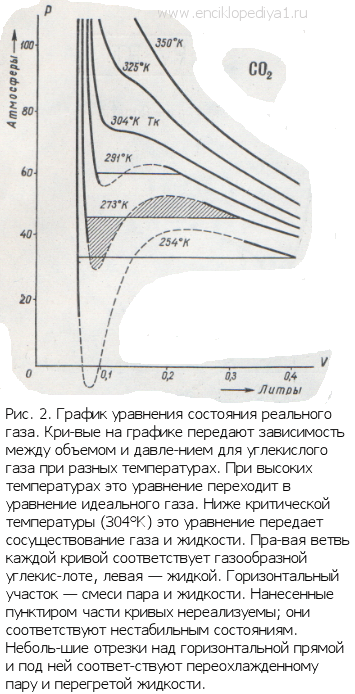
Таким образом, в совокупности свойств, характеризующих состояние системы, нельзя
произвольно менять значения всех свойств. Эти значения связаны между собой уравнением. Уравнение состояния обязательно нужно знать, только при этом условии возможно успешно использовать замечательный математический аппарат термодинамики.
http://spadilo.ru/uravnenie-sostoyaniya-idealnogo-gaza/
http://enciklopediya1.ru/index/0-729

 Задачи
Задачи