Шпаргалки к экзаменам и зачётам
студентам и школьникам
Ответы к экзамену по физической химии для аспирантов — Электроды второго рода. Каломельный электрод
Cмотрите так же.
Электроды второго рода. Каломельный электрод. Окислительно-восстановительные электроды.
Электроды второго рода
Состоят из металла, покрытого слоем труднорастворимой соли этого металла и опущенного в раствор соли, образующей такой же анион, как и труднорастворимое соединение металла. Электроды второго рода обладают высокой стабильностью потенциалов и применяются в качестве электродов сравнения.
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl – представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
б) Каломельный электрод (КЭ) Hg, Hg 2Cl 2|Cl – – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg 2Cl 2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Каломельный электрод — электрод, использующийся в качестве электрода сравнения в гальванических элементах. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути, помещённую в насыщенный каломелью раствор хлорида калия определённой концентрации. Схематически его записывают следующим образом: Pt|Hg|Hg2Cl2|Cl- .
Уравнение окислительно-восстановительного процесса, протекающего в каломельном электроде, имеет вид 

Потенциал каломельного электрода зависит, таким образом, только от температуры и активности хлорид-ионов. На практике обычно используется насыщенный раствор KCl; в этом случае потенциал насыщенного каломельного электрода зависит только от температуры и составляет 0.2412 В при 25 °С.
Достоинством насыщенных каломельных электродов является хорошая воспроизводимость потенциала. Работоспособны при температурах до 80 °С; при более высоких температурах начинается разложение каломели. Ввиду токсичности ртути, содержащейся в каломельных электродах, в настоящее время они применяются сравнительно редко.
Окислительно-восстановительный электрод — в электрохимии — система из инертного электронного проводника (металла), находящегося в контакте с раствором электролита, содержащим окисленную и восстановленную форму одного и того же химического элемента или соединения.
Уравнение Никольского
При ионообменной адсорбции происходит стехиометрический обратимый обмен ионов между объемом раствора электролитов и адсорбентом.
Процессы ионного обмена на твердой поверхности характеризуются уравнением Б.П.Никольского:

где 




Графически уравнение Б.П.Никольского изображается прямой, тангенс угла наклона которой и представляют величину константы К.
Примеры решения задач:
1. Рассчитать удельную поверхность адсорбента по изотерме адсорбции бензола на его поверхности. Площадь, занимаемая молекулой бензола, S0=49·10 -20 м 2 .
| p P/PS | 0.024 | 0.08 | 0.14 | 0.20 | 0.27 | 0.35 | 0.46 |
| a·10 3 , моль/кг | 14,9 | 34,8 | 47,2 | 56,8 | 66,3 | 79.3 | 101.0 |
Решение. Проверяют применимость к экспериментальным данным теории БЭТ. С этой целью рассчитывают абсциссу и ординату уравнения изотермы адсорбции БЭТ в линейной форме, т.е.

Результаты вычислений сводят в таблицу 1 и строят график зависимости y=f(x)
| p/ps | y, кг/моль | p/ps | y, кг/моль |
| 0,024 | 1,650 | 0,27 | 5,466 |
| 0,08 | 2,499 | 0,35 | 6,790 |
| 0,14 | 3,449 | 0,46 | 8,343 |
Рис.1 изотерма адсорбции в координатах линейной формы уравнения БЭТ.
Для определения адсорбционной емкости монослоя аm по графику зависимости у=f(x) находят константы уравнения прямой линии: отрезок, отсекаемый на оси ординат при p/ps=0, b0=1.24 кг/моль, и угловой коэффициент прямой b1=15.8 кг/моль. Для сравнения вычисляют b0 и b1
методом наименьших квадратов. Данные для расчёта b0 и b1 приведены в таблице 2.
| n | x | y, кг/моль | xy, кг/моль | x 2 |
| 0,024 | 1,650 | 0,0396 | 5,76·10 -4 | |
| 0,080 | 2,499 | 0,2000 | 6,4·10 -3 | |
| 0,140 | 3,499 | 0,4830 | 1,96·10 -2 | |
| 0,200 | 4,400 | 0,8800 | 4,00·10 -2 | |
| 0,270 | 5,466 | 1,4550 | 7,08·10 -2 | |
| 0,350 | 6,790 | 2,3765 | 0,123 | |
| 0,460 | 8,434 | 3,8778 | 0,212 |
k=13,65 и am=0,0489 моль/кг.
По величине аm рассчитывают удельную поверхность адсорбента:
2. Вычислить предельный адсорбционный объём активированного угля БАУ по изотерме адсорбции бензола (таблица 3). Молярный объём бензола vm=89·10 -6 м 3 /моль.
| p/ps | a, моль/кг | p/ps | a, моль/кг | p/ps | a, моль/кг |
| 1,33·10 -6 | 0,50 | 1,63·10 -2 | 2,25 | 0,327 | 2,86 |
| 2,13·10 -5 | 0,85 | 3,77·10 -2 | 2,39 | 0,460 | 3,00 |
| 1,21·10 -4 | 1,18 | 9,47·10 -2 | 2,56 | 0,657 | 3,19 |
| 5,60·10 -4 | 1,55 | 0,201 | 2,74 | 0,847 | 4,47 |
Решение. Проверяют применимость уравнения (II.15) к экспериментальным данным. С этой целью вычисляют lg a и 

 | lg a |  | lg a |  | lg a |
| 34,52 | -0,3010 | 3,19 | 0,3522 | 0,230 | 0,4564 |
| 21,82 | -0,0706 | 2,03 | 0,3784 | 0,113 | 0,4771 |
| 15,34 | 0,0719 | 1,05 | 0,4082 | 0,033 | 0,5038 |
| 10,58 | 0,1903 | 0,48 | 0,4378 | 0,005 | 0,6503 |
Рис.2 Изотерма адсорбции в координатах линейной формы уравнения М.М.Дубинина.
Как видно из рис.2, экспериментальные точки с хорошим приближением укладываются на прямую линию и, следовательно, уравнение (15) применимо к адсорбции бензола на активированном угле БАУ.
По отрезку, отсекаемому па оси lg a при 

3. По экспериментальным данным сорбции паров воды на активированном угле при Т = 293 К построить кривую капиллярной конденсации. Показать наличие гистерезиса и, используя ветвь десорбции, построить интегральную и дифференциальную кривые распределения пор по радиусам.
аадс ·10 3 ,моль/кг. 3,75 5,3 6;2 8,75 10,4 12, 5 13 ,4
адес·10 3 , моль/кг . . .. 3,75 7,0 7,9 10,0 11,5 13,0 13,4
Vm=18·10 -3 м3/моль, σ= 72,5-10 -3 Дж/м 2 .’
Решение. Строят изотерму капиллярной конденсации в соответствии с условием задачи. Выбирают ряд точек на ветви десорбции (не менее шести—восьми), соответствующих определенным значениям p/pS, и рассчитывают объем пор, заполненных конденсатом, по уравнению V=aVm. Затем для этих же значений по уравнению
рассчитывают максимальный радиус пор, заполненных конденсатом при соответствующих давлениях p/ps. Полученные данные записывают в табл. 5 и строят структурную кривую адсорбента в координатах V=f(r). Из кривой находят ряд значений ΔV/Δr (табл.6) и строят дифференциальную кривую распределения объёма пор по радиусам в координатах ΔV/Δr=f(r)
Таблица.5 Данные для построения интегральной кривой распределения объёма пор по радиусам.
| № точки | P/PS | aдес·10 3 ,моль/кг | V·10 6 ,м 3 /кг | r·10 10 ,м |
| 0,05 0,1 0,2 0,4 0,6 0,8 0,9 0,98 | 0,5 3,7 7,0 7,9 9,0 10,0 10,9 11,5 | 0,9 66,6 126,0 142,0 162,0 180,0 196,0 207,0 | 2,2 4,6 6,6 8,5 11,6 15,5 20,2 26,3 |
Таблица.6 Данные для построения дифференциальной кривой распределения объёма по радиусам.
| ΔV/Δr·10 — 4 ,м 2 /кг | Δr·10 10 ,м | ΔV/Δr·10 — 4 ,м 2 /кг | Δr·10 10 ,м | ΔV/Δr·10 — 4 ,м 2 /кг | Δr·10 10 ,м |
| 1,5 0,5 |
Рис.3 Интегральная(1) и дифференциальная(2) кривые распределения.
Задачи
1. Ниже приведены экспериментальные данные по адсорбции азота на TiO2 (рутиле) при 75 К:
P·10 2 Па……….60,94 116,41 169,84 218,65 275,25
А, моль/кг……. 0,367 0,417 0,467 0,512 0,567
Постройте график соответствующий линейному уравнению БЭТ. Найдите константы 
занимаемая одной молекулой азота S0=0,16 нм 2 .
2.Окись углерода адсорбируется на слюде; данные при 90 К представлены ниже. Определите, какой изотерме – Лэнгмюра или Фрейндлиха – лучше соответствуют эти данные? Каково значение К для адсорбционного равновесия? Взяв общую поверхность равной 6200см 2 , рассчитайте площадь, занимаемую каждой адсорбированной молекулой.
Vа, см 3 ……………..0,130 0,150 0,162 0,166 0,175 0,180
Р, мм. рт. cт.………. 100 200 300 400 500 600.
3.При измерении адсорбции газообразного азота на активном угле при 194.4К были получены следующие данные:
р·10 -3 , Па……………….1,86 6,12 17,96 33,65 68,89
А·10 3 , м 3 /кг…………..…5,06 14,27 23,61 32,56 40,83
Значения А даны для азота при нормальных условиях.
Рассчитайте, постоянные в уравнение Лэнгмюра и удельную поверхность активированного угля, принимая плотность газообразного азота равной
1,25 кг/м 3 , а площадь занимаемую одной молекулой азота на поверхности адсорбента, равной 0,16 нм 2 .
4.При измерении адсорбции азота на активированном угле при 273 К были получены следующие данные:
А,см 3 /г…………..……0,987 3,04 5,08 7,04 10,31
Р, мм. рт. ст…….……3,93 12,98 22,94 34,01 56,23
Построить график в координатах, в которых происходит спрямление уравнения изотермы Лэнгмюра, и определить константы этого уравнения.
5.Определите константы эмпирического уравнения Фрейндлиха, используя следующие данные об адсорбции диоксида углерода на активном угле при 293 К:
Р·10 -3 , Па…………1,00 4,48 10,0 14,4 25,0 45,2
А·10 2 , кг/кг……….3,23 6,67 9,62 11,72 14,5 17,7.
6.Используя уравнение БЭТ, построить изотерму адсорбции бензола по нижеуказанным данным и рассчитайте удельную поверхность адсорбента по изотерме адсорбции бензола (варианты 1-4):
1. P/Ps.………..0,04 0,08 0,16 0,22 0,27 0,36 0,46
А, моль/кг……. 0,348 0,483 0,624 0,724 0,805 0,928 0,13
2. Р/Рs………. 0,05 0,12 0,19 0,26 0,34 0,44 0,50
А, моль/кг ……. 0,31 0,593 0,795 0,99 1,21 1,525 1,77
3. Р/Рs……….…0,03 0,07 0,12 0,17 0,24 0,31 0,38
А, моль/кг……. 0,196 0,301 0,373 0,423 0,488 0,52 0,625
4. Р/Рs…………. 0,02 0,05 0,11 0,19 0,25 0,3 0,36
А, моль/кг……. 0,104 0,196 0,298 0,387 0,443 0,488 0,55
Площадь, занимаемую молекулой бензола, примите равной 0,49 нм 2 .
7.Используя уравнение БЭТ, рассчитайте удельную поверхность адсорбента по данным об адсорбции азота:
А•10 3 , м 3 /кг…………..0,71 0,31 0,93 1,09
Площадь занимаемая молекулой азота в плотном монослое, равна 0,16 нм 2 ,
Плотность азота 1,25 кг/м 3 .
8.При обработке данных по адсорбции азота на графитированной саже при 77 К с помощью графика, соответствующего линейному уравнению БЭТ,
найдено, что тангенс угла наклона прямой составляет 1,5•10 3 , а отрезок, отсекаемый на оси ординат, равен 5 единицам (адсорбция выражена в м 3 азота на 1 кг адсорбента при нормальных условиях). Рассчитайте удельную поверхность адсорбента, предполагая, что площадь, занимаемая одной молекулой азота, равна 0,16 нм 2 .
9.Ниже приведены результаты измерения адсорбции газообразного криптона (при 77,5К) на катализаторе:
А·10 3 , м 3 /кг…………1,27 1,5 1,76 1,9 1,98
Р, Па……………..…13,22 23,99 49,13 75,70 91,22.
Значения А для криптона даны при нормальных условиях. Определите константы уравнения БЭТ и удельную поверхность катализатора, принимая, что один атом криптона занимает площадь 0,195нм 2 , Рs=342,6 Па, плотность криптона равна 3,74 кг/м 3
10.используя уравнение БЭТ, рассчитайте удельную поверхность адсорбента по изотерме адсорбции азота:
А, моль/кг……..2,16 2,39 2,86 3,02 3,22 3,33
Площадь занимаемая одной молекулой азота в адсорбционном слое 0,16 нм 2 .
11.По изотерме адсорбции азота определить удельную поверхность адсорбента
(Т=77 К, S0=16,2·10 -20 м 2 ). (Варианты 1-5).
1. Р/Рs………. 0,04 0,09 0,16 0,20 0,30
А, моль/кг… .2,20 2,62 2,94 3,11 3,58
2. Р/Рs…………0,029 0,05 0,11 0,14 0,20
А, моль/кг………..2,16 2,39 2,86 3,02 3,33
3. Р/Рs………….0,02 0,04 0,08 0,14 0,16 0,18
А, моль/кг………..1,86 2,31 2,72 3,07 3,12 3,23
Для следующих двух вариантов объем адсорбированного газа приведен к нормальным условиям:
4. Р/Рs…………….…0,05 0,10 0,15 0,20 0,25 0,30
А·10 2 м 3 /кг……………..0,70 1,10 1,17 1,32 1,45 1,55
5. Р/Рs……………….0,029 0,05 0,11 0,14 0,18 0,20
А·10 2 м 3 /кг……..……..0,48 0,54 0,64 0,68 0,72 0,75
12.По изотерме адсорбции бензола определить удельную поверхность
адсорбента. Т=293 К, S0=49•10 -20 м 2 . Объем адсорбированного газа приведен к нормальным условиям (варианты 1-4):
1. Р/Рs…………………….0,05 0,10 0,15 0,20 0,25 0,30
А·10 2 , м 3 /кг………………..0,86 1,20 1,40 1,60 1,80 1,90
2. Р/Рs…………………….0,10 0,15 0,20 0,25 0,30 0,35
А·10 2 , м 3 /кг……….………..1,15 1,37 1,55 1,71 1,86 1,99
3. Р/Рs…………………….0,10 0,15 0,20 0,25 0,30 0,35
А·10 2 , м 3 /кг………………..0,89 1,09 1,27 1,45 1,60 1,78
4. Р/Рs…………………….0,08 0,16 0,25 0,35 0,45 0,52
А·10 2 , м 3 /кг………..… ……1,03 1,37 1,70 1,99 2,44 2,82
13.По изотерме адсорбции бензола определить удельную поверхность
адсорбента. Т=293 К, S0=49·10 -20 м 2 (варианты 1-3).
1. Р/Рs……………..0,05 0,10 0,15 0,20 0,30 0,40
А, моль/кг…. ………0,36 0,51 0,60 0,68 0,82 0,98
2. Р/Рs…………. ….0,06 0,12 0,20 0,30 0,40 0,50
А, моль/кг…. ………..0,08 0,16 0,25 0,35 0,45 0,52
3. Р/Рs…………. ….0,46 0,61 0,76 0,89 1,09 1,26
14.Построить изотерму адсорбции нитролигнина на глине и определить константы уравнения Фрейндлиха по следующим экспериментальным данным:
Концентрация водного раствора нитролигнина
Г·10 3 , кг/кг……………………5,0 12,0 21,0 26,0 35,0 38,0.
15.Пользуясь экспериментальными данными ионного обмена ионов кальция (Г1с1) и натрия (Г2с2) на синтетическом катионите, определить графически константу уравнения Никольского К:



16.Пользуясь константами уравнения Фрейндлиха k=4,17·10 -3 , 1/n=0,4, рассчитать и построить изотерму адсорбции углекислого газа на угле для следующих интервалов давления: 100·10 2 , 200·10 2 , 400·10 2 , 500·10 2 Н/м 2 .
17. Пользуясь константами уравнения Фрейндлиха k=3,2·10 -3 , 1/n=0,6 построить кривую адсорбции углекислого газа на угле в интервале давлений от 5·10 2 до 25·10 2 Н/м 2 .
18. По данным сорбции углекислого газа на угле построить изотерму адсорбции и определить константы изотермы адсорбции Фрейндлиха:
Р·10 -2 , Н/м 2 ……………..5,0 10,0 30,0 50,0 75,0 100,0
Г·10 3 , кг/кг……………..30, 5,5 16,0 23,0 31,0 35,0.
19. При изучении реакций обмена Mg-ионов из чернозема с ионами Ca из внесенных минеральных удобрений получены следующие результаты:
Концентрация ионов в растворе Количество сорбированных катионов
С·10 3 , кмоль/м 3 Г·10 5 ,кмоль/кг
2,41 4,75 8,12 42,88
2,25 5,00 7,70 43,30
2,00 5,10 6,90 44,10
1,84 5,50 6,10 44,90
1,53 5,87 4,54 46,46
1,37 5,99 4,12 46,88
Графическим методом определить константу уравнения Никольского.
20.Оределить константу уравнения Никольского К, используя экспериментальные данные реакций обмена ионов Ca из почвы на ионы Na из раствора натриевой соли.
Концентрация ионов в растворе Na…3,26 6,60 13,80 21,25 38,41 65,19
С·10 3 , кмоль/м 3 Ca.…37,84 36,72 34,62 31,87 26,16 17,10
Количество сорбированных Na….0,28 0,60 1,20 1,89 3,18 7,62
ионов Г·10 5 , кмоль/кг Ca…39,72 39,56 39,40 38,93 38,68 37,40
21.Пользуясь экспериментальными данными реакций обмена ионов ионов Na из раствора натриевой соли на ионы Mg из почвы, определить графически константу уравнения Никольского:
Концентрация ионов в растворе Количество сорбированных ионов
С·10 3 ,кмоль/м 3 на почве Г.10 5 , кмоль/кг
13,82 41,92 1,16 25,40
21,25 38,30 1,89 26,13
38,19 31,90 3,62 27,20
65,0 21,14 8,01 29,32
79,25 14,73 11,66 32,84
22. Используя экспериментальные данные адсорбции анилина из его водного раствора на угле, определить графически константы уравнения Лэнгмюра и построить изотерму адсорбции для следующих с1:
C1·10 4 , кмоль/м 3 ……………………3 5 10 15 20
анилина с·10 4 , кмоль/ м …………1,0 4,0 7,5 12,5 17,5
А·10 9 ,кмоль/м 2 …………….……0,3 0,58 0,70 0,87 0,92
23.По экспериментальным данным построить кривую адсорбции углекислого газа на цеолите при 293º и с помощью графического метода определить константы уравнения Лэнгмюра:
Р·10 -2 , н/м 2 ……………….1,0 5,0 10,0 30,0 75,0 100,0 200,0
А·10 3 , кг/кг………………35,0 86,0 112,0 152,0 174,0 178,0 188,0
24.Используя уравнение Лэнгмюра, вычислить величину адсорбции азота на цеолите при давлении р=2,8·10 2 , если А∞=38,9·10 -3 кг/кг, а k=0,156·10 -2 .
25. Найти площадь, приходящуюся на одну молекулу в насыщенном адсорбционном слое анилина на поверхности его водного раствора, если предельная адсорбция А∞=6,0·10 -9 кмоль/м
26.По экспериментальны данным адсорбции углекислого газа на активированном угле, найти константы уравнения Лэнгмюра, пользуясь которыми рассчитать и построить изотерму адсорбции:
P·10 -2 , Н/м2……………..9,9 49,7 99,8 200,0 297,0 398,5
Г·10 3 , кг/кг……………..32,0 70,0 91,0 102,0 107,3 108,0.
27.По константам уравнения Лэнгмюра А∞=182·10 -3 и k=0,1·10 -2 рассчитать и построить изотерму адсорбции углекислого газа на активированном угле в пределах следующих равновесных давлений газа: 10·10 2 – 400·10 2 Н/м.
28.Построить кривую адсорбции углекислого газа на активированном угле при 231 º и определить константы эмпирического уравнения Фрейндлиха, пользуясь следующими экспериментальными данными:
Р·10 -2 , Н/м 2 ………………10,0 44,8 100,0 144,0 250,0 452,0
А·10 3 , кг/кг……………….32,3 66,7 96,2 117,2 145,0 177,0.
29. Используя константы эмпирического уравнения Фрейндлиха k=1,6·10 -3 и 1/n=0,48, построить кривую адсорбции углекислого газа на активированном угле при 271 º в интервале давлений от 2·10 2 до 30·10 2 Н/м 2 .
30. Определить постоянные эмпирического уравнения Фрейндлиха, используя следующие данные для адсорбции при 231К углекислого газа на угле из коксовой скорлупы:
Р, Па·10 -3 ……………….1,000 4,480 10,000 14,40 25,0 45,2
А, кг/кг·10 2 ………………3,23 6,67 9,62 11,72 14,5 17,7.
31. Вычислите площадь поверхности катализатора, если для образования монослоя на нем должно адсорбироваться 103 см 3 /г азота (объем приведен к 760 мм рт.ст. и 0ºС). Адсорбция измеряется при температуре 195ºС. Эффективная площадь, занимаемая молекулой азота при этой температуре, равна 16,2 А 2 .
32.Площадь поверхности 1 г активированного угля равна 1000 м 2 . Какое количество аммиака может адсорбироваться на поверхности 45 г угля при 45ºС и 1 атм, если принять в качестве предельного случая полное покрытие поверхности? Диаметр молекулы аммиака равен 3·10 -10 м. Принимается, что молекулы касаются друг друга так, что центры четырех соседних сфер расположены в углах квадрата.
33. Ниже представлены данные по хемосорбции водорода на порошке меди при 25ºС. Подтвердите, что они подчиняются изотерме Ленгмюра. Затем найдите значение К для адсорбционного равновесия и адсорбционный объем, соответствующий полному покрытию.
Р, мм рт ст…………………..0,19 0,97 1,90 4,05 7,5 11,95
Vа, см 3 ……………………….0,042 0,163 0,221 0,321 0,411 0,471.
34. Определите, какая изотерма – Лэнгмюра или Фрейндлиха – лучше соответствует данным для адсорбции метана на 10 г сажи при 0ºС, приведенным ниже:
Для электродов какого рода выполняется уравнение никольского
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
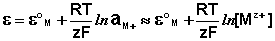
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
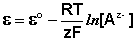
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения . В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
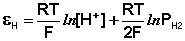
Каломельный электрод . Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
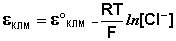
Хлорсеребряный электрод . В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
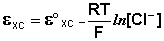
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод , относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
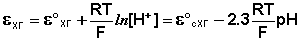
Стеклянный электрод , являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
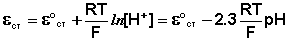
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe 3+ до Fe 2+ за счет электронов, полученных от платины, либо окисление ионов Fe 2+ до Fe 3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом . Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H + // Fe 3+ , Fe 2+ / Pt
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
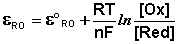
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
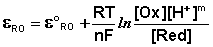
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe 3+ , Fe 2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления:
Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe 3+ , Fe 2+ , то на последнем будет протекать реакция восстановления и он будет являться катодом:
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Copyright © С. И. Левченков, 1996 — 2005.
http://sdamzavas.net/3-17814.html
http://physchem.chimfak.sfedu.ru/Source/PCC/Solutions_6.htm







