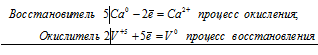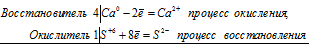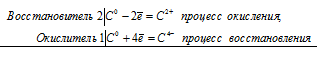Кальций: способы получения и химические свойства
Кальций Ca — это щелочноземельный металл, серебристо-белый, пластичный, достаточно твердый. Реакционноспособный. Сильный восстановитель.
Относительная молекулярная масса Mr = 40,078; относительная плотность для твердого и жидкого состояния d = 1,54; tпл = 842º C; tкип = 1495º C.
Способ получения
1. В результате электролиза жидкого хлорида кальция образуются кальций и хлор :
2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С образуя кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
3. В результате разложения гидрида кальция при температуре выше 1000º С образуется кальций и водород:
4. Оксид кальция взаимодействует с алюминием при 1200º С и образует кальций и алюминат кальция:
4CaO + 2Al = 3Ca + Ca(AlO2)2
Качественная реакция
Кальций окрашивает пламя газовой горелки в коричнево-красный цвет.
Химические свойства
1. Кальций — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция:
1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция:
2Ca + O2 = 2CaO
1.3. Кальций активно реагирует при температуре 200 — 400º С с хлором, бромом и йодом . При этом образуются соответствующие соли :
1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция:
1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция:
1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция:
Ca + S = CaS
1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция:
1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция:
Ca + 2C = CaC2
2. Кальций активно взаимодействует со сложными веществами:
2.1. Кальций при комнатной температуре реагирует с водой . Взаимодействие кальция с водой приводит к образованию гидроксида кальция и газа водорода:
2.2. Кальций взаимодействует с кислотами:
2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород :
Ca + 2HCl = CaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода:
2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород:
Для кальция составьте уравнения химических реакций с помощью которых можно осуществить цепочку превращений метал — основной оксид — основание — соль?
Химия | 5 — 9 классы
Для кальция составьте уравнения химических реакций с помощью которых можно осуществить цепочку превращений метал — основной оксид — основание — соль.
Ca — CaO — Ca(OH)2 — CaCO3
CaO + H2O = Ca(OH)2
Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH.
Составьте молекулярные уравнения реакций, с помощью которых можно осуществить превращения по следующей схеме :кальций — кальций гидроксид — кальция карбонат — кальций оксид — кальций хлорид — кальцийП?
Составьте молекулярные уравнения реакций, с помощью которых можно осуществить превращения по следующей схеме :
кальций — кальций гидроксид — кальция карбонат — кальций оксид — кальций хлорид — кальций
Составьте уравнения химических реакций, с помощью которых можно осуществить цепочку превращения этан — этилен — этиловый спирт — ацетальдегий?
Составьте уравнения химических реакций, с помощью которых можно осуществить цепочку превращения этан — этилен — этиловый спирт — ацетальдегий.
Составьте уравнения химических реакций, с помощью которых можно осуществить цепочку превращений?
Составьте уравнения химических реакций, с помощью которых можно осуществить цепочку превращений.
Метан — углекислый газ — глюкоза — этанол — этилен.
Напишите уравнение реакций , с помощью которых можно осуществить цепочку превращений веществ : кальций — > ; Оксид кальция — > ; гидроксид кальция — > ; нитрат кальция — > ; карбонат кальция -?
Напишите уравнение реакций , с помощью которых можно осуществить цепочку превращений веществ : кальций — > ; Оксид кальция — > ; гидроксид кальция — > ; нитрат кальция — > ; карбонат кальция — > ; оксид кальция — > ; силикат кальция.
Написать уравнение реакции, с помощью которого можно осуществить цепочку превращений вещества : Кальций — > ; Оксид кальция — > ; Гидроксид кальция — > ; Хлорид кальция?
Написать уравнение реакции, с помощью которого можно осуществить цепочку превращений вещества : Кальций — > ; Оксид кальция — > ; Гидроксид кальция — > ; Хлорид кальция.
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения : а) метан — ацителен — бензол — хлоробензол б) карбонат кальция — оксид кальция — карбид кальция — ацителен — бен?
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения : а) метан — ацителен — бензол — хлоробензол б) карбонат кальция — оксид кальция — карбид кальция — ацителен — бензол — нитробензол.
Дополните цепочку переходов?
Дополните цепочку переходов.
Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме :
Составьте уравнения химических реакций с помощью которых можно осуществить цепочку превращений этан — этилен — этиловый спирт — углекислый газ?
Составьте уравнения химических реакций с помощью которых можно осуществить цепочку превращений этан — этилен — этиловый спирт — углекислый газ.
Составьте уравнение химических реакций с помощью которых можно осуществить цепочку превращений СН4 — > ; С2Н2 — > ; С6Н6 — > ; С6Н5СI?
Составьте уравнение химических реакций с помощью которых можно осуществить цепочку превращений СН4 — > ; С2Н2 — > ; С6Н6 — > ; С6Н5СI.
S — SO2 — H2SO3 — Na2SO3 составить уравнение химической реакции с помощью которой можно осуществить цепочку превращений?
S — SO2 — H2SO3 — Na2SO3 составить уравнение химической реакции с помощью которой можно осуществить цепочку превращений.
Вы зашли на страницу вопроса Для кальция составьте уравнения химических реакций с помощью которых можно осуществить цепочку превращений метал — основной оксид — основание — соль?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
Ковалентная полярная молекула неметалла с кислотным остатком никак не может образовать ионную связь + неорганическое вещество.
1) 4 2) 2 3) 1 4) 1 5) 2 6) 2 7) 4 8) 2 9) 3 10) 11) 3 12) 2.
Молярная масса водорода — 2 г / моль в сосуде было 0, 24 / 2 = 0, 12 моль водорода молярная масса кислорода — 32 г / моль в сосуде было 4 / 32 = 0, 125моль кислорода молярная доля водорода составляет 0, 12 / (0, 12 + 0, 125) = 49, 0% молярная доля ки..
N(FeCl₂) = m(FeCl₂) / M(FeCl₂) n(FeCl₂) = 13 / 126, 75 = 0, 103 моль n(NaOH) = m(NaOH) / M(NaOH) n(NaOH) = 15 / 40 = 0, 375 моль хлорид железа прореагирует полностью FeCl₂ + 2NaOH = Fe(OH)₂↓ + 2NaCl гидроксид хлорид натрия железа (II) n(Fe(OH)₂) = n(..
2HCl + CaO — > CaCl2 + H2O (реакция обмена) ( образуется хлорид кальция и вода).
CaO + 2HCl = CaCl2 + H2O оксид кальция + соляная кислота = хлорид кальция + вода.
CH3 — CH2 — CН = CH — CH3 это пентен — 2.
А. Ba(OH)2 + CO2 = BaCO3 + H2O Б. Ba(OH)2 + P2O5 = Ba3(PO4)2 + H2O B. Ba(OH)2 + SO3 = BaSO4 + H2O Г. Ba(OH)2 + Cl2O7 = Ba(ClO4)2 + H2O.
HCl Cl — 1 Cl2O7 Cl + 7 NACL Cl — 1 HClo3 СL + 5.
Характеристика химических свойств кальция
Задание 337
Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция: а) с V2O5; б) СаSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
Благодаря большому отрицательному значению 
Уравнения реакций кальция:
5Ca 0 + 2V +5 = 5Ca 2+ + 2V 0
б) Ca + СаSO4 = CaO + CaS
4Ca 0 + S +6 = 4Ca 2+ + S 2-
4Са + CaSO4 = 4СаО + CaS
Задание 338
Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Решение:
СаО – оксид кальция называют «негашеная известь». Са(ОН)2 – гидроксид кальция называют «гашённая известь».
а) Оксид кальция получают при термическом разложении известняка СаСО3:
Этот процесс протекает при температуре 1000 0 С (промышленный метод получения СаО).
б) При спекании известняка и графита получают оксид кальция:
Гашённую известь получают при действии воды на оксид кальция:
При прокаливании негашеной извести с углём образуется карбид кальция:
СаО + 3С СаС2 + СО
2Ca 0 + С 0 = 2Ca 2+ + С 4-
Таким образом, углерод является и окислителем, и восстановителем в данной реакции. Эта реакция является реакцией самоокисления-самовосстановления (реакцией диспропорционирования, дисмутации), потому что протекает с одновременным уменьшением и увеличением степени окисления одного и того же элемента (С – уголь).
Задание 339
Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Решение:
http://himia.my-dict.ru/q/943074_dla-kalcia-sostavte-uravnenia-himiceskih-reakcij/
http://buzani.ru/zadachi/khimiya-shimanovich/977-svojstva-kaltsiya-zadachi-337-339