Для нахождения волновой функции используют уравнение
Важным этапом в создании квантовой механики явилось обнаружение волновых свойств микрочастиц. Идея о волновых свойствах была первоначально высказана как гипотеза французским физиком Луи де Бройлем.
В физике в течение многих лет господствовала теория, согласно которой свет есть электромагнитная волна. Однако после работ Планка (тепловое излучение), Эйнштейна (фотоэффект) и других стало очевидным, что свет обладает корпускулярными свойствами.
Чтобы объяснить некоторые физические явления, необходимо рассматривать свет как поток частиц-фотонов. Корпускулярные свойства света не отвергают, а дополняют его волновые свойства.
Итак, фотон-элементарная частица света, обладающая волновыми свойствами.
Логично считать, что и другие частицы-электроны, нейтроны- обладают волновыми свойствами.
Формула для импульса фотона
была использована для других микрочастиц массой m, движущихся со скоростью v:
По де Бройлю, движение частицы, например, электрона, подобно волновому процессу с длиной волны λ , определяемой формулой (4.4.3). Эти волны называют волнами де Бройля . Следовательно, частицы (электроны, нейтроны, протоны, ионы, атомы, молекулы) могут проявлять дифракционные свойства.
К.Дэвиссон и Л.Джермер впервые наблюдали дифракцию электронов на монокристалле никеля.
Может возникнуть вопрос: что происходит с отдельными частицами, как образуются максимумы и минимумы при дифракции отдельных частиц?
Опыты по дифракции пучков электронов очень малой интенсивности, то есть как бы отдельных частиц, показали, что при этом электрон не «размазывается» по разным направлениям, а ведет себя как целая частица. Однако вероятность отклонения электрона по отдельным направлениям в результате взаимодействия с объектом дифракции различная. Наиболее вероятно попадание электронов в те места, которые по расчету соответствуют максимумам дифракции, менее вероятно их попадание в места минимумов. Таким образом, волновые свойства присущи не только коллективу электронов, но и каждому электрону в отдельности.
4.4.2. Волновая функция и ее физический смысл
Так как с микрочастицей сопоставляют волновой процесс, который соответствует ее движению, то состояние частиц в квантовой механике описывается волновой функцией, зависящей от координат и времени: .
Если силовое поле, действующее на частицу, является стационарным, то есть не зависящим от времени, то ψ-функцию можно представить в виде произведения двух сомножителей, один из которых зависит от времени, а другой от координат:
В дальнейшем будем рассматривать только стационарные состояния; ψ-функция является вероятностной характеристикой состояния частицы. Поясним смысл этого утверждения.
Выделим в пространстве достаточно малый объем dV=dxdydz, в пределах которого значения ψ-функции можно считать одинаковыми. Вероятность нахождения dW в частицы в этом объеме пропорциональна объему и зависит от квадрата модуля ψ -функции:
Отсюда следует физический смысл волновой функции:
Квадрат модуля волновой функции равен плотности вероятности, то есть отношению вероятности нахождения частицы в объеме к этому объему .
Интегрируя выражение (4.4.5) по некоторому объему V, находим вероятность нахождения частицы в этом объеме:
4.4.3. Соотношение неопределенностей
Одним из важных положений квантовой механики являются соотношения неопределенностей, предложенные В.Гейзенбергом.
Пусть одновременно измеряют положение и импульс частицы, при этом неточности в определениях абсциссы и проекции импульса на ось абсцисс равны соответственно Δx и Δр x .
В классической физике нет каких-либо ограничений, запрещающих с любой степенью точности одновременно измерить как одну, так и другую величину, то есть Δx→0 и Δр x→ 0.
В квантовой механике положение принципиально иное: Δx и Δр x , соответствующие одновременному определению x и р x , связаны зависимостью
Таким образом, чем точнее определена координата x (Δx→0), тем не менее точно определена проекция р x (Δp x→ ± ), и наоборот. Аналогично,
Формулы (4.4.8), (4.4.9) называют соотношениями неопределенностей .
Поясним их одним модельным экспериментом.
При изучении явления дифракции было обращено внимание на то, что уменьшение ширины щели при дифракции приводит к увеличению ширины центрального максимума. Аналогичное явление будет и при дифракции электронов на щели в модельном опыте. Уменьшение ширины щели означает уменьшение Δ x (рис. 4.4.1), это приводит к большему «размазыванию» пучка электронов, то есть к большей неопределенности импульса и скорости частиц.
Рис. 4.4.1.Пояснение к соотношению неопределенности.
Соотношение неопределенностей можно представить в виде
где ΔE — неопределенность энергии некоторого состояния системы; Δt -промежуток времени, в точение которого оно существует. Соотношение (4.4.10) означает, что чем меньше время существования какого-либо состояния системы, тем более неопределенно его значение энергии. Энергетические уровни Е 1 , Е 2 и т.д. имеют некоторую ширину (рис.4.4.2)), зависящую от времени пребывания системы в состоянии, соответствующем этому уровню.
Рис. 4.4.2.Энергетические уровни Е 1 , Е 2 и т.д. имеют некоторую ширину.
«Размытость» уровней приводит к неопределенности энергии ΔE излучаемого фотона и его частоты Δν при переходе системы с одного энергетического уровня на другой:
Это проявляется в уширении спектральных линий.
4.4.4.Уравнение Шредингера
Так как состояние микрочастицы описывают ψ -функцией, то надо указать способ нахождения этой функции с учетом внешних условий. Это возможно в результате решения основного уравнения квантовой механики, предложенного Шредингером. Такое уравнение в квантовой механике постулируется так же, как в классической механике постулируется закон Ньютона.
Применительно к стационарным состояниям уравнение Шредингера может быть записано так:
где m- масса частицы; ; Е и Е n –ее полная и потенциальная энергии (потенциальная энергия определяется силовым полем, в котором находится частица, и для стационарного случая не зависит от времени)
Если частица перемещается только вдоль некоторой линии, например вдоль оси ОХ (одномерный случай), то уравнение Шредингера существенно упрощается и принимает вид
Одним из наиболее простых примеров на использование уравнения Шредингера является решение задачи о движении частицы в одномерной потенциальной яме.
4.4.5. Применение уравнения Шредингера к атому водорода. Квантовые числа
Описание состояний атомов и молекул с помощью уравнения Шредингера является достаточно сложной задачей. Наиболее просто она решается для одного электрона, находящегося в поле ядра. Такие системы соответствуют атому водорода и водородоподобным ионам (однократно ионизированный атом гелия, двукратно ионизированный атом лития и т.п.). Однако и в этом случае решение задачи является сложным, поэтому ограничимся лишь качественным изложением вопроса.
Прежде всего в уравнение Шредингера (4.4.12) следует подставить потенциальную энергию, которая для двух взаимодействующих точечных зарядов – e (электрон) и Ze (ядро), — находящихся на расстоянии r в вакууме, выражается следующим образом:
Состояние электрона в атоме характеризуется не одним, а несколькими квантовыми числами.
Первое из них — главное квантовое число n =1, 2, 3, . Оно определяет уровни энергии электрона по закону
Это выражение является решением уравнения Шредингера и полностью совпадает с соответствующей формулой теории Бора (4.2.30)
На рис.4.4.3 показаны уровни возможных значений полной энергии атома водорода (Е 1 , Е 2 , Е 3 и т.д.) и график зависимости потенциальной энергии Е n от расстояния r между электроном и ядром. С возрастанием главного квантового числа n увеличивается r (см.4.2.26), а полная (4.4.15) и потенциальная энергии стремятся к нулю. Кинетическая энергия также стремится к нулю. Заштрихованная область (Е>0) соответствует состоянию свободного электрона.
Рис. 4.4.3. Показаны уровни возможных значений полной энергии атома водорода
и график зависимости потенциальной энергии от расстояния r между электроном и ядром.
Второе квантовое число – орбитальное l , которое при данном n может принимать значения 0, 1, 2, …., n-1. Это число характеризует орбитальный момент импульса L i электрона относительно ядра:
Третье квантовое число – магнитное m l , которое при данном l принимает значения 0, ±1, ± 2, …, ±l; всего 2l+1 значений. Это число определяет проекции орбитального момента импульса электрона на некоторое произвольно выбранное направление Z:
Четвертое квантовое число – спиновое m s . Оно может принимать только два значения (±1/2) и характеризует возможные значения проекции спина электрона:
Состояние электрона в атоме с заданными n и l обозначают следующим образом: 1s, 2s, 2p, 3s и т.д. Здесь цифра указывает значение главного квантового числа, а буква – орбитальное квантовое число: символам s, p, d, f, соответствуют значения l=0, 1, 2. 3 и т.д.
© ФГОУ ВПО Красноярский государственный аграрный университет, 2015
Соотношение неопределенности, волновая функция, излучение и поглощение энергии
Конспект лекции
Аннотация: знакомство с границами применимости классической физики, уравнением Шредингера. Традиционное изложение темы.
В первой четверти XX-го века получены экспериментальные свидетельства двойственности свойств материи: электромагнитное излучение проявляет свойства частиц (фотоэффект, комптоновское рассеяние, . ), а частицы демонстрируют волновые свойства (эффект Рамзауэра, туннельный эффект, . ).
Но свойства волн и частиц в известной степени противоположны.
| Частицы | Волны |
|---|---|
| Энергия и импульс локализованы | Переносят энергию, распределенную по фронту волны |
| Сложение по правилу: частицы + частицы => больше частиц | Интерференция лучей: больше в одном месте и меньше в другом |
| Отбрасывают резкую тень | Огибают препятствия |
| При наличии щелей частица проходит через одну из них | Проходят через любое число отверстий |
Нет подходящих образов, чтобы представить существование волновых и корпускулярных свойств у одного объекта. Нельзя все свойства волн и все свойства частиц приписать одному объекту. Необходимо внести некоторые ограничения в применении к объектам микромира понятий классической физики. Корпускулярно-волновая двойственность свойств частиц, изучаемых в квантовой механике, приводит к тому, что в ряде случаев оказывается невозможным, в классическом смысле, одновременно характеризовать частицу ее положением в пространстве (координатами) и скоростью (или импульсом). В 1927 году немецкий физик Вернер Гейзенберг сформулировал принцип неопределенности, названный теперь его именем. Он может быть записан в следующем виде

Здесь Δx — неопределенность координаты x, Δp — неопределенность импульса, ħ — постоянная Планка, деленная на 2π (h = 6.62·10 -34 Дж·с). Выражение (1) следует понимать так, что если мы точно задаем координату частицы (Δx → 0), то ничего не можем сказать о величине импульса (Δp → ∞). Одновременно точно задать координату и импульс микрочастицы невозможно. Для иллюстрации рассмотрим опыт по дифракции электронов на щели. Прямой опыт Йенсона (см. лекцию) показал, что за щелью распределение интенсивности электронов будет иметь вид, показанный на рис.1. 
Отклонение электрона от первоначального направления означает получение им приращения импульса Δp. Ширина щели служит мерой неопределенности положения электрона (электрон проник в щель, в какой точке щели это произошло, неизвестно). Из опыта известно, что при уменьшении ширины щели дифракционная картина уширяется. Т.е., если Δx уменьшается, Δp растет, как это предсказывает соотношение (1).
Принцип неопределенности не мешает нам с любой желаемой точностью измерить каждую из величин, входящих в соотношение. Он утверждает лишь, что мы не в состоянии достоверно узнать и то, и другое одновременно. Неравенства (1) и (2) представляют собой ограничения применимости понятий классической механики.
Оценим количественную сторону ограничений на трех примерах.
- Молекула в стакане.
Массы молекул имеют порядок 10 -27 кг. Пусть стакан имеет размер
10 -1 м. Эту величину возьмем в качестве неопределенности координаты Δx. Тогда для неопределенности скорости получим

Чрезвычайно малое значение Δv в сравнение со скоростью молекул (при комнатной температуре порядка 500 м/с) приводит к выводу об отсутствии ограничений на классическое рассмотрение движения молекул в этом случае.
Электрон в атоме.
10 -30 кг, размер атома
10 -10 м. Для неопределенности скорости получим

И поскольку эта величина Δv сравнима со скоростью электронов в атоме, соотношение неопределенностей играет решающую роль, игнорировать волновые свойства электрона никак нельзя.
Луч осциллографа.
Скажутся ли волновые свойства электрона на работе осциллографа? Пусть радиус луча на экране очень качественного осциллографа равен r = 10 мкм, длина трубки L
10 -1 м. Тогда относительное изменение импульса Δp/p = r/L = 10 -4 . Импульс электрона определим, задав напряжение на трубке U, равным 10 кВ

Неопределенность импульса тогдаΔp
6·10 -27 , а неопределенность координаты
что существенно меньше размера пятна на экране. Т.е. пользоваться осциллографом можно, не задумываясь о волновых свойствах электронов.
Приведем один пример использования соотношения неопределенностей для оценки физических величин. Исходим из того, что неопределенность, например, импульса — это минимальное значение импульса, которое что-то значит.
Покажем, что в существующих ядрах не могут находиться электроны. За неопределенность координаты возьмем радиус ядра r, тогда
Размеры ядер имеют порядок 10 -14 м, электрон с таким импульсом — ультрарелятивистский, его энергия много больше энергии покоя, и последней можно пренебречь в оценках. Имеем E = p·c (как для фотонов). Для того чтобы электрон находился в ядре, его кинетическая энергия должна быть меньше потенциальной энергии (энергии взаимодействия с заряженным шаром, которым представляем ядро). Получаем
Ядер с таким большим атомным номером не существует. Точное решение задачи с нахождением волновой функции показывает отсутствие связанного состояния для электрона в потенциальной яме, которой представляется ядро.
Другая важная пара связанных физических величин – энергия Е и время t. Соотношение неопределённостей для них имеет вид

Если под величиной Δt понимать среднее время жизни атома в возбужденном состоянии, то энергия этого состояния определена с точностьюΔE. В основном состоянии атом может находиться без внешних воздействий бесконечно долгое время: Δt = ∞. Тогда ΔE = 0, то есть в основном состоянии энергия атома является строго определенной величиной. Однако каждый возбужденный уровень энергии имеет конечную ширину, которая определяется временем жизни атома в этом состоянии. Вследствие этого длина волны испускаемого кванта при переходе из возбужденного состояния не будет однозначной, спектральная линия излучающего атома имеет конечную ширину. Говорят о естественной ширине линии. Ширина спектральной линии определяется шириной уровней энергии, между которыми происходит переход. Обычно ширина уровней энергии очень мала. Например, для переходов с излучением в видимой части спектра (время жизни атома в возбужденном состоянии
Соотношение (2) допускает рождение на короткое время с последующим исчезновением частиц (их называют виртуальными (возможными) частицами). Их время жизни очень мало — порядка 10 -21 — 10 -24 с. Это объясняет, почему в вакууме постоянно присутствуют кванты различных полей. Отдельные виртуальные частицы нельзя обнаружить в принципе, но их суммарное воздействие на обычные микрочастицы обнаруживается экспериментально. В опыте У.Лэмба и Р.Ризерфорда (1947 г.) при исследовании спин-орбитального расщепления (см. лекцию) 2p уровня атома водорода обнаружено не только ожидаемое расщепление энергий состояний 2p3/2 и 2p1/2, но и отличие энергий 2s1/2 и 2p1/2 состояний. Это отличие обусловлено, как выяснилось позднее, во-первых, испусканием и поглощением связанным электроном виртуальных фотонов, что приводит к изменению эффективной массы электрона и возникновению у него аномального магнитного момента, и, во-вторых, возможностью виртуального рождения и аннигиляции в вакууме электронно-позитронных пар, что искажает кулоновский потенциал ядра. Лэмбовский сдвиг оказался первым физическим эффектом, на котором подтвердилась правильность квантовой электродинамики.
Волновая функция
Наличие волновых свойств у микрочастицы показывает, что ей (микрочастице) следует сопоставить некоторое волновое поле (аналог знакомых нам электрического, магнитного, гравитационного полей). Амплитуду этого волнового поля, зависящую от координат и времени, принято называть волновой функцией 
величина 
Вспомним опыт с пропусканием электронов через щель. Куда попадет данный конкретный электрон — дело случая. После пропускания малого числа электронов картина похожа на мишень плохого стрелка. Поведение электрона должно описываться некоторой вероятностной функцией. И эта функция должна быть связана со свойствами волнового поля, т.к. итог большого числа попаданий электронов — вполне четкая картина дифракционных полос. Совместить случайный характер попадания электрона в данное место с его волновыми свойствами можно, лишь допустив, что вероятность попадания электрона в данную точку пропорциональна интенсивности волнового поля, т.е. квадрату амплитуды |Ψ| 2 . |Ψ| 2 имеет смысл плотности вероятности. С помощью волновой функции можно рассчитать все измеряемые физические характеристики системы частиц. Например, среднее расстояние электрона от ядра
Свойства волновой функции:
- самое главное — сама амплитуда Ψ(x,y,z,t) непосредственного физического смысла не имеет; только |Ψ| 2 — плотность вероятности;
- волновая функция может быть комплексной (так чаще всего и бывает);
- умножение волновой функции на постоянную величину не изменяет физического состояния частицы, которая она описывает (распределение вероятности в пространстве и во времени не изменится; во сколько раз частицу чаще можно встретить в одной точке, чем в другой, во столько же раз и после умножения);
- волновая функция должна быть непрерывной и однозначной;
- непрерывной должна быть и первая производная по координате, так как через нее определяется импульс частицы;
- волновая функция не должна обращаться в бесконечность;
- обычно волновую функцию нормируют так ,что
т.е. вероятности достоверного события.
Уравнение Шредингера
Уравнение, решением которого является волновая функция, получено австрийским физиком Э.Шредингером
- m — масса частицы;
- Ψ(x,y,z,t) — волновая функция;
- ħ — постоянная Планка, деленная на π2;
— оператор Лапласа;
- U(x,y,z,t) — потенциальная энергия;
- i — мнимая единица.
Это уравнение применимо только для нерелятивистских частиц, у которых масса не зависит от скорости.
Для многих задач уравнение Шредингера можно упростить, исключив зависимость от времени. Это так называемые стационарные задачи. Пусть потенциальная энергия зависит только от координат U = U(x,y,z). Будем искать решение в виде произведения двух функций, зависящих одна от координат, а другая от времени: Ψ(x,y,z,t) = ψ(x,y,z)·φ(t). Поставим это выражение в уравнение и вынесем из-под знаков дифференцирования сомножители, не зависящие от соответствующих переменных
Разделим получившееся уравнение на ψ(x,y,z)·φ(t). Теперь левая часть зависит только от координат, а правая от времени. Поскольку обе части равны между собой, то остается единственная возможность: каждая из них равна одной и той же константе. Обозначим эту константу -E (E, как будет видно, — полная энергия частицы).
Теперь имеем два уравнения: первое для функции ψ(x,y,z)
Это так называемое стационарное уравнение Шредингера. Второе, которое легко решается, для временной части
Итак, для стационарного случая имеем два дифференциальных уравнения. Многочисленные эксперименты подтверждают выводы, вытекающие из решения уравнения Шредингера. На этом основана наша уверенность в справедливости этого уравнения.
В 1933г. Эрвину Шредингеру присуждена Нобелевская премия:
E RWIN S CHRODINGER for the discovery of new productive forms of atomic theory.
(за открытие новых продуктивных форм атомной теории)
Решение уравнения Шредингера для свободной частицы
Для понимания природы явлений в микромире обычно достаточно решить одномерную задачу. Этим мы и займемся. Для свободной частицы U(x) = 0, и уравнение Шредингера имеет вид

Имеем дифференциальное уравнение второго порядка с посто39янными коэффициентами. Его решение, используя характеристическое уравнение, получаем в виде

Теперь добавим множитель φ(t), зависящий от времени (см. выше)

Если учесть, что E/ħ = ω, получили уравнение волны с фазой kx-ωt в первом слагаемом и -kx-ωt во втором. Если фазу зафиксировать, то точка с постоянной фазой движется в направлении x для первого слагаемого (x растет с увеличением t), и в противоположном для второго. Первое слагаемое описывает движение частицы в направлении x, второе — против x.
Выражение (4) однозначно, конечно и имеет смысл при любых значениях энергии E. Энергия свободной частицы может принимать любое значение, т.е. ее энергетический спектр является непрерывным.
Этой волне соответствует не зависящая от времени вероятность обнаружить частицу в данной точке пространства. Действительно, выбирая для простоты волну, распространяющуюся в положительном направлении x, имеем |Ψ| 2 = Ψ·Ψ * = |A| 2 .
И напоследок получим соотношение между импульсом p и энергией E свободной частицы. Вспоминая выражение для длины волны де Бройля, для волнового числа k получим

Возведя это выражение в квадрат и приравняв к равенству для k 2 (3), получим
что совпадает с классическим соотношением.
Тождественность частиц. Бозоны и фермионы. Принцип Паули.
Проделаем опыт по изучению углового распределения упруго рассеянных α-частиц на ядрах углерода 12 C: α + 12 C → α + 12 C. 
Но может быть (рисунок 2б) α-частица рассеялась на угол π — θ и попадает в детектор 2. Этот процесс описывается функцией Ψ(π — θ). Детекторы 1 и 2 включены в схему совпадений, и событие считается зарегистрированным, когда в каждый детектор попадет по частице.
Можно ли сделать детектор, различающий α-частицы и ядра углерода? Отвечаем «да», и случаи 1а и 1б различны. Измеряемая величина — доля частиц, рассеянных на данный угол. В случае а) она пропорциональна |Ψ(θ)| 2 , а в случае б) — |Ψ(π — θ)| 2 . А если детектор не различает частицы (например, счетчик Гейгера), тогда вероятность опыта пропорциональна
Состояния в принципе различны и складываются вероятности.
А при рассеянии α-частиц на ядрах гелия: α + 4 He → α + 4 He (α-частица — это и есть ядро гелия!)? Тут взаимодействуют тождественные частицы, и экспериментальные результаты не согласуются с формулой (5). Полная неразличимость частиц приводит к интерференции рассеянных волн. В этом случае складываются амплитуды
Если подсчитать по этим формулам вероятности для угла θ = π/2, то вероятности 2|Ψ(π/2)| 2 и |2·Ψ(π/2)| 2 = 4·|·Ψ(π/2)| 2 отличаются в два раза. Ошибиться тут нельзя. Опыт согласуется со вторым значением: для неразличимых частиц складываются амплитуды.
А как обстоит дело с электронами? Электроны в отличие от α-частиц имеют спин (собственный момент количества движения), который может иметь два направления. Если спины взаимодействующих электронов направлены одинаково, то это тождественные частицы, но ни (5), ни (6) неверно. Для них складываются амплитуды в противофазе:
Если спины электронов имеют противоположные направления, детектором можно определить, какой электрон попал в детектор, и складываются вероятности (5).
Приходим к выводу: тождественность микрочастиц существенна при описании взаимодействия этих частиц.
Электроны тождественны, и перестановка двух любых экспериментально обнаружена быть не может: возможны переходы, ведущие к неразличимым экспериментально состояниям.
| макрофизика | физика микрочастиц |
|---|---|
| можно пронумеровать частицы, наблюдать за движением определенной | понятие траектории не имеет смысла, теряет смысл и различие частиц. Обозначим волновую функцию, описывающую состояние двух частиц, через Ψ(x1,x2). Здесь x1 — координата первой частицы, x2 — второй. Подействуем на эту функцию оператором перестановки двух частиц местами Но начальное и конечное состояния ввиду тождественности частиц неразличимы, и поэтому волновые функции могут отличаться только постоянным сомножителем. Подействуем этим оператором еще раз и вернемся к исходной волновой функции Получаем a = ± 1. Волновые функции либо меняют знак при перестановке частиц либо нет Спины фермионов полуцелые: 1/2ħ, 3/2ħ. Для фермионов действует принцип Паули: в одном и том же квантовом состоянии не может быть одновременно более одного фермиона, например, электрона. Это утверждение впервые было сформулировано Вольфгангом Паули в 1925 г. Полное обобщённое доказательство этого принципа было им сделано в 1940 г. в рамках квантовой теории поля. Определенное квантовое состояние задается набором квантовых чисел. Например, для атома водорода это четыре числа. |
В 1945г. Вольфгангу Паули присуждена Нобелевская премия:
W OLFGANG P AULI for the discovery of the Exclusion Principle, also called the Pauli Principle.
(за открытие принципа запрета, названного принципом Паули)
Вычисление средних значений
Если известна волновая функция Ψ(x), то можно вычислить значение физических величин, характеризующих данную задачу. Как упоминалось, |Ψ(x)| 2 dx — дает долю частиц, находящихся между x и x + dx. Тогда среднее значение x
Аналогично надо поступить и любых функций координаты x. Например, среднее значение потенциальной энергии U(x) равно
По-другому вычисляется средняя кинетическая энергия, которая зависит не от координаты x, а от импульса. Приведем формулу
Можно проверить последнее выражение для частного случая n = 1 в прямоугольной бесконечно глубокой потенциальной яме
что совпадает со значением полной энергии E в основном состоянии, т.к. потенциальная энергия U полагалась равной нулю.
Излучение и поглощение энергии
Чтобы выяснить, излучает ли система, содержащая заряженную частицу, надо вычислить среднее значение координаты. Если среднее значение x колеблется с частотой ν, то согласно законам электродинамики надо ожидать испускания или поглощения излучения такой частоты.
Используем волновую функцию частицы в состоянии с квантовым числом n и энергией En —
Оказывается, если частица находится в определенном энергетическом состоянии, среднее значение x не зависит от времени, и излучения нет. В 1913 году Нильс Бор для объяснения закономерности линейчатого спектра атома водорода постулировал, что атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает. Этот постулат находился в явном противоречии с классической механикой. 
Теперь рассмотрим систему, в которой есть два состояния с квантовыми числами n, m и соответствующими им энергиями En и Em (рис.3). Принцип суперпозиции в квантовой механике заключается в следующем: если квантовая система может находиться в состояниях, описываемых волновыми функциями Ψn и Ψm, то она может находиться и в состоянии, описываемом волновой функцией
где a и b — произвольные коэффициенты. Наблюдая испускание излучения при возвращении в основное состояние n, можно заключить, что система была в состоянии m (т.е. a = 0, b = 1) в какой-то момент времени. Найдем среднее значение x для функции (8).
В подынтегральном выражении слагаемые с произведениями Ψ * n·Ψn и Ψ * m·Ψm приводят, как мы видели, к стационарным значениям x и не вызывают излучение или поглощение. Поэтому нас будут интересовать перекрестные произведения
Получили, что среднее положение частицы представляет собой периодическую функцию времени, умноженную на некоторое число (определенный интеграл по x). Поэтому получаются колебания заряда, и, следовательно, излучение с частотой
Таким образом, квантовая механика объясняет существование линейчатых спектров и обосновывает вторую гениальную догадку Н.Бора: испускание или поглощение фотонов происходит только с частотами, удовлетворяющими равенству hν = Em — En.
Теперь заметим, что колебаний заряда не будет, если интеграл В (9) равен нулю
Когда это бывает? В лекции о квантовом гармоническом осцилляторе выписаны волновые функции основного и первых двух возбужденных состояний. Для перехода m = 1 → n = 0 этот интеграл (опуская постоянные коэффициенты)
т.к. под интегралом четная функция. Аналогично для перехода m = 2 → n = 1
функция под интегралом четная и интеграл нулю не равен. Переходы m = 1 → n = 0 и m = 2 → n = 1 разрешены и сопровождаются излучением кванта.
Теперь проанализируем переход m = 2 → n = 0.
т.к. под интегралом нечетная функция. Такой переход запрещен. Детальный анализ волновых функций гармонического осциллятора показывает, что возможны только переходы, при которых квантовое число обязательно меняется на единицу Δn = ±1. Это так называемое правило отбора. Для водородоподобных атомов правила отбора будут свои.
Квантовая механика объясняет основные характеристики испускания и поглощения света.
Если возникли какие-либо вопросы, напишите мне.
Волновая функция
Вы будете перенаправлены на Автор24
В соответствии с корпускулярно — волновым дуализмом в квантовой физике состояние частицы описывается при помощи волновой функции ($\psi (\overrightarrow
Волновая функция — это функция, которая используется в квантовой механике. Она описывает состояние системы, которая имеет размеры в пространстве. Она является вектором состояния.
Данная функция является комплексной и формально имеет волновые свойства. Движение любой частицы микромира определено вероятностными законами. Распределение вероятности выявляется при проведении большого числа наблюдений (измерений) или большого количества частиц. Полученное распределение аналогично распределению интенсивности волны. То есть в местах с максимальной интенсивностью отмечено максимальное количество частиц.
Набор аргументов волновой функции определяет ее представление. Так, возможно координатное представление: $\psi(\overrightarrow
,t)$ и т.д.
В квантовой физике целью ставится не точность предсказания события, а оценка вероятности того или иного события. Зная величину вероятности, находят средние значения физических величин. Волновая функция позволяет находить подобные вероятности.
Так вероятность присутствия микрочастицы в объеме dV в момент времени t может быть определена как:
где $\psi^*$- комплексно сопряженная функция к функции $\psi.$ Плотность вероятности (вероятность в единице объёма) равна:
Вероятность является величиной, которую можно наблюдать в эксперименте. В это же время волновая функция не доступна для наблюдения, так как она является комплексной (в классической физике параметры, которые характеризуют состояние частицы, доступны для наблюдения).
Условие нормировки $\psi$- функции
Волновая функция определена с точностью до произвольного постоянного множителя. Данный факт не оказывает влияния на состояние частицы, которую $\psi$- функция описывает. Однако волновую функцию выбирают таким образом, что она удовлетворяет условию нормировки:
Готовые работы на аналогичную тему
где интеграл берут по всему пространству или по области, в которой волновая функция не равна нулю. Условие нормировки (2) значит то, что во всей области, где $\psi\ne 0$ частица достоверно присутствует. Волновую функцию, которая подчинятся условию нормировки, называют нормированной. Если $<\left|\psi\right|>^2=0$, то данное условие означает, что частицы в исследуемой области наверняка нет.
Нормировка вида (2) возможна при дискретном спектре собственных значений.
Условие нормировки может оказаться не осуществимым. Так, если $\psi$ — функция является плоской волной де-Бройля и вероятность нахождения частицы является одинаковой для всех точек пространства. Данные случаи рассматривают как идеальную модель, в которой частица присутствует в большой, но имеющей ограничения области пространства.
Принцип суперпозиции волновой функции
Данный принцип является одним их основных постулатов квантовой теории. Его смысл в следующем: если для некоторой системы возможны состояния, описываемые волновыми функциями $\psi_1\ <\rm и>\ $ $\psi_2$, то для этой системы существует состояние:
где $C_<1\ >и\ C_2$ — постоянные коэффициенты. Принцип суперпозиции подтверждается эмпирически.
Можно говорить о сложении любого количества квантовых состояний:
где $<\left|C_n\right|>^2$ — вероятность того, что система обнаруживается в состоянии, которое описывается волновой функцией $\psi_n.$ Для волновых функций, подчиненных условию нормировки (2) выполняется условие:
Стационарные состояния
В квантовой теории особую роль имеют стационарные состояния (состояния в которых все наблюдаемые физические параметры не изменяются во времени). (Сама волновая функция принципиально не наблюдаема). В стационарном состоянии $\psi$- функция имеет вид:
где $\omega =\frac
Из физических свойств стационарных состояний следуют математические требования к волновой функции $\psi\left(\overrightarrow
Математические требования к волновой функции для стационарных состояний
$\psi\left(\overrightarrow
Если потенциальная энергия имеет поверхность разрыва, то на подобных поверхностях функция $\psi\left(\overrightarrow
Решение:
Запишем условие нормировки для нашего случая в виде:
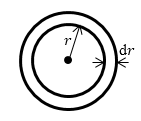
где $dV=4\pi r^2dr$ (см.рис.1 Из условий понятно, что задача обладает сферической симметрией). Из условий задачи имеем:
Подставим $dV$ и волновые функции (1.2) в условие нормировки:
Проведем интегрирование в левой части:
Из формулы (1.4) выразим искомый коэффициент:
Задание: Каково наиболее вероятное расстояние ($r_B$) электрона от ядра, если волновая функция, которая описывает основное состояние электрона в атоме водорода может быть определена как: $\psi=Ae^<-
Решение:
Используем формулу, которая определяет вероятность присутствия микрочастицы в объеме $dV$ в момент времени $t$:
где $dV=4\pi r^2dr.\ $Следователно, имеем:
В таком случае, $p=\frac
Для определения наиболее вероятного расстояния производную $\frac
Ответ: $r_B=a.$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 06 05 2021
http://teachmen.csu.ru/work/lectureWaveFunction/index.html
http://spravochnick.ru/fizika/predmet_i_zadachi_atomnoy_fiziki/volnovaya_funkciya/






 — оператор Лапласа;
— оператор Лапласа;