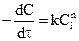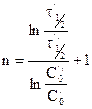Нормальное (нормированное) уравнение прямой: описание, примеры, решение задач
В данной статье рассмотрим нормальное уравнение прямой на заданной плоскости. Получим нормальное уравнение, покажем не примере, дадим определение нормирующего множителя и разберем приведение общего уравнения к нормальному виду. Заключительной части посвятим основному приложению нормального уравнения прямой, то есть нахождение расстояние от точки до прямой на плоскости.
Нормальное уравнение прямой – описание и пример
Рассмотрим выведение нормального уравнения.
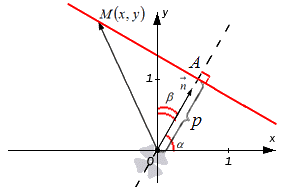
Фиксируем на плоскости систему координат О х у , где задаем прямую с точкой, через которую она проходит с нормальным вектором прямой. Нормальному вектору прямой дадим обозначение n → . Его начало обозначено точкой O . координатами являются cos α и cos β , углы которых расположены между вектором n → и положительными осями О x и O y . Это запишется так: n → = ( cos α , cos β ) . Прямая проходит через точку A с расстоянием равным p , где p ≥ 0 от начальной точки O при положительном направлении вектора n → . Если р = 0 , тогда A считается совпадающей с точкой координат. Отсюда имеем, что O A = p . Получаем уравнение, при помощи которого задается прямая.
Имеем, что точка с координатами M ( x , y ) расположена на прямой тогда и только тогда, когда числовая проекция вектора O M → по направлению вектора n → равняется p , значит при выполнении условия n p n → O M → = p .
O M → является радиус-вектором точки с координатами M ( x , y ) , значит O M → = ( x , y ) .
Применив определение скалярного произведения векторов, получим равенство вида: n → , O M → = n → · n p n → O M → = 1 · n p n → O M → = n p n → O M → = p
Тогда это же произведение будет иметь вид в координатной форме: n → , O M → = cos α · x + cos β · y
Отсюда cos α · x + cos β · y = p или cos α · x + cos β · y — p = 0 . Было выведено нормальное уравнение прямой.
Уравнение вида cos α · x + cos β · y — p = 0 называется нормальным уравнением прямой или нормированным уравнением прямой. Иначе говоря, уравнение прямой в нормальном виде.
Понятно, что такое уравнение представляет собой общее уравнение прямой A x + B y + C = 0 , где A и B имеют значения, при которых длина вектора n → = ( A , B ) равна 1 , а C является неотрицательным числом.
Теперь рассмотрим его геометрический смысл. Нормальное уравнение прямой вида cos α · x + cos β · y — p = 0 задает в системе координат О х у на плоскости прямую с наличием нормального вектора единичной длины n → = ( cos α , cos β ) , которая располагается на расстоянии равном p от начала координат по положительному направлению вектора n → .
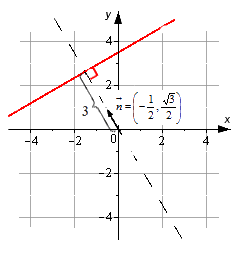
Если дано уравнение прямой вида — 1 2 · x + 3 2 · y — 3 = 0 , то на плоскости задается прямая, у которой нормальный вектор с координатами — 1 2 , 3 2 . Удаление прямой от начала координат идет по направлению, совпадающему с направлением нормального вектора n → = — 1 2 , 3 2 .
Приведение общего уравнения прямой к нормальному виду
Часто решение задач подразумевает использование нормального уравнения прямой, но само оно не дается в нормальном виде, поэтому необходимо для начала приводить к нормальному виду, после чего выполнять необходимые вычисления.
Нормальное уравнение получают из общего уравнения прямой. Когда на плоскости задается другим уравнением, то необходимо привести его к общему виду, после чего возможно приведение к нормальному. Если рассмотреть на примере, то это будет выглядеть так.
Для приведения общего уравнения прямой A x + B x + C = 0 к нормальному необходимо обе части умножить на нормирующий множитель, который имеет значение ± 1 A 2 + B 2 . Его знак определяется при помощи противоположности знака слагаемого C . При С = 0 знак выбирается произвольно.
Привести уравнение прямой 3 x — 4 y — 16 = 0 к нормальному виду.
Из общего уравнения видно, что А = 3 , В = — 4 , С = — 16 . Так как значение C отрицательное, необходимо брать положительный знак для формулы. Перейдем к вычислению нормирующего множителя:
1 A 2 + B 2 = 1 3 2 + ( — 4 ) 2 = 1 5
Теперь необходимо умножить обе части уравнения на одну пятую. Получим, что 1 5 · ( 3 x — 4 y — 16 ) = 0 ⇔ 3 5 · x — 4 5 · y — 16 5 = 0 .
Нормальное уравнение по заданной прямой найдено.
Ответ: 3 5 · x — 4 5 · y — 16 5 = 0 .
Определение состава и константы нестойкости одноядерного комплекса потенциометрическим методом
Пусть в результате реакции комплексообразования
Ме n + + pX — B =MeXp n — pB (1)
образуется одноядерный комплекс. Согласно закону действия масс константа нестойкости
Чтобы вычислить константу, нужно экспериментальным путем определить концентрации всех частиц, участвующих в равновесии (1). Пусть к небольшому начальному количеству металло-ионов [Me n + ]нач. прибавлен избыток адденда [X B — ]. За счет реакции (1) все ионы металла должны связаться в комплекс. С другой стороны, благодаря тому, что комплекс диссоциирует, в растворе создается определенная равновесная концентрация метало-ионов [Me n + ]. Убыль концентрации метало-ионов численно равна концентрации образовавшегося комплекса
так как согласно (1) один ион металла образует одну комплексную частицу.
Аналогично рассуждая и учитывая, что каждый металло-ион присоединяет p частиц адденда можно написать
[X B — ] — p[Me n + ] = [X B — ] (4)
Если комплекс прочен и в раствор введен избыток адденда, подавляющего диссоциацию, равновесная концентрация метало-ионов пренебрежимо мала по сравнению с начальными концентрациями. При этом условии (3) и (4) запишутся так:
Подставляя которые в (2) получим
К=[Me n + ][X B — ] р нач. / [Me n + ]нач. (5)
Логарифмирование (5) приводит к выражению
В координатах lg[Me n + ] нач / [Me n + ]-lg[X B — ] это уравнение прямой, не проходящей через начало координат (рис.1). Угловой коэффициент прямой tgα=a/b=p. Поэтому, определив из графика tgα, находим число частиц адденда, входящих в комплекс.
Отрезок, отсекаемый на оси ординат при [X B — ]=1,численно равен логарифму константы нестойкости. Однако найденная таким образом константа, отвечает лишь одной концентрации X B — . При других концентрациях величина константы будет несколько отлична. Поэтому на практике константу определяют не из графика, а рассчитывают по уравнению (6) для ряда концентраций X B — и полученные результаты усредняют. Эта часть работы выполняется после того, как установлен состав комплекса.
Если начальные концентрации иона металла и адденда известны (они задаются самим исследователем), то для расчетов по формуле (6) нужно каким-то образом найти равновесную концентрацию иона металла. Для этой цели часто используется потенциометрия. Метод основан на измерении потенциала электрода, обратимого по отношению к ионам металла.
Потенциал электрода однозначно определяется концентрацией (точнее активностью) металло-ионов в растворе и выражается формулой Нернста
Таким образом, задача сводится к измерению равновесного потенциала электрода и вычислению [Me n + ], величина которой подставляется в (6).
Существует несколько приемов использования потенциометрии для исследования комплексных соединений.
В одном случае составляют цепь
Me│Me n + ║Me n + +X B — │Me
состоящую из двух одинаковых электродов, но один из них погружен в раствор с постоянной и известной концентрацией ионов изучаемого металла с1,а второй – в раствор с такой же начальной концентрацией металло-ионов, но содержащий определенное количество адденда X B — . В последнем растворе за счет комплексообразования концентрация металло-иона уменьшается; она равна с2. ЭДС такой цепи
где lg(с1/с2) и lg[Me n + ]нач /[Me n + ] в выражении (7) представляет собой одну и ту же величину.
Вместо составления концентрационной цепи (8) можно составить две, в которых потенциал каждого электрода в отдельности измеряется по отношению к каломельному электроду сравнения, т.е.произвести раздельное определение величин Е1 и Е2 и отвечающих им [Me n + ]нач и [Me n + ]
Mетоды исследования процессов комплексообразования в случае существования нескольких различных по составу частиц (с различным координационным числом) постоянно совершенствовались различными авторами не столько по методике измерений, сколько по способам обработки экспериментальных результатов. Рассмотрим некоторые из известных методов расчета общих констант прочности комплексов.
Методы расчета констант нестойкос т и комплексных соединений по данным потенциометрических измерений.
Метод Б ь е р р у м а
Теоретические положения, лежащие в основе современных методов математической обработки результатов потенциометрических измерений, были разработаны Я. Бьеррумом и связаны с развитыми им представлениями о ступенчатом комплексообразовании в растворах. Согласно этим представлениям равновесия в растворах комплексных соединений могут быть описаны следующими уравнениями:
Через Me обозначен ион металла-комплексообразователя, через L — лиганд, без указания их зарядов. Рассматривая их процессы в водных растворах, подразумевается гидратированность всех частиц. MeLn — координационно-насыщенный комплекс в данной системе. В дальнейших рассуждениях предполагается отсутствие многоядерных комплексов.
Константы равновесия каждой отдельной реакции представляют собой последовательные константы устойчивости или, по Бьерруму, константы образования (величины, обратные константам нестойкости). Приведем здесь все обозначения, которых мы будем придерживаться в дальнейшем. Некоторые из них уже упоминались.
Кn — общая константа нестойкости координационно-насыщенного комплекса MeLn;
Кm — тоже для любого из промежуточных комплексов MeLm;
k — последовательная константа нестойкости комплекса;
βn — общая константа устойчивости координационно-насыщенного комплекса.

βi— общая константа устойчивости промежуточного комплекса
x— последовательная константа устойчивости

См— начальная концентрация ионов металла-комплексообразователя или общая концентрация всех частиц, содержащих в том или ином виде металл — комплексообразователь;
[Me] — равновесная концентрация ионов металла;
СL— общая концентрация лиганда;
[L] — равновесная концентрация лиганда;
[MeLn], [MeLi,] — равновесные концентрации комплексов;
Константы устойчивости выражаются следующими уравнениями;




Бьеррум ввел понятие о функции образования

Функцию образования можно определить как отношение концентрации лиганда, связанного в комплекс, к общей соли металла.
Эта функция может быть выражена через константы устойчивости. Числитель правой части уравнения (17) по определению равен:
Используя уравнение (15), запишем:
Знаменатель этой же части уравнения (16) можно выразить следующим образом:
Подставляя эти выражения в уравнение (16), получим:

Для решения полученного уравнения (вернее системы уравнений этого типа) можно использовать следующий метод, предложенный Бьеррумом.
Если из экспериментальных данных определяются значения равновесных концентраций лиганда, то по уравнению (16) можно вычислить функцию образования, поскольку остальные величины, входящие в него, также известны из опыта. Далее строится график, выражающий зависимость 

Вид кривой образования показан на рис. 1.
Для определения констант устойчивости находят значения lg [L] при 
Из уравнения (13) следует, что в данной точке значение lg[L] будет соответствовать lgхj
Таким образом, константа устойчивости комплекса MeL х1 =β1 будет равна концентрации лиганда при п = 1/2. Последовательной константе устойчивости отвечающий присоединению к MeL одной группы L, будет соответствовать значение концентрации лиганда при 
Рис. 1. Кривая образования
Такое предположение будет тем ближе к истине, чем больше отличаются между собой последовательные константы устойчивости, т. е. чем больше область концентраций лиганда в которой преобладает каждый комплекс. Уточнение результатов можно произвести путем последовательных приближений с помощью уравнения (21).
Возможны и другие способы решения уравнения (21), которые иногда представляют в следующем виде:




Ряд методов решения его, относящихся к частному случаю, когда максимальное число координированных групп равно 2, рассмотрены Ирвингом и Россоти. В работе этих авторов указываются ограничения каждого варианта в зависимости от соотношения между последовательными константами устойчивости.
Метод Бьеррума как в его первоначальном виде, так и видоизмененном, чаще всего применяется для обработки данных рН-метрических измерений. Равновесную концентрацию лиганда и функцию образования в этом случае выражают через концентрацию водородных ионов.
В некоторых случаях метод расчета по Бьерруму используется также для вычисления констант диссоциации кислот или оснований, участвующих в комплексообразовании. При этих расчетах рассматривают водородный ион как лиганд, анион кислоты как центральный ион, и определяют функцию образования.
Для определения констант диссоциации кислоты решается система уравнений, выражающих зависимость 
Для вычисления констант устойчивости по данным экспериментальных методов, определяющих равновесную концентрацию ионов металла-комплексообразователя, привлекаются другие способы расчета. На примере этих данных разработан метод Ледена.
Этот метод основан на использовании функции F, представляющей собой отношение общей концентрации всех комплексов, имеющихся в системе, к равновесной концентрации ионов металла-комплексообразователя.

К.Б. Яцимирский предложил назвать эту функцию «закомплексованностью» (строго говоря, это название относится к близкой к ней функции 
Общая концентрация соли металла складывается из концентраций свободных-ионов металла и всех комплексных частиц (уравнение 19)
Общая концентрация лиганда выражается уравнением (17):
Уравнение (19) и (17) можно представить в следующем виде:
Из уравнения (23) находится функция F

Разделив обе части уравнения на [L], имеем:

Значения См и [Me] известны из опыта. Для вычисления равновесной концентрации лиганда [L] Леден предлагает использовать среднее координационное число N.
В отличие от функции образования число N представляет собой отношение концентрации лиганда, связанного в комплекс, к общей концентрации комплексов. Другими словами, N является средним числом координированных групп, связанных с комплексообразователем.

Или, учитывая уравнения (17) и (19):

В первом приближении можно рассматривать N как постоянную величину в некотором узком интервале концентраций лиганда. При исследовании комплексных соединений потенциометрическим методом, использующим металлические или амальгамные электроды, приближенное значение N можно определить по разности потенциалов индикаторного электрода при двух различных концентрациях лиганда:
Если общая концентрация соли металла в обоих опытах постоянна, то последнее уравнение запишется в следующем виде:

Принимая, в первом приближении, равновесные концентрации лигандов равным общим концентрациям, вычислим N.

Зная N, можно определить равновесную концентрацию лиганда (пока, конечно, приближенно).

Далее задача сводится к вычислению F(L) no уравнению (27) и построению графика в координатах F(L)–[L]. Экстраполяция полученной прямой до [L]=0 позволяет определить значение β1, соответствующее ординате точки пересечения данной прямой с осью ординат.
Для определения β2 вычисляется 
Найденные значения βiявляются приближенными. Для лучших результатов рассчитывают новые значения из уравнения (29).
Далее, по уравнению (32) вычисляются новые значения, и повторяется весь расчет βi.
Такие приближенные расчеты продолжаются до тех пор, пока не будут достигнуты постоянные значения βi.
Метод Ледена требует очень точных экспериментальных данных и недостаточно надежен при определении значений βi (если i > 2).
Близко к этим методам примыкает вариант расчета констант нестойкости при ступенчатом комплексообразовании, предложенный К. Б. Яцимирским.
M е т о д К.Б. Я ц и м и р с к о г о
Метод Яцимирского состоит в построении графика, выражающего зависимость логарифма равновесной концентрации иона-комплексообразователя или пропорциональной ему величины от логарифма равновесной концентрации лиганда. Первоначально этот метод был предложен для вычисления констант нестойкости комплексов по данным полярографии. Затем автор метода распространил его и на другие экспериментальные методы (потенциометрический, метод растворимости).
К. Б. Яцимирский исходит из предположения о том, что в данных условиях в растворе имеются два комплекса MeLm и MeLm+1. Суммарная концентрация комплексных частиц в растворе выражается
следующим уравнением:

Уравнение (33) справедливо для прочных комплексов, когда концентрацией свободных ионов металла можно пренебречь, как слагаемым.
Это уравнение можно записать в следующем виде:

km+1— последовательная константа нестойкости, соответствующая процессу:
Если экспериментальное исследование комплексных соединений проводится потенциометрическим методом с металлическими или амальгамными электродами, то измеряемое значение ЭДС будет величиной, пропорциональной равновесной концентрации свободных ионов металла в растворе комплексных соединений.
Не учитывая коэффициентовактивностей ионов, мы можем представить уравнение э.д.с. концентрационной цепи в виде:

где Ех потенциал электрода в растворе комплексных соединений, Е0 – тоже в растворе простой соли при начальной концентрации ионов металла См.
Прологарифмируем уравнение (34) и, решив его относительно 

Уравнение (36) показывает, что зависимость потенциала электрода от логарифма концентрации лиганда при ступенчатом комплексообразовании выражается кривой, выпуклой к оси концентраций (рис. 2)
Рис. 2. Зависимость потенциала ртутного электрода от логарифма равновесной концентрации сульфит-ионов.
Решением уравнения (36) можно найти значения последовательных констант нестойкости.
Дифференцирование его по dlg[L] приводит к следующему уравнению:

В той точке кривой, где Km+1 численно равна [L], тангенс угла касательной выразится cледующим образом:

При этом условии концентрации обеих форм комплексов равны между собой.
Таким образом, если к кривой, построенной по экспериментальным значениям Ех и lg[L], провести касательную с угловым коэффициентом 
Проведением нескольких касательных с тангенсами угла наклона: 

На рис. 2 в качестве примера показана зависимость потенциала ртутного электрода в растворе сульфитных комплексов ртути от логарифма равновесной концентрации сульфит-ионов. Можно видеть, что прямые с угловыми коэффициентами 0,072 (2,5∙0,029) и 0,094(3,5·0,029) являются касательными в точках, абсциссы которых равны соответственно —0,26 и —0,16. Отсюда последовательные константы нестойкости комплексов с тремя и четырьмя координированными группами будут равны:
Для вычисления общей константы нестойкости используется уравнение (34). В точке, где km+1 = [L], оно преобразуется в следующее:


По уравнению (36) можно найти ряд параллельных значений lgKm, если использовать серию экспериментальных данных для 

Метод Яцимирского отличается большой наглядностью и простотой расчета. Если область существования одного из комплексов достаточно широка, то зависимость Е от lg[L] приближается к прямолинейной. В этом случае угловой коэффициент прямой (tgα) равен 

Уравнение (41) примет вид:

Чаще всего прямолинейная зависимость имеет место при высокой концентрации лиганда и характеризует преобладание координационно насыщенного комплекса. Можно считать, что данный комплекс преобладает практически полностью, если доля его в растворе превышает 90%. Под «долей данного комплекса» понимается отношение его концентрации к общей концентрации соли металла.

К.Б. Яцимирский показал, что максимальное накопление данного комплекса определяется отношением ступенчатых констант нестойкости

Из уравнения (45) следует, что для того, чтобы максимальная доля данного комплекса превышала 90%,соотношение между последовательными константами нестойкости должно составлять по крайней мере 2∙10 3 .Если в системе образуется больше двух комплексов с мало отличающимися друг от друга последовательными константами нестойкости, то доля комплекса еще больше понижается. Предположение о существовании в этих условиях только двух комплексов уже не будет справедливо. Наряду с рассматриваемыми формами, в растворе будут представлены в большем или меньшем количестве и другие виды комплексов. Естественно, что в данном случае метод Яцимирского, также как и другие методы, дает только приближенные значения констант нестойкости. При последующем расчете они могут быть учтены. Одновременно с этими вычислениями можно уточнить значения равновесных концентраций лиганда, которые в первом приближении принимаются равными общим концентрациям его. Для этой цели можно воспользоваться ходом рассуждений Ледена, касающимся определения среднего координационного числа.
Выше уже указывалось, что объединение различных способов расчета может оказаться наиболее полезным для обработки экспериментальных данных при ступенчатом комплексообразовании.
Рассмотренные методы вычислений констант устойчивости связаны не только с потенциометрическими измерениями. Они могут быть использованы в других экспериментальных методах, определяющих равновесные концентрации частиц, участвующих в реакции комплексообразовани
Реакции n-го порядка
Как мы уже знаем, сложные реакции типа 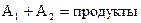
Разделив переменные, получаем:
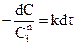
Интегрируя данное выражение в пределах от 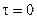
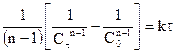
Данное уравнение можно представить относительно Сτ, что позволяет рассчитать концентрацию реагента в любой момент времени, если известны k и n:
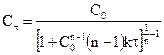
Уравнение для времени половинного превращения можно получить, как и ранее, приняв, что 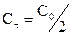
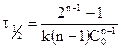
Представленные уравнения можно использовать для реакций n-го порядка (кроме первого!).
| n | Кинетическое уравнение | Вид зависимости  | Уравнения для расчета |
| k | 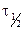 | ||
 | 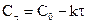 | 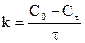 | 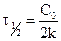 |
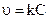 | 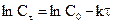 | 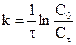 | 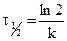 |
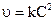 | 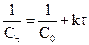 | 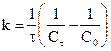 | 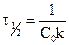 |
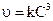 |  | 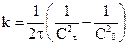 |  |
определение порядка реакции
Для определения порядка реакции используются различные методы.
Метод подстановки (аналитический): заключается в подстановке экспериментальных данных в уравнения кинетики реакции нулевого, первого, второго и третьего порядков и определении, которое из этих уравнений приводит к постоянному значению константы скорости реакции (можно считать, что уравнение описывает процесс, если рассчитанные по нему значения констант колеблются около какой-то средней величины и отклонения от среднего лежат в пределах возможных погрешностей определения). Если ни одно из уравнений не дает такого результата, то реакция является сложной.
Графический метод: заключается в построении графика, выражающего зависимость различных функций концентрации от времени, и определении, для которой из них зависимость выражается прямой линией. Так для реакции первого порядка прямая получается в системе координат 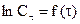
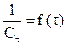
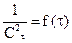
Метод определения периода полураспада: основан на определении промежутка времени, в течение которого концентрации (или количества) исходных веществ уменьшаются ровно в два раза. Проводя реакцию при двух различных начальных концентрациях 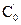
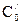
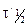
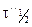
Вспомним уравнение для периода полураспада реакции n-го порядка:
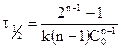
Получим 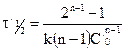
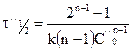
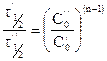
Например, 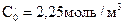
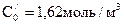
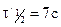
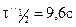
Метод изоляции или метод избытка: реагентов заключается в том, что проводят серии опытов, в каждом из которых изучается влияние изменения концентрации только одного из исходных веществ на скорость реакции. это достигается применением всех остальных исходных веществ в данной серии опытов в таком избытке, что расход их в ходе реакции существенно не меняет их количества (концентрации), которые поэтому можно считать постоянными. Охватывая, таким образом, все исходные вещества, можно установить влияние изменения концентрации каждого из них на скорость реакции и отсюда определить порядок реакции и уравнение кинетики.
Рассмотреть самостоятельно – дифференциальный метод (разновидность графического метода?)!
Кинетика сложных реакций, состоящих из двух или большего числа простых реакций, в той или иной форме связанных между собой, зависит от формы связи между этими реакциями и от соотношения их скоростей. Типичными по форме такой связи являются реакции:
Параллельные: две реакции называются параллельными, если в обеих в качестве исходного вещества выступает одно и то же вещество, т.е. это реакции вида:
Обозначим, через 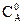
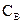
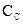
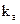
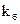
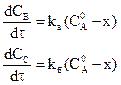
Сумма этих скоростей определяет скорость расходования исходных веществ:
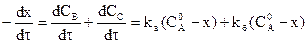
С другой стороны, отношение этих двух уравнений (*) дает:
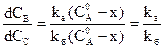
Таким образом, если в данных условиях термодинамически возможны два или три направления химический реакции, то преобладание того или другого из них и относительные количества получаемых продуктов реакции определяются всецело соотношением скоростей этих реакций, а не соотношением термодинамической устойчивости конечных продуктов. Если реакции значительно различаются по скорости, то обычно реакцию, обладающую большей скоростью, называют главной (основной), а остальные – побочными. При не слишком большом различии в скоростях главной реакцией называют реакцию, приводящую к получению основного нужного продукта, хотя бы она и обладала меньшей скоростью.
Последовательные (или консекутивные): две реакции называются последовательными, если вещество, образующееся в одной стадии, является исходным для другой, т.е. это реакции вида:
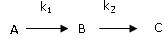
где В промежуточный продукт в процессе получения вещества С; k1 и k2 — константы скоростей двух стадий превращения.
Данная схема представляет собой простейшую последовательную реакцию, которая происходит в две ступени, и каждая из этих ступеней является простой мономолекулярной реакцией. В общем же случае ступеней может быть больше, а стадии могут не быть мономолекулярными.
Расчет кинетики последовательных реакций очень сложен. Отметим только, что если одна из ступеней обладает значительно меньшей скоростью, чем остальные, то общая скорость реакции определяется скоростью именно этой реакции.
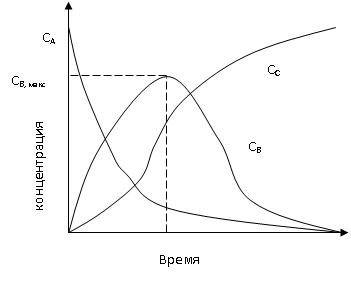
Зависимость концентрации веществ, участников реакции, от времени можно рассмотреть на примере простейшей последовательной реакции:
Из данных графических зависимостей следует, что в начале процесса, когда концентрация вещества А еще сравнительно высока, скорость первой реакции значительна и увеличение концентрации В происходит быстро. По мере израсходования вещества А уменьшается и скорость образования вещества В. Это приводит к тому, что расход вещества В на образование вещества С, начиная с какого-то момента времени, уже не компенсируется в полном степени образованием его из вещества А и концентрация вещества В в системе начинает уменьшаться. Вследствие этого кривая Св проходит через максимум. Положение таких кривых для различных последовательных реакций неодинаково, т.к. оно зависит от соотношения в скоростях этих реакций, но общий характер зависимости остается обычно таким, как он рассмотрен нами.
Кривые на рисунке описываются уравнениями:

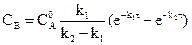
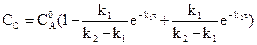
(реакции первого порядка)
Было доказано, что максимальная концентрация промежуточного продукта В, достигаемая в ходе реакции, не зависит от абсолютных значений констант скоростей k1 и k2, а зависит только от их отношения 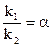
При k1 > k2 скорость образования промежуточного продукта будет значительно выше скорости его расходования. Таким образом, если промежуточный продукт является целевым и необходимо увеличить его выход, то это может быть достигнуто увеличением k1, что можно достигнуть введением в реакционную систему селективного катализатора, который увеличил бы скорость первой стадии при неизменной скорости второй. Если зависимость скоростей стадий от температуры различна, то тот же эффект может быть достигнут изменением температуры.
При k1 0 С и через 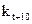
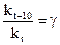
Данное правило определяет только порядок изменения скорости, присущий значительной части различных химических реакций при обычных температурах. Однако для ориентировочной оценки возможного влияния температуры оно нередко бывает полезным, в особенности при отсутствии данных для более точного расчета.
http://allrefrs.ru/1-49884.html
http://mydocx.ru/1-34023.html