Скорость химической реакции
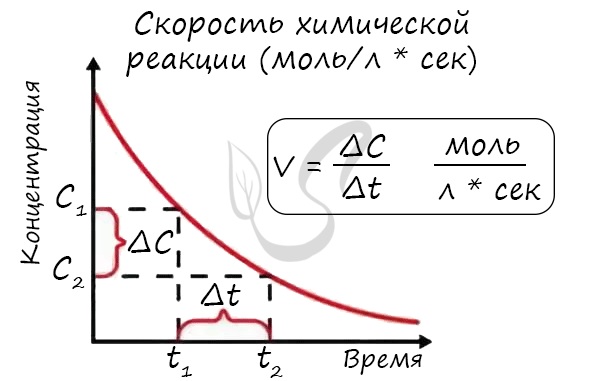
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
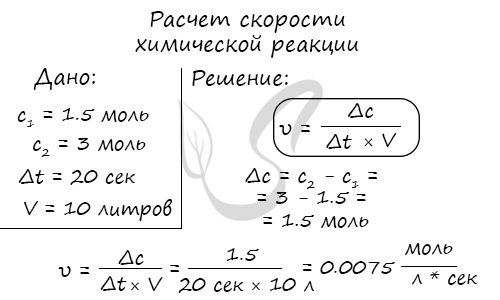
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо — железная стружка.
Химическая активность также играет важную роль. Например, отвечая на вопрос «какой из металлов Fe или Ca быстрее прореагирует с серой?» мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.
Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос «какой из металлов Li или K быстрее прореагирует с водой?» мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
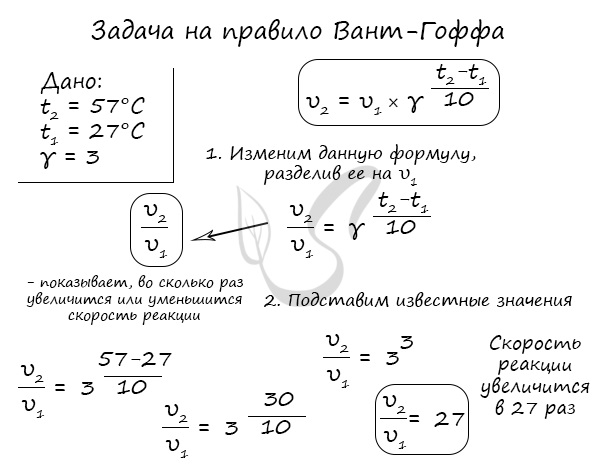
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!
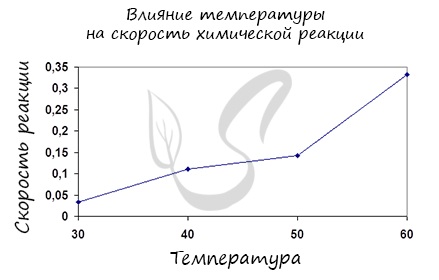
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора — каталитическими.
Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
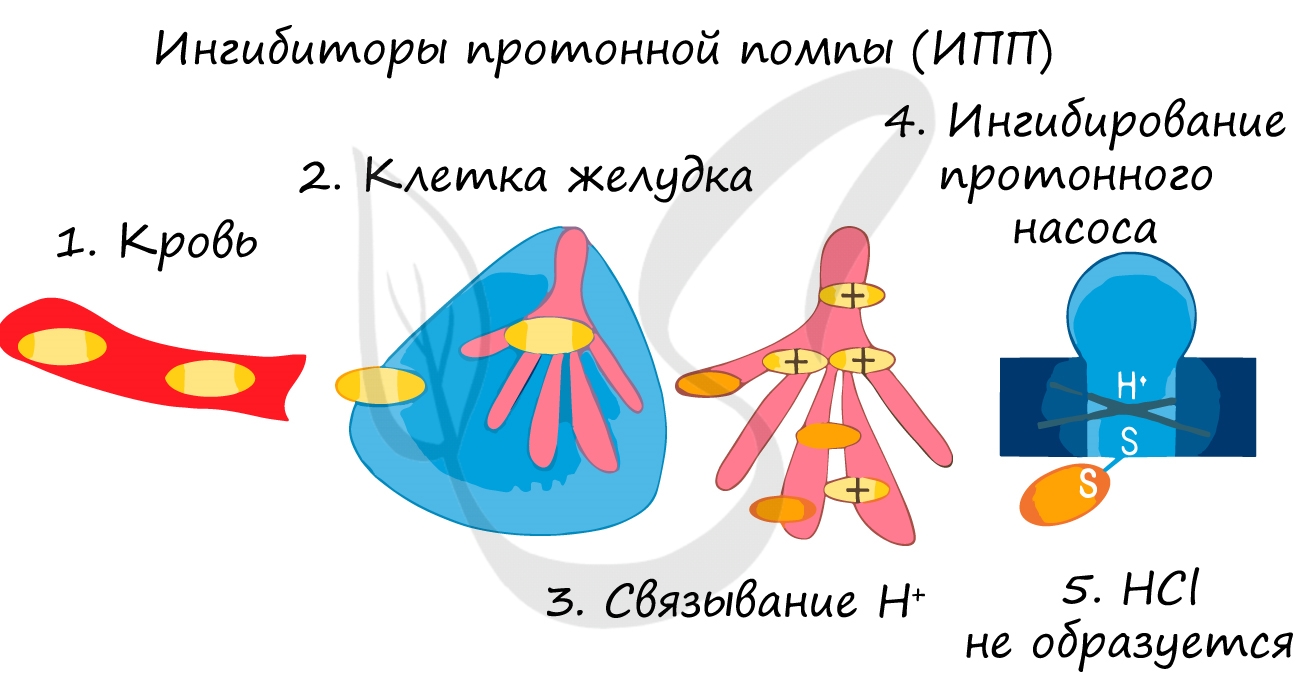
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Алгоритм решения задач по теме «Скорость химических реакций»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Алгоритм решения задач по теме «Скорость химической реакции»
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
По правилу Вант-Гоффа
По условию задачи требуется определить υ/υ 0 :
υ/υ 0 =2 (70-30)/10 = 2 4 = 16
Запишите кинетическое уравнение для следующих уравнений реакций:
Согласно закону действующих масс, который действует для газов и жидкостей:
Как изменится скорость реакции:
при увеличении давления в системе в 4 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О 2 ) = а, концентрация серы — твёрдого вещества не учитывается.
При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 4а / к 1 а = 4
Следовательно, при повышении давления в 4 раза, скорость данной реакции увеличится в 4 раза.
Как изменится скорость реакции:
при увеличении давления в системе в 2 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO 2
С(SО 2 ) = а, концентрация кислорода C(O 2 ) = b.
При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO 2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ ‘ = к 1 (2а) 2 ·2b = к 1 4а 2 ·2b= к 1 8а 2 ·b
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 8а 2 ·b / к 1 а 2 ·b =8
Следовательно, при повышении давления в 2 раза, скорость данной реакции увеличится в 8 раз.
При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
1) При условии, что концентрация вещества (С), вступившего в реакцию, постоянна:
При температуре 10 ºС скорость реакции равна υ 0 =∆ C /∆τ 0 ,
При температуре 30 ºС скорость реакции равна υ =∆ C /∆τ,
υ =∆ C /60, ∆ C = 60 υ . Следовательно, 300 υ 0 =60 υ , а υ/ υ 0 =300/60=5.
2) По правилу Вант Гоффа: υ = υ 0 γ ∆ t /10 , υ/ υ 0 = γ ∆ t /10
3) Согласно рассуждениям (1) и (2), получим γ (20-10)/10 = γ=5
Работа № 143 (лабораторная). Выделение крахмала, белка, жира из семян.
Оборудование: мука, семена подсолнечника, вода в химическом стакане, кусочек марли, раствор иода, стакан с водой и крахмалом, пипетка.
1.Возьмите немного пшеничной муки, добавьте в нее воды и сделайте небольшой комочек теста.
2.Заверните комочек теста в марлю и промойте его в стакане с водой. Как изменилась вода в стакане?
3. Капните 1—2 капли раствора иода в стакан с водой и крахмалом. Как изменилась окраска содержимого стакана?
4.Капните 1—2 капли раствора иода в стакан с водой, в котором промывали комочек теста в марле. Как изменилась окраска содержимого в стакане? Чем это можно объяснить?
5.Разверните марлю, в которой было тесто. Вы увидите на марле тягучую клейкую массу — клейковину, или растительный белок.
6.Возьмите семя подсолнечника и заверните его в листок белой бумаги. Надавите на семя тупым концом карандаша. Разверните листок бумаги и посмотрите, чем пропиталась бумага.
7.Перечертите схему и заполните ее.
Органические вещества семени
Работа № 143 (лабораторная). Выделение крахмала, белка, жира из семян.
Оборудование: мука, семена подсолнечника, вода в химическом стакане, кусочек марли, раствор иода, стакан с водой и крахмалом, пипетка.
1.Возьмите немного пшеничной муки, добавьте в нее воды и сделайте небольшой комочек теста.
2.Заверните комочек теста в марлю и промойте его в стакане с водой. Как изменилась вода в стакане?
3. Капните 1—2 капли раствора иода в стакан с водой и крахмалом. Как изменилась окраска содержимого стакана?
4.Капните 1—2 капли раствора иода в стакан с водой, в котором промывали комочек теста в марле. Как изменилась окраска содержимого в стакане? Чем это можно объяснить?
5.Разверните марлю, в которой было тесто. Вы увидите на марле тягучую клейкую массу — клейковину, или растительный белок.
6.Возьмите семя подсолнечника и заверните его в листок белой бумаги. Надавите на семя тупым концом карандаша. Разверните листок бумаги и посмотрите, чем пропиталась бумага.
7.Перечертите схему и заполните ее.
Органические вещества семени
Классификация органических соединений по функциональным группам.
Основы номенклатуры органических соединений.
Изомерия в органической химии: углеродного скелета, положения кратной связи.
Изомерия положения функциональных групп. Межклассовая и пространственная изомерия.
Решение заданий по определению и написанию изомеров. Решение расчетных задач на вывод формул органических
Решение расчетных задач на вывод формул органических по процентному составу вещества.
Контрольная работа №1 по теме «Строение и классификация орг. в-в»
Тема 3. Химические реакции в органической химии (4 часа)
Типы химических реакций в органической химии: замещения и присоединения.
Реакции отщепления и изомеризации
Решение задач и упражнений по теме «Химические реакции»
Практическая работа №1 «Качественный анализ органических соединений»
Тема 4. Углеводороды (16 часов)
Природные источники углеводородов. Нефть, природный газ, каменный уголь.
Алканы: строение, номенклатура, изомерия, получение, физические свойства
Химические свойства алканов.
Алкены: строение, номенклатура, изомерия, получение, физические свойства.
Химические свойства алкенов.
Практическая работа №2 «Получение этилена и опыты с ним»
Алкины: строение, номенклатура, изимерия, получение, физические свойства
Химические свойства алкинов.
Алкадиены: строение, номенклатура, изомерия, получение, физические свойства
Химические свойства алкадиенов. Каучуки. Резина.
Циклоалканы: строение, номенклатура, изомерия, получение, физические свойства.
Ароматические углеводорода (Арены). Строение молекулы бензола. Физические свойства и получение.
Химические свойства бензола.
Генетическая связь между классами углеводородов.
Выполнение заданий по составлению изомеров, уравнений реакций.
Контрольная работа №2 по теме «Углеводороды»
Тема 5. Спирты и фенолы (7 часов)
Спирты: состав, классификация, изомерия.
Химические свойства одноатомных спиртов
Взаимное влияние атомов на примере молекулы фенола.
Решение расчетных задач по определению мол. формулы по продуктам сгорания.
Тема 6. Альдегиды и кетоны (6 часов)
Альдегиды: классификация, изомерия, номенклатура. Строение молекулы, физ. свойства».
Химические свойства альдегидов.
Генетическая связь между органическими веществами.
Решение расчетных и экспериментальных задач
Контрольная работа №3 по теме «Альдегиды и кетоны»
Практическая работа №4 «Спирты. Фенолы. Альдегиды. Кетоны»
Тема 7. Карбоновые кислоты. Сложные эфиры (7 часов).
Карбоновые кислоты: строение, классификация.
Химические свойства карбоновых кислот (по карбоксильной группе)
Химические свойства карбоновых кислот (по радикалу).
Контрольная работа №4 по теме «Карбоновые кислоты и их производные»
Практическая работа №5 «Карбоновые кислоты»
Тема 8. Углеводы (5 часов)
Углеводы, их состав и классификация.
Решение экспериментальных задач. Генетическая связь между классами орг. в-в»
Практическая работа №6 «Углеводы»
Тема 9. Азотсодержащие соединения (8 часов)
Амины: строение, классификация, номенклатура, получение.
Аминокислоты: состав и строение молекул, номенклатура, получение.
Белки как биополимеры. Биологическая роль белков.
Химические свойства белков.
Контрольная работа №5 « Азотсодержащие соединения»
Практическая работа № 7 « Амины. Аминокислоты, Белки»
Практическая работа № 8 «Идентификация органических соединений»
Тема 9. Биологически активные вещества (3 часа)
Закрепить знания об органических и неорганических веществах, входящих в состав клеток и тканей организма, полученные в ходе изучения курса биологии и химии.
Развивать у учащихся умения анализировать, сравнивать, делать обобщения и выводы.
Развивать навыки проведения химического эксперимента.
Тип занятия: практическая работа.
Практическая работа рассчитана на 2 спаренных урока по 45 минут.
1. Персональный компьютер (или ноутбук) для преподавателя
2. Мультимедийный проектор
6. Держатели для пробирок
7. Стаканы химические
1. Пероксид водорода – 3% H 2 O 2
3. Разбавленная серная кислота – 2н H 2 SO 4
4. Соляная кислота – 2н HCl
5. Крахмальный клейстер
6. Спиртовая настойка йода 5%
7. Гидрофосфат натрия – 2н Na 2 HPO 4
8. Хлорид аммония – 0,5н NH 4 Cl
9. Гидроксид аммония – 10% NH 4 OH
10. Хлорид магния – 0,5н MgCl 2
Биологический материал (исследуемые образцы растительного и животного происхождения):
1. Сырой картофель
2. Вареный картофель
5. Скорлупа куриного яйца
1. Организационная часть.
Преподаватель объявляет тему занятия, раскрывает ее связь с другими темами курса.
2. Контроль исходного уровня знаний.
Проводится в виде фронтального опроса, сопровождаемого мультимедийной презентацией:
— Какие макроэлементы входят в состав клетки?
— Какие макроэлементы являются главными компонентами всех органических соединений? Какой процент они составляют от массы клетки?
— В состав каких органических молекул входят сера и фосфор?
— Какие функции выполняют в клетке ионы калия, натрия и хлора?
— Какую роль в организме играет кальций?
— Какова роль железа в организме?
— Какую функцию в организме выполняет гемоглобин?
— Почему угарный газ в отличие от углекислого вызывает отравление организма?
— Какова роль магния в клетках животных?
— Какие вещества называются ферментами? Какое строение имеют ферменты?
— Какую роль магний играет в клетках растений?
— Что такое хлорофилл? В каких органоидах он содержится? В каких процессах обмена веществ участвует?
— Какие элементы относятся к микроэлементам? Какую роль они играют в организме?
— Какие вещества называются гормонами?
— Какое неорганическое вещество содержится в клетке в наибольшем количестве?
— В каких органах и тканях содержание воды наименьшее, а в каких наибольшее?
— Какую роль вода играет в клетке и живом организме в целом?
— Какой процесс называется гидролизом?
— Какие вещества пищи при попадании в организм подвергаются гидролизу?
— В каком состоянии в клетке могут находиться соли?
— Какой процесс называется диссоциацией? Какие вещества подвергаются диссоциации?
— Распределите приведенные вещества по классам: CO, Na 2 HPO 4 , HCl, KHCO 3 , CO 2 , NaH 2 PO 4 , CaCl 2 , CH 3 COOH, NH 4 OH.
— Какие ионы образуются в клетке при диссоциации солей NaCl, CaCl 2 , KHСO 3 ? К какому классу относится последняя соль? Назовите ее.
— Как применяются в медицине NaCl и CaCl 2 ?
— Приведите примеры нерастворимых солей, входящих в состав клетки.
— Какова реакция среды в клетке? Какие ионы поддерживают постоянную слабощелочную реакцию среды в клетке?
— Какая реакция среды в желудке? Какое вещество ее создает? Для чего?
— Какой рН желудочного сока? При каких значениях рН функционирует пепсин желудочного сока?
Если учащийся не может ответить на вопрос, он переходит к следующему ученику. В результате опрошенными оказываются практически все учащиеся.
Далее учащимся предлагается устно выполнить несколько заданий, текст которых высвечивается на слайдах мультимедийной презентации:
1. Установите соответствие:
Ответы: А – 2, Б – 1, В – 4, Г – 2, Д – 4
2. Установите соответствие:
Ответы: А – 4, Б – 3, В – 5, Г – 2, Д – 1
3. Вставьте пропущенные слова:
Жиры – это . вещества клетки, представляющие собой сложные эфиры . и . Жиры относятся к группе . По агрегатному состоянию растительные жиры обычно . а животные — . однако встречаются исключения, например, . имеет животное происхождение, но по агрегатному состоянию . В организме жиры выполняют множество функций. Например, . — жиры входят в состав биологических мембран. Кроме того, жиры препятствуют потере тепла организмом вследствие своей низкой . Верблюдам запас жира позволяет долгое время обходиться без жидкости, так как при . жиров выделяется большое количество воды. Утки смазывают свое оперение секретом, содержащим жиры, в результате их перья приобретают . свойства. В семенах подсолнечника большое количество жиров служит в качестве . для развития зародыша.
Ответы: органические; глицерина; высших жирных карбоновых кислот; липидов; жидкие; твердые; рыбий жир; жидкий; строительную; теплопроводности; окислении; водоотталкивающие; запаса питательных веществ.
4. В приведенном перечне веществ и понятий укажите лишнее:
а). Пепсин, амилаза, мальтоза, липаза.
— Мальтоза, так как это углевод, а все остальные вещества – белки.
б). Вазопрессин, инсулин, глюкагон, тестостерон.
— Тестостерон, так как это гормон, имеющий липидную природу, а все остальные вещества – гормоны белковой природы.
в). Лактоза, гликоген, мальтоза, сахароза.
— Гликоген, так как это – полисахарид, а все остальные углеводы – дисахариды.
г). Миоглобин, тромбин, гемоглобин, натрий-калиевый насос.
— Тромбин, так как он выполняет защитную функцию, а остальные белки транспортную.
д). Фруктоза, рибоза, глюкоза, галактоза.
— Рибоза, так как это пентоза, а все остальные углеводы – гексозы.
е). РНК, АКТГ, ДНК, АТФ.
— АКТГ, так как остальные вещества имеют нуклеотидную природу, а АКТГ – белок.
ж). Кератин, коллаген, эластин, иммуноглобулин.
— Иммуноглобулин, так как это белок, выполняющий защитную функцию, а остальные – строительную.
Другое объяснение: так как иммуноглобулин – это глобулярный белок, а остальные вещества – фибриллярные белки.
з). Фенилкетонурия, галактоземия, болезнь Тея-Сакса, синдром Дауна.
— Синдром Дауна, так как это заболевание вызвано хромосомной мутацией, а все остальные заболевания являются нарушениями обмена веществ.
и). Аденин, урацил, цитозин, тимин.
— Урацил, так как это азотистое основание, которое не входит в состав ДНК.
Другое вариант: тимин, так как это азотистое основание не входит в состав РНК.
5. Назовите химические вещества, входящие в состав клеточной мембраны, обозначенные на рисунке цифрами, и поясните их функцию.
1 – белки (транспортная, рецепторная, каталитическая функция);
2 – фосфолипиды (составляют основу мембраны);
3 – углеводы (обеспечивают узнавание клетки клеткой).
3. Выполнение практической работы.
Учащиеся выполняют работу парами в соответствии с методическими указаниями и заносят результаты в практическую тетрадь. Перед началом работы преподаватель проводит инструктаж по технике безопасности.
Опыт 1. Химические свойства карбоната кальция и его значение для живых организмов.
а). В пробирку поместите 1г скорлупы куриного яйца, добавьте 3 мл соляной кислоты. Запишите наблюдения, составьте уравнение химической реакции.
Основу скорлупы куриных яиц составляет карбонат натрия. При взаимодействии его с кислотой происходит растворение соли и выделение газа:
CaCO 3 + 2HCl —> CaCl 2 + CO 2 
б ). Демонстрационный опыт: поместите сырое куриное яйцо в раствор соляной кислоты на 30 минут. Какие изменения наблюдаете? Сделайте вывод о составе оболочки яйцеклетки курицы и влиянии неорганических солей на ее свойства.
Под действием соляной кислоты оболочка яйцеклетки курицы становится мягкой. Так как основу скорлупы куриного яйца составляет карбонат кальция, можно сделать вывод, что именно он обуславливает твердость скорлупы и обеспечивает ее защитную функцию для клетки.
Опыт 2. Химические свойства фосфата кальция и его значение для живых организмов.
а). В пробирку поместите 0,1г фосфата кальция, добавьте 2 мл серной кислоты. Запишите наблюдения, составьте уравнение химической реакции.
Фосфат кальция составляет основу костной ткани. В результате реакции происходит растворение фосфата кальция в кислоте:
б ). Демонстрационный опыт: поместите куриную кость в раствор соляной кислоты на 6 — 8 часов. Какие изменения наблюдаете? Сделайте вывод о составе костной ткани и влиянии неорганических солей на свойства костей. (Опыт закладывается заранее, учащимся на занятии только демонстрируются полученные результаты).
В состав костей входят неорганические и органические вещества. Неорганические вещества костей представлены в первую очередь нерастворимыми солями (Ca 3 (PO 4 ) 2 и CaCO 3 ). Карбонат кальция придает костям прочность. Органические вещества придают костной ткани эластичность. Под действием соляной кислоты происходит растворение карбоната кальция, в результате чего костная ткань теряет твердость и кость становится гибкой.
Опыт 3. Качественная реакция на фосфат-ион.
В пробирку налейте 2 капли раствора гидрофосфата натрия, добавьте 2 капли раствора хлорида аммония и 2 капли раствора гидроксида аммония, а затем 2 капли раствора хлорида магния. Запишите наблюдения, составьте уравнение химической реакции.
В результате реакции выпадает белый осадок фосфата магния аммония:
Na 2 HPO 4 + MgCl 2 + NH 4 OH —> MgNH 4 PO 4 
Опыт 4. Взаимодействие пероксида водорода с белками клетки.
В четыре пробирки поместите соответственно сырой и вареный картофель, сырое и вареное мясо. В каждую пробирку добавьте по 3 мл пероксида водорода. Какие изменения наблюдаете? Сделайте вывод о влиянии термической обработки на структуру и функции белка каталазы.
В тканях животных и растений содержится фермент каталаза, который катализирует реакцию разложения пероксида водорода:
H 2 O 2 —> O 2 
За счет действия каталазы при добавлении пероксида водорода к сырым мясу и картофелю наблюдается выделение газа.
По своей химической природе все ферменты являются белками. При термической обработке происходит денатурация белков, вследствие чего каталаза теряет свои свойства и разложение пероксида водорода в клетках вареного картофеля и мяса не идет.
Опыт 5. Качественная реакция на крахмал. Обнаружение крахмала в клетках картофеля.
а). В пробирку налейте 1 мл крахмала и добавьте 1 каплю йода. Запишите наблюдения, составьте схему химической реакции. Затем нагрейте пробирку. Какие изменения наблюдаете? Сохраняются ли эти изменения после охлаждения пробирки. Сделайте вывод о влиянии нагревания на смещение равновесия в реакции крахмала с йодом.
В результате реакции образуется соединение сине-фиолетового цвета:
I 2 + крахмал — сине-фиолетовое окрашивание
При нагревании пробирки происходит исчезновение окраски, а при охлаждении вновь ее появление, что указывает на обратимость реакции взаимодействия крахмала с йодом.
б). Возьмите ломтик сырого картофеля и капните на него 1 каплю йода. Какие изменения наблюдаете? Сделайте вывод о химическом составе клеток картофеля.
Под действием йода происходит появление сине-фиолетового окрашивания, что указывает на содержание в клетках клубня картофеля крахмала, который запасается там в виде крахмальных зерен.
Преподаватель в процессе беседы выясняет, какие у учащихся были трудности в ходе выполнения практической работы, предлагает им оценить эффективность своей работы на занятии и достигнутые результаты.
Проводится в форме ситуационных задач.
1. Известно, что кислотные дожди оказывают негативное воздействие на растения и животных, вызывая повреждения их тканей. Предположите, с чем связано негативное действие кислотных дождей на яйца птиц. Составьте уравнения соответствующих реакций, принимая во внимание, что кислотные дожди вызываются наличием в атмосфере оксида серы (IV) и оксида азота (IV).
При взаимодействии оксида серы (IV) и оксида азота (IV) с водой образуются кислоты:
Твердость скорлупы птичьих яиц обусловлена наличием в ней карбоната кальция, который растворяется в кислой среде с выделением углекислого газа:
CaCO 3 + 2HNO 3 —> Ca(NO 3 ) 2 + CO 2 
Таким образом, после воздействия кислотных дождей скорлупа яйца размягчается и не обеспечивает больше надлежащей защиты развивающемуся зародышу.
2. Известно, что тяжелые металлы вызывают нарушения в работе нервной системы, печени, почек и других органов. Объясните с точки зрения химического состава клетки, в чем состоит негативное воздействие на нее тяжелых металлов.
Тяжелые металлы вызывают необратимое осаждение белков, в результате чего белки перестают выполнять свои функции в клетке.
3. Основу препаратов “Мезим”, “Креон”, “Панзинорм” составляет панкреатин, представляющий собой экстракт содержимого поджелудочной железы. В состав панкреатина входят липаза, амилаза, трипсин, химотрипсин. Предположите, какое действие будет оказывать на организм данный препарат.
Препараты “Мезим”, “Креон”, “Панзинорм” нормализуют процессы пищеварения, так как в их состав входят ферменты, расщепляющие органические вещества пищи.
4. Для лечения повышенного артериального давления применяются препараты, относящиеся к фармакологической группе “блокаторы медленных кальциевых каналов”. Яркими представителями данной группы являются: “Кордафлекс”, “Кальцигард”, “Амлодипин”. Предположите, на чем основано действие препаратов данной группы на организм.
Препараты данной фармакологической группы уменьшают поступление ионов кальция в клетку. Ионы кальция влияют на сокращение гладкой и поперечнополосатой мускулатуры, в том числе сердечной мышцы, и как следствие, на артериальное давление.
5. Для уменьшения кислотности желудочного сока при гастрите и язвенной болезни желудка применяются препараты антацидной фармакологической группы, например, “Альмагель”, “Маалокс”, “Гастал”. В состав этих препаратов входят гидроксиды алюминия и магния, а также карбонат магния. Объясните, на чем основано действие этих препаратов на организм, составьте уравнения соответствующих реакций.
Препараты антацидной группы нейтрализуют соляную кислоту в желудке, снижая тем самым уровень кислотности.
MgCO 3 + 2HCl —> MgCl 2 + CO 2 
6. Подведение итогов.
Преподаватель выставляет оценки за занятие, комментирует полученные результаты. Учащиеся сдают тетради с оформленными результатами работы.
http://chemege.ru/kinetika/
http://infourok.ru/algoritm-resheniya-zadach-po-teme-skorost-himicheskih-reakciy-3719021.html