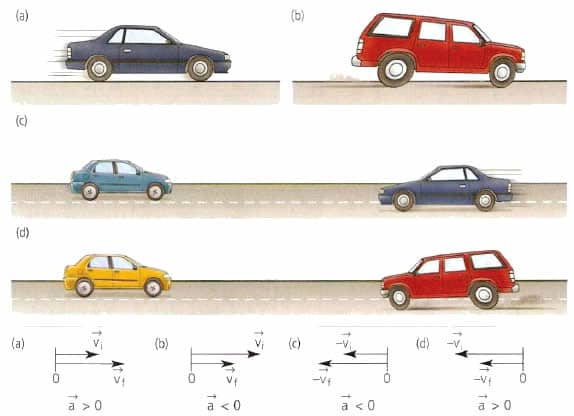
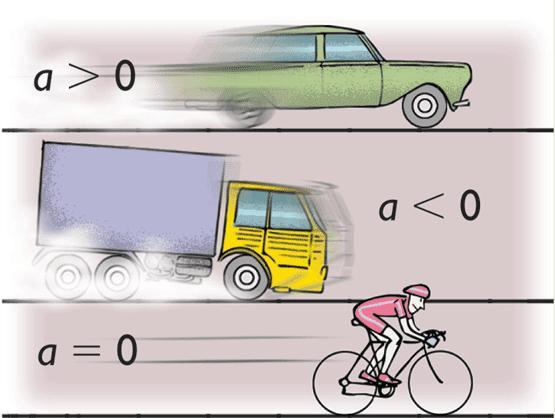
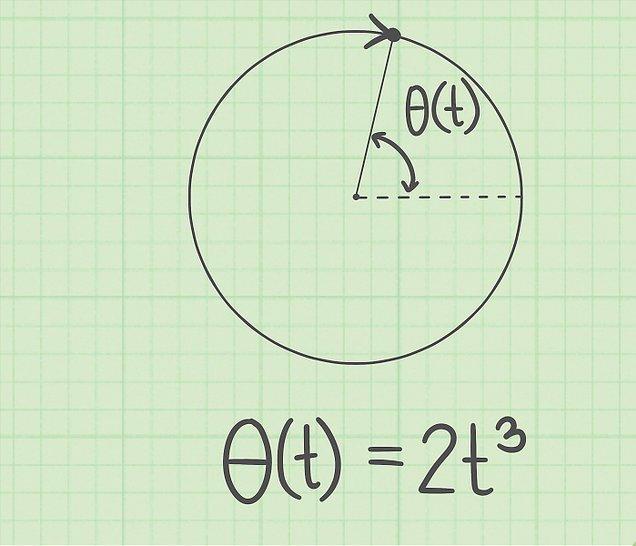Среднее и мгновенное ускорение и скорость. Формулы. Пример задачи
В физике рассмотрением особенностей движения макроскопических твердых тел занимается кинематика. Этот раздел механики оперирует такими понятиями, как скорость, ускорение и путь. В данной статье мы сосредоточим свое внимание на вопросах, что такое мгновенное ускорение и скорость. Также рассмотрим, какими формулами можно определить эти величины.
Нахождение скорости
Об этом понятии известно каждому школьнику, начиная уже с младших классов. Все ученики знакомы с приведенной ниже формулой:
Здесь S — путь, который преодолело движущееся тело за время t. Данное выражение позволяет рассчитать некоторую среднюю скорость v. Действительно, нам ведь неизвестно, каким образом двигалось тело, на каком участке пути оно перемещалось быстрее, а на каком медленнее. Даже не исключена ситуация, что в некоторой точке пути оно находилось в состоянии покоя какое-то время. Единственное, что известно, это пройденный путь и соответствующий ему временной отрезок.
В старших классах школ скорость, как физическая величина, рассматривается в новом свете. Ученикам предлагают следующее ее определение:
Чтобы понять это выражение, нужно знать, как вычисляется производная от некоторой функции. В данном случае — это S(t). Поскольку производная характеризует поведение кривой в данной конкретной точке, то вычисляемая по формуле выше скорость называется мгновенной.
Ускорение
Если механическое движение является переменным, то для его точного описания необходимо знать не только скорость, но и величину, которая показывает, как она изменяется во времени. Это — ускорение, которое является производная по времени скорости. А та, в свою очередь, есть производная по времени пути. Формула мгновенного ускорения имеет вид:
Благодаря этому равенству можно определить изменение величины v в любой точке траектории.
По аналогии со скоростью, среднее ускорение вычисляется по такой формуле:
Здесь Δv — это изменение модуля скорости тела за промежуток времени Δt. Очевидно, что в течение этого периода тело способно как ускоряться, так и замедляться. Величина a, определенная из выражения выше, покажет лишь в среднем быстроту изменения скорости.
Движение с постоянным ускорением
Отличительной особенностью этого типа перемещения тел в пространстве является постоянство величины а, то есть a=const.
Это движение также называют равноускоренным или равнозамедленным в зависимости от взаимного направления векторов скорости и ускорения. Ниже такое перемещение рассмотрим на примере двух наиболее распространенных траекторий: прямой линии и окружности.
При перемещении по прямой линии во время равноускоренного движения мгновенная скорость и ускорение, а также величина пройденного пути, связаны следующими равенствами:
Здесь v0 — это значение скорости, которым тело обладало до появления ускорения a. Заметим один нюанс. Для данного типа перемещения бессмысленно говорить о мгновенном ускорении, поскольку в любой точке траектории оно будет одним и тем же. Иными словами, мгновенная и средняя величины его будут равны друг другу.
Что касается скорости, то первое выражение позволяет определить ее в любой момент времени. То есть это будет мгновенный показатель. Для расчета средней скорости необходимо воспользоваться представленным выше выражением, то есть:
v = S/t = v0 ± a*(t1 + t2)/2.
Здесь t1 и t2 — это моменты времени, между которыми вычисляют среднюю скорость.
Знак «плюс» во всех формулах соответствует ускоренному передвижению. Соответственно знак «минус» — замедленному.
При изучении движения по окружности с постоянным ускорением в физике используют угловые характеристики, которые аналогичны соответствующим линейным. К ним относится угол поворота θ, угловая скорость и ускорение (ω и α). Эти величины связаны в равенства, аналогичные выражениям равноускоренного движения по прямой линии, которые приводятся ниже:
При этом угловые характеристики связаны с линейными следующим образом:
Здесь R — радиус окружности.
Задача на определение среднего и мгновенного ускорения
Известно, что тело движется по сложной траектории. Его мгновенная скорость меняется по времени следующим образом:
Чему равно мгновенное ускорение тела в момент t=3 (секунды)? Найти среднее ускорение за промежуток времени от двух до четырех секунд.
На первый вопрос задачи ответить несложно, если вычислить производную от функции v(t). Получаем:
а = |3*t2 — 3|t=2 = 24 м/с2.
Для определения среднего ускорения, следует воспользоваться таким выражением:
a = (v2 — v1)/(t2 — t1);
а = ((10 — 3*4 + 43) — (10 — 3*2 + 23))/2 = 25 м/c2.
Из расчетов следует, что среднее ускорение немного превышает мгновенное в середине рассмотренного временного промежутка.
Для уравнения скоростей берут произведения
MedBioGoogle
Навигация
Основные понятия химической кинетики. Химическая реакция.
Химической реакцией можно считать любое изменение вещества, при котором образуется или разрывается химическая связь между атомами. Химическая реакция характеризуется механизмом ее протекания и глубиной протекания.
Химические реакции, как правило, не происходят путем непосредственного взаимодействия исходных молекул с прямым переходом их в молекулы продуктов реакции. В большинстве случаев реакции протекают в несколько стадий. Например, окисление ионов двухвалентного железа в кислом растворе молекулярным кислородом состоит из ряда стадий:
Fe 2+ + HO2 × ® Fe 3+ + HO2 — Общее стехиометрическое уравнение
H2O2 + Fe 2+ ® Fe 3+ + OH — + OH × 4Fe 2+ + 4H + + O2 ® 4Fe 3+ + 2H2O
Fe 2+ + OH × ® Fe 3+ + OH —
Этот сложный путь оказывается тем не менее неизмеримо более выгодным,. Так как на одном из семи этапов не требуется встречи более чем двух частиц, и ни на одном из этапов не требуется соударение одноименно заряженных частиц. Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции.
Исходные, конечные и промежуточные вещества.
Вещества, вступающие в процесс химического превращения, называются исходными веществами. Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции. Вещества, образующиеся в одних стадиях процесса химического превращения и расходующегося в других стадиях этого же процесса, называют промежуточными веществами.
Глубина превращения реакции.
Характеризует степень превращения исходных веществ в конечные продукты реакции. Проведенные измерения привели химиков к убеждению, что, во-первых, все мыслимые реакции в какой-то степени происходят, и во вторых, не существует реакций, идущих полностью до конца. Однако, часто удобнее говорить, что одни реакции совсем не идут, другие идут в ограниченной степени, а третьи потребляют исходные вещества полностью.
Гомогенные и гетерогенные реакции.
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией.
Химическая реакция, протекающая на границах раздела фаз, называется гетерогенной химической реакцией.
Примером гомогенных реакции может служить любая реакция в растворе. Примером гетерогенной реакции может служить любая из реакций, идущих не поверхности твердого катализатора (гетерогенная каталитическая реакция).
Скорость химической реакции.
Важнейшей количественной характеристикой процесса химического превращения является скорость процесса. Понятие скорости характеризует количество вещества, вступающего в реакцию в единицу времени. Это определение однако, не совсем однозначно, ак как в реакции принимают участие в качестве исходных и промежуточных веществ и в качестве продуктов реакции также несколько веществ. Поэтому строго можно говорить не о скорости химического процесса вообще, а о скорости по некоторому компоненту. Изменение количества этого компонента принято выражать в числе молей N. Таким образом, для гомофазного химического процесса, идущего веществу называется изменение концентрации этого вещества в единицу времени. Пусть концентрация одного из реагирующих веществ 1 момент времени t1 равна С1, а в момент времени t2 равна С2. Тогда средняя скорость реакции ( ` V ) за промежуток времени t2 – t1 равна
Поскольку концентрация вещества (исходного) в процессе реакции убивает, то
C2 C1 и разность C2 – C1 имеет отрицательный знак, т.е. C2 – C1 = — D С. Отсюда
средняя скорость ` V = — ¾¾
Переходя к бесконечно малым изменениям можно отношение — ¾¾ заменить
на — ¾¾ ; В результате производная от концентрации по времени характеризует
dt мгновенную (истинную) скорость химической реакции:
Скорость химической реакции всегда является величиной положительной, отношение же dC/dt может иметь и положительное и отрицательное значение в зависимости от того представляет ли С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае dC/dt 0, но так как скорость должна быть положительной, перед производной ставят минус; во втором случае dc/dt > 0 и чтобы скорость реакции имела положительное значение берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид
V = + ¾¾ . Однако, необходимо учитывать, что измерение по
dt разным веществам скорости не равны, а пропорциональны одна другой. Например, в реакции синтеза аммиака
на каждый исчезающий моль N2 расходуется 3 моля H2 и образуется 2 моля аммиака. Соответствующие скорости реакции соотносятся, как 1: 3: 2.
Скорость реакции имеет размерность [концентр] × [время] -1 . В химической кинетике концентрацию чаще всего выражают в моль/л, а время в секундах . Отсюда скорость химической реакции выражается в моль × л -1 × с -1 .
8.6. Измерение скорости реакции
В химической кинетике широко используется графический метод изображения функциональных зависимостей. Кривая, изображающая зависимость концентрации какого-либо вещества от времени в ходе процесса химического превращения, носит название кинетической кривой. Крутизна кинетической кривой в каждый момент времени характеризует истинную скорость реакции в этот момент времени, т.к. наклон касательной в точке численно равен скорости:V = — dc/dt = tg a
Часто под кинетическими кривыми понимают и другие зависимости изменения какого-либо изменяющегося параметра в ходе химической реакции (изменение рН, электропроводности, показателя преломления, оптической плотности и т.д.). Однако расссчитывать скорость накопления или расходования какого-либо из компонентов реакции, исходя из такой кривой, можно лишь в том случае, если существует и известна однозначная зависимость, связывающая концентрация этого компонента с измеряемым свойством системы.
Порядок реакции и константа скорости реакции
Скорость химической реакции зависит от целого ряда факторов. При заданных внешних условиях (температура, давление, среда в которой проходит процесс скорость является функцией концентрации реагирующих веществ. Зависимость скорости реакции от концентрации реагирующих вещества описывается основным постулатом химической кинетики: скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, имеющихся в данный момент времени, возведенных в некоторые степени. Этот постулат вытекает из физически очевидного предположения о том, что реагируют те молекулы, которые сталкиваются. Известно, что число столкновений зависит от концентрации молекул, поэтому и скорость химической реакции должна определяться теми же факторами. Итак, можно записать для реакции:
А + В ® С + Д можно записать V = k[A] n 1 × B n 1 , где величины n принято называть порядком реакцию по веществу А и В и т.д. Сумму порядков реакции по всем реагирующим веществам называют порядком реакции.
Следует подчеркнуть, что величины n1 и n2 определяются только экспериментальным путем, т.к. для подавляющего большинства реакций порядки реакции по веществу не равнозначны стехиометрическим коэффициентом.
Порядок реакции – величина формальная. Он может быть положительным или отрицательным, целым или дробным, а также нулевым числом. Как было уже указано, порядок реакции определяется опытным путем, и его нельзя предсказать заранее, даже для формально простых реакций. Например, скорость реакции H2 + I2 = 2HI Согласно опытным данным может быть записана следующим образом: V = k[H2][I2], где порядок реакции по водороду и йоду равен единице, а порядок реакции в целом равен 1 + 1 = 2. В этом случае стехиометрическое уравнение правильно изображает элементарный акт реакции.
Однако, в большинстве сложных реакций, протекающих через несколько стадий, когда общее стехиометрическое уравнение не отражает действительного хода реакции показатели степени в уравнении скорости реакции не будут соответствовать стехиометрическим коэффициентам, т.е. закон действия масс для химических реакций выполняется лишь в некоторых частных случаях.
Можно утверждать, что стехиометрическое уравнение реакции устанавливающее пропорции реагентов и продуктов, не определяет механизма протекания этой реакции во времени. Это является причиной, по которой экспериментально найденный порядок не всегда согласуется с уравнением, описывающим реакцию.
Множитель k в уравнении, показывает с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных
1 моль/л, называют константой скорости химического процесса. Она не зависит от концентрации и характеризует лишь влияние природы реагирующих веществ на скорость их взаимодействия друг, с другом, т.е. константа скорости реакции является мерой реакционной способности молекул.
Размерность констант скорости реакции различного порядка легко получить из выражения для скорости реакции.
Нулевой порядок V = — ¾¾¾ = ko; ko = [c][t] -1
Первый порядок V = — ¾¾¾ = k1c; ko = [t] -1
Второй порядок V = — ¾¾¾ = k2c 2 ; ko = [c -1 ][t] -1
Константы скорости реакций разных порядков имеют разные размерности и, поэтому их сравнение не имеет смысла. Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, однако это еще не значит, что они являются тримолекулярными. Все же укажем
Молекулярность реакции определяется числом молекул, одновременно сталкивающихся и приводящим к химическим превращениям. Взаимодействие подобного рода носят название элементарного акта химического превращения, т.е. молекулярность реакции, в отличие от порядка реакции имеет вполне определенный физический смысл. Например, реакция: I2 = 2I – мономолекулярная, т.к. в ее основе лежит распад исходного вещества; реакция H2 + I2 = 2HI – бимолекулярная. Реакция 2NO + H2 = N2O + H2O является примером тримолекулярной реакции. Молекулярность более высокого порядка не встречается, т.к. одновременное столкновение четырех частиц почти невероятно.
В случае сложных реакций, протекающих в несколько стадий, нет смысла говорить о молекулярности реакции в целом, поскольку это понятие имеет отношение применимо только к отдельным стадиям.
Различие между молекулярностью и порядком реакции можно свести к следующему:
1) молекулярность реакции имеет вполне определенный физический смысл, а порядок реакции – величина формальная;
2) порядок реакции может принимать любые значения: целые, дробные и даже отрицательные, численные значения молекулярности ограничены лишь тремя цифрами 1,2,3.
3) Порядок реакции можно использовать для характеристики любых реакций (как сложных, так и простых), понятие “молекулярность” применимо только к элементарным актам химических превращений.
Количественные, соотношения между скоростью реакции и концентрации реагента.
В реакции первого порядка скорость реакции пропорциональна концентрации одного реагента
Для них V = — ¾¾¾ = k c
Для нахождения С в каждый момент времени t это уравнение необходимо проинтегрировать:
— ¾¾¾ = k c ¾¾¾ = k dt или после интегрирования:
ln c = — kt + const. Значение const находим из начального условия, из которых следует, что Со — начальная концентрация в момент времени t = 0. Определим постоянную., как ln Со. Отсюда ln с = — kt + lnCo; ln C — lnCo = — kt; ln C/Co = -kt
или k = 1/t ln ¾¾ ; заменим на десятичные логарифмы, получим k= ¾¾¾ lg ¾ .
Особенность реакции первого порядка заключается в том, что равным промежуткам времени отвечают равные доли Со/С прореагировавшего вещества. Время t, нужное для того, чтобы прореагировала половина Со, называется периодом полупревращения: подставляя в уравнение t1/2 = t и
С = Со/2, получим: t1/2 = ¾¾¾ , т.е. для реакции первого порядка период
K полупревращения t1/2 не зависит от начальной концентрации и служит характеристикой скорости таких реакций.
Реакция второго порядка
Выражение скорости для реакции второго порядка имеет вид: V = -dc/dt= k × c1 × c2 или V = — dc/dt = kc 2 ; Разделяя переменные, получим –dc/c 2 = k dt; После интегрирования получим: 1/c = kt + const; при Co и t = 0 определяем постоянную интегрирования, равную 1/С0. Отсюда 1/С = kt + 1/Co или 1/С – 1/Со = kt;
Период полупревращения для реакции второго порядка не остается постоянным, а обратно пропорционален начальной концентрации:
Уравнение скорости реакции третьего порядка.
Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, тем не менее это еще не значит, что они действительно тримолекулярные. Однако оно удобно для вывода кинетического уравнения:
V = — dc/dt = kc 3 ; После интегрирования получим
½ ( ¾¾ × ¾¾¾ ) = kt или ½ ( ¾¾¾ × ¾¾ ) = kt, если а — исходная
С 2 Со 2 ( а-х) 2 а 2
концентрация, (а-х) – количество вещества оставшегося ко времени t. Если реакция протекает по уравнению: 2А + В ® продукты и если [B] не равна [A], то интегрирование выражения для скорости реакции третьего порядка значительно усложняется
Уравнение скорости реакции нулевого порядка.
Если в уравнении скоростми отсутствуют члены, содержащие концентрацию реагирующих веществ, то скорость такой реакции выражается уравнением нулевого порядка.
Реакция нулевого порядка представляет особый интерес в каталитических процессах, когда катализатор, взятый в определенном количестве, может служить фактором, лимитирующим скорость реакции. Такая ситуация встречается в ферментативной кинетике и будет рассмотрена на следующей лекции.
Определение порядка реакции.
Порядок реакции играет существенную роль при изучении и раскрытии механизма реакции. Он в значительной степени зависит от механизма реакции. Порядок реакции определяется опытным путем и его нельзя предсказать заранее, даже для реакции формально похожих.
а) Для определения порядка реакции часто используют способ подстановки. Он заключается в выборе уравнения кинетики реакции (нулевого, первого, второго порядка) при подстановке в которое экспериментальных данных, получается постоянное значение константы скорости реакции.
б) Существует и графический способ определения порядка реакции. Например, для реакции нулевого порядка скорость реакции не зависит от концентрации. Для реакции первого порядка прямолинейной является зависимость ln C от времени. Для реакции второго порядка линейной будет зависимость 1/С от времени.
в) Используется также определение зависимости от концентрации константы полупревращения и т.д.
Теоретические основы химической кинетики.
В основе современной химической кинетики лежат две теории: теория активных соударений и теория активного комплекса.
Теория активных соударений была сформулирована С.Аррениусом в 1889 году. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ, а число соударений определяется интенсивностью теплового движения молекул, т.е. зависит от температуры. Но не каждое соударение молекул приводит к химическому превращению: к нему приводит лишь активное соударение. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называют энергетическим барьером реакции. Наглядное представление об энергетическом барьере реакции дает графическое изображение энергетики химической реакции.
В качестве абсциссы в этих диаграммах используется так называемая координата реакции. Вообще говоря, она является сложной функцией межатомных расстояний. Но для практических целей и простых молекул можно считать, что она характеризует изменение в межатомных расстояниях, которые происходят при сближении исходных молекул, образующих активированный комплекс, и взаимном удалении продуктов реакции при распаде активированного комплекса. По оси ординат откладывается потенциальная энергия всей системы.
То дополнительное количество энергии, которое нужно добавить к средней энергии молекул исходных веществ, чтобы соударение стало активным, называется энергией активации.
Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры. Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса: k = A × l -Ea/RT , где А – так называемое число “число соударений” представляет собой число соударений в одну секунду между одной молекулой вещества А и одной молекулой вещества В, заключенных в объеме в 1см 3 .
Однако, наблюдаемые константы скорости реакции, как правило, гораздо меньше, вычисленных по уравнению. Поэтому уравнение для константы скорости реакции видоизменяют следующим образом: k = P × Z × l -Ea/RT , где Z – теоретическое число столкновений, а Р – так называемый фактор вероятности или стерический, учитывает все влияния, вызывающие отклонения от идеального уравнения. Необходимость ориентации может заметно тормозить даже сравнительно простые реакции. Хорошо изученным примером является реакция: Н2 + I2 ® 2НI
Для того, чтобы простое соударение дало две молекулы йодистого водорода, надо, чтобы ориентация молекулы была сходна с той, которая изображена на рис.
Энергия активации этой реакции невелика, но скорость мала. Это связано с довольно жесткими требованиями, предъявляемыми к ориентации реагирующих молекул. Тогда А = РZ, т.е. А характеризует чсло соударений С благоприятной ориентацией и называется предэкспоненциальным множителем.
Используя уравнение Аррениуса, можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме:
ln k = lnA — Ea/R × 1/T или
Если построить график lg k от 1/Е, то получим прямую отсекающую на оси ординат отрезок, равный lg А и имеющую тангенс угла, равный – Еа/2,303R, т.е. tg a = — Еа/2,303R, откуда Еа = -2,303 R tg a
Из уравнения видно, что константа скорости реакции k является произведением двух сомножителей. Предэкспоненциальный множитель А практически не зависит от температуры, т.к. последняя не влияет на взаимную ориентацию молекул. Экспоненциальный множитель l -Ea/RT , который характеризует долю активных соударений от общего числа двойных соударений, сильно зависит от температуры. Теория двойных соударений внесла в химическую кинетику новые представления об активных соударениях и об энергии активации, но эта теория не рассматривала механизм самого соударения, что является ее недостатком.
Менее строгую зависимость константы скорости реакции от температуры в отличие от уравнения Аррениуса дает правило Вант-Гоффа, которое носит эмпирический характер. В 1884 г. Вант-Гофф установил, что при повышении температуры на 10 о С скорость большинства реакций увеличиатся в 2-4 раза. Математически эта зависимость выражается соотношением:
¾¾¾¾ = ¾¾¾¾ = g , где VT и kT – скорость и константа реакции при
VT kT температуре Т: g = 2 ¸ 4 — температурный коэффициент скорости реакции . В общем случае, если температура изменилась на D Т = Т2 – Т1, то уравнение принимает вид:
Следует отметить, что правило Вант-Гоффа можно использовать лишь в узких интервалах температур. Дело в том, что с повышением температуры g уменьшается и при очень высоких температурах может стать даже меньше единицы. В случае ферментативных реакций даже интервал в 10 о С может быть достаточно большим. Для того, чтобы не ошибиться рекомендуется при использовании g использовать более узкий интервал (2 о , 3 о , 5 о ) и полученные результаты приводить к величине
8.17. Теория активированного (переходного) комплекса (переходного состояния
Эта теория – простейший и исторический первый вариант статистической теории химических реакций. Она разработана Э.Вагнером, М.Поляни, Г.Эйрнингом и М.Эвансом в 30-ых годах двадцатого века.
8.18. Вывод основного уравнения теории переходного состояния.
В основу теории также пополнено представление о столкновении молекул как непременном условии реакции. Но она рассматривает то, что происходит в момент столкновения. Для реакции А+В = С в соответствии с теорией переходного состояния следует: А + В « х * ® С, где х * — переходной комплекс. Что подразумевается под переходным комплексом. После столкновения молекул А и В начинается перераспределение химических связей и образование переходного комплекса и переходной комплекс представляет такое состояние взаимодействующих молекул, когда старые связи еще не полностью разорвались, а новые еще не полностью сформировались. В результате мы имеем состояние промежуточное между А,В и С. Переходное состояние характеризуется непрерывным изменением расстояний между взаимодействующими атомами. В этом существенное отличие переходного комплекса от обычной молекулы, в которой средние расстояния между атомами не зависят от времени. Переходный комплекс также не следует путать с промежуточными веществами. Он является динамической структурой, для образования которой требуется затрата энергии. Энергия, необходимая для перевода реагирующих молекул в состояние переходного комплекса носит название энергии активации. Так как исходные молекулы еще не распались, то энергия перехода в активированное состояние меньше энергии разрыва связей в молекулах исходных веществ: Еа Едиссоциации. Таким образом, формирование переходного комплекса – процесс энергетически более выгодный, чем полный распад, вступающих в реакцию молекул. С другой стороны, превращение активированного комплекса в продукты реакции всегда является экзотермическим процессом.
1) Основной постулат теории переходного состояния состоит в том, что исходные вещества всегда находятся в равновесии с переходным комплексом.
В этом случае k химического равновесия переходного комплекса равна:
k * x.p. = ¾¾¾¾ и концентрация
Затем ПК распадается необратимо с образованием продукта С. (характеристикой (количественной) распада будет частота распада ПК – Р. Из статистической механики известно, что Р зависит только от температуры. Эта зависимость имеет вид: Р = kТ/h, где – постоянная Больцмана; h – постоянная Планка; Т – абсолютная температура. Значит, для данной температуры число Р одинаково для всех переходных состояний, а скорость любой химической реакции определяется лишь концентрации определяется лишь концентрации ПК:
Концентрация ПК связана с концентрацией реагентов и поэтому, подставив их выражения, получим:
К обычной реакции взаимодействия применим закон действия масс:
V = kv[А][B], символ kv употребляется для константы скорости в отличие от константы Больцмана. Приравняем правые части уравнений и получим:
Из уравнения видно, что при данной температуре константа скорости реакции зависит от константы химического равновесия образования ПК и от частоты распада ПК. Уравнение называется основным уравнением теории переходного состояния.
8.19. Термодинамическая форма основного уравнения теории переходного состояния.
Термодинамические данные позволяют связать kx.p. * со стандартной свободной энергией образования переходного комплекса D G ¹ , называемый также свободной энергией активации: D G’ ¹ = -RT ln k * x.p.
откуда k * x.p. = e — D G/RT
Тогда для константы скорости химической реакции можно записать
Из этого уравнения видно, что скорость реакции определяется свободной энергией активации D G ¹ , а не Еа, как это следует из теории активных соударений Аррениуса.
Поскольку D G ¹ = D Н ¹ — Т D S ¹ , то
k * x.p. = e — D S/R — D H/RT
или по теории переходного состояния kv равна:
kV = ¾¾ × × e — D S/R — D H/RT или
kV = ¾¾ × × e — D S/R × e — D H/RT
т.е. мы получили термодинамическую форму основного уравнения теории переходного состояния.
8.20. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса.
При сравнении уравнения для ТПС с уравнением Аррениуса видно, что
¾¾ × × e — D S/R соответствует А в уравнении Аррениуса.
Т.е. А = ¾¾ × × e — D S/R
Значит определив опытным путем А, можно рассчитать энтропию активации D S ¹ , которая дает важную информацию о механизме образования активированного комплекса. Например, чем более жестко связывается фермент с субстратом, т.е. образуется большее число связей, тем больше уменьшается D S ¹ . Величина D Н ¹ практически равна энергии активации и при сравнении с выражением получается, что kT ¹
Поскольку Z – теоретическое число столкновений и kT/h практически постоянны, вероятностный фактор Р будет, очевидно, связан с энтропией активации D S ¹ . Если она велика и положительна, то фактор Р велик, и реакция будет быстрой. Конечно, это вывод. Но если D S ¹ отрицательна и мала, то реакция будет медленной, т.е. чем больше возрастание энтропии, тем больше вероятность переходного состояния.
Поскольку kT/h соответствует Z и равно при 298К 6,3 × 10 -12 сек -1 , то это число равно числу активных комплексов, разлагающихся за одну секунду в одном см 3 или количеству соударений в 1 секунду в 1 см 3 .
Таким образом, скорость реакции, согласно теории переходного состояния, зависит от двух факторов.
1. Энергетический фактор — D Н ¹ , энтальпия активации. Чем больше энтальпия активации, тем меньше скорость реакции.
2. Энтропийный фактор — D S ¹ , энтропия активации. Чем больше энтропия активации, тем больше скорость реакции.
Учет энтропийного фактора для кинетики реакций во многих отношениях оказался плодотворным и впервые позволил установить связь константы скорости со строением молекул реагирующих веществ. При этом теория ПС оперирует, в частности, величинами расстояний между атомами в молекулах, взаимной ориентацией молекул. Т.е. параметрами геометрического характера.
Теория активных соударений позволяет при знании энергии активации рассчитать общее число эффективных соударений и отсюда скорость реакции, не объясняя механизма реакции. В отличие от теории активных соударений теория ПК сопоставляет различные возможные комплексы, выявляет большую или меньшую их достижимость и определяет в результате энергетически наиболее выгодный путь реакции.
Для вычисления скоростей взаимодействие двух атомов две теории дают одинаковые результаты. В случае нелинейных многоатомных молекул теория ПК дает значение скоростей отличных от значений, даваемой теорией соударений. Если известна конфигурация реагирующих молекул и активного комплекса, теория ПК позволяет рассчитать предэкспоненциальный множитель. К сожалению, в большинстве случаев строение активированного комплекса и его свойства неизвестны и это затрудняет расчеты.
Таким образом две теории дополняют друг друга. Теория ПК применяется для вычисления абсолютных скоростей электродных процессов, процессов диффузии и т.д. Теория активных соударений хорошо описывает, как правило, реакции в газовой среде.
Практичекая работа на тему «Скорость химических реакций»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Расчет скоростей химических реакций
Научиться рассчитывать величину скорости химической реакции, величину изменения скорости реакции в зависимости от различных факторов;
Пояснения к работе
Скорость химической реакции определяется как количество вещества , прореагировавшего в единицу времени в единице объема (для гомогенной реакций) или на единице площади поверхности раздела фаз (для гетерогенных реакций).
Если концентрация одного из продуктов реакции увеличилась от С 1 до С 2 за промежуток времени от t 1 до t 2 , то в соответствии с определе нием, скорость реакции равна:
Если концентрация одного из реагирующих веществ уменьшилась от С 2 до С 1 за промежуток времени от t 1 до t 2 , то в соответствии с определе нием, скорость реакции равна:
Знак «−» в правой части уравнения обозначает следующее. По мере протекания реакции ( t 2 — t 1 > 0) концентрация реагентов убывает, следовательно, С 2 — С 1 0, а так как скорость реакции всегда положительна, то перед дробью следует поста вить знак»-«.
Здесь С – молярная концентрация реагентов, которую выражают в моль/л,
соответственно, скорость реакции выражают в молъ/(л∙с).
Расчет средней скорости реакции.
Если известны величины концентрации какого-либо из реагирующих веществ в начальный момент времени и через определенный промежуток, то можно легко рассчитать среднюю скорость реакции. Для этого нужно воспользоваться определением скорости и соответствующей расчетной формулой:
определить среднюю скорость химической реакции А + В = D , протекающей в растворе, если известно, что исходная концентрация вещества В равнялась 1 моль/л. Через 10 минут концентрация вещества В уменьшилась до 0,25 моль/л.
Записываем краткое условие задачи и подставляем данные в расчетную формулу.
Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важней шими из них являются: концентрация, температура и присут ствие катализатора. Для гетерогенных реакций еще и площадь поверхности раздела фаз, так как реакция протекает именно на этой поверхности, а не во всем объеме системы.
Можно рассчитать, во сколько раз изменится значение скорости при изменении величин концентраций реагирующих веществ, при изменении температуры и при изменении площади поверхности для гетерогенных реакций.
Расчет зависимости скорости от концентрации
Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описы вается основным законом химической кинетики — законом действующих масс.
Скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих ве ществ.
Для реакции, записанной в общем виде
в соответствии с законом действующих масс зависимость скорости от концентрации реагирующих веществ может быть представлена в виде
Здесь k — коэффициент, не зависящий от концентрации, называемый константой скорости.
Гораздо реже реакция осуществляется путем столкновения трех реагирующих частиц. Например, реакция типа
может протекать по механизму тройных столкновений:
В этом случае, в соответствии с законом действия масс, можно записать
Одновременное столкновение более чем трех частиц крайне маловероятно. Поэтому реакции, в уравнения которых входит большое число частиц, протекают в несколько стадий. Показатели степеней в выражении закона действующих масс в случае сложных реакций определяются экспериментально.
При расчетах используются молярные концентрации веществ, находящихся в растворе или в газовой фазе. В случае гетерогенных реакций концентрации веществ в твердой фазе обычно не изменяются в ходе реакции и поэтому не включаются в выражение закона действующих масс.
Для того, чтобы определить, во сколько раз изменится скорость реакции при известном изменении концентрации, пользуются арифметическим приемом: делят одну величину на другую.
Приведенные расчеты справедливы только для простых реакций, протекающих в одну стадию
Во сколько раз увеличится скорость реакции 2А + В = D , если концентрацию вещества А увеличить в 3 раза, а концентрацию вещества В не изменять.
http://www.sites.google.com/site/1bio1med1/home/immunologia/ekologia/biomembranes-and-cell-architecture/pervoe-nacalo-termodinimiki-/vtoroe-nacalo-termodinamiki-i-ego-primenenie-/trete-nacalo-termodinamiki-rascety-izmenenia-entropii-pri-razlicnyh-processah-/himiceskij-potencial-/himiceskoe-ravnovesie-v-geterogennyh-i-gomogennyh-sistemah-/rastvory-elektrolitov-/osnovnye-ponatia-himiceskoj-kinetiki
http://infourok.ru/praktichekaya-rabota-na-temu-skorost-himicheskih-reakciy-2803249.html