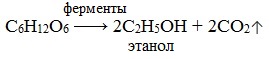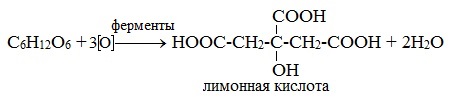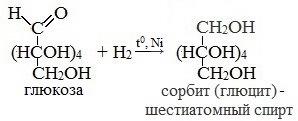Доказательство наличия гидроксильных групп в глюкозе уравнение реакции
Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
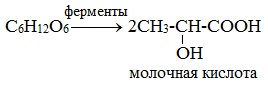
2) Молочнокислое брожение
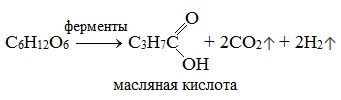
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
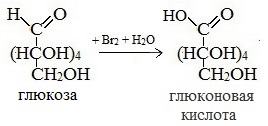
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
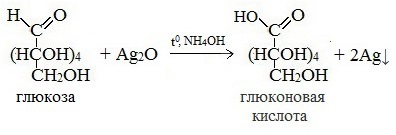
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
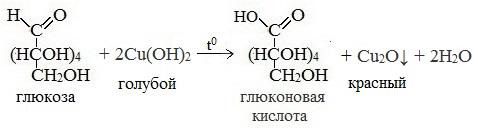
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
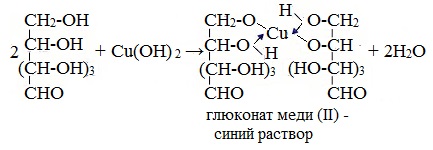
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
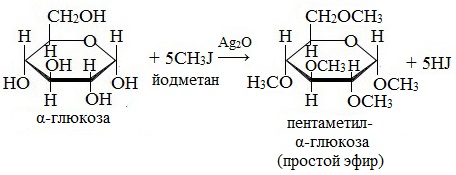
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
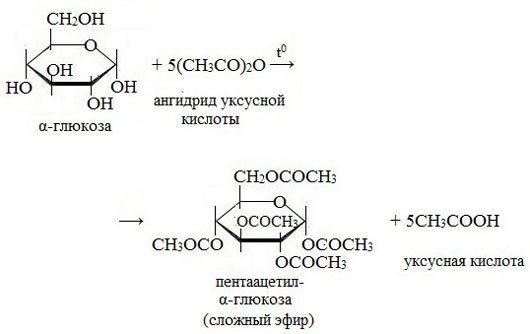
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
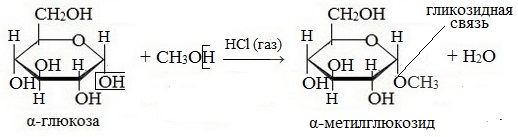
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
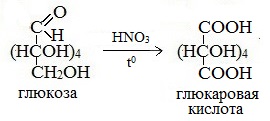
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Опыты по химии. Углеводы
Доказательство наличия гидроксильных групп в сахарозе
Докажем, что в состав молекулы сахарозы входят гидроксильные группы.
Прильем к раствору сахарозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае сахароза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Продукт реакции – сахарат меди (II).
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН)4 – СОН + Ag2O = СН2ОН – (СНОН)4 – СООН + 2Ag↓
Реакцию серебряного зеркала используют в промышленности для серебрения зеркал, изготовления колб для термосов, елочных украшений.
Оборудование: колба круглодонная, горелка, стакан, штатив, прокладка огнезащитная.
Техника безопасности. Аммиачный раствор оксида серебра нельзя хранить. После опыта неиспользованный раствор нейтрализуют соляной кислотой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз крахмала
В присутствии кислот крахмал гидролизуется. При гидролизе крахмала образуется глюкоза. Экспериментально проверим это. Прокипятим смесь крахмального клейстера и серной кислоты. Полноту гидролиза будем проверять с реакцией с йодом. Гидролиз проводится до тех пор, пока реакция с йодом не станет отрицательной, т. е. проба раствора не будет давать с йодом синего окрашивания. Проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор. Выпадает красный осадок оксида меди (I).
(С6Н10О5)n + n Н2О = n С6 Н12О6
Мы доказали, что при гидролизе крахмала образовалась глюкоза.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, штатив, стакан, прокладка огнезащитная.
Техника безопасности. Соблюдать правила работы с растворами кислот.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз сахарозы
В присутствии кислот дисахариды гидролизуются. При гидролизе сахарозы образуется глюкоза и фруктоза. Экспериментально проверим это. Прокипятим смесь растворов сахарозы и серной кислоты. Через несколько минут проверим наличие глюкозы в полученном растворе.
Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе сахарозы образовалась глюкоза.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, штатив, стакан, прокладка огнезащитная.
Техника безопасности. Соблюдать правила работы с растворами кислот.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз целлюлозы
При кислотном гидролизе целлюлозы образуется глюкоза. Проведем гидролиз в присутствии серной кислоты. В фарфоровой ступке разотрем вату с концентрированной серной кислотой. Полученную смесь разбавим водой и перенесем в стакан. Прокипятим смесь. Через несколько минут проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе целлюлозы образовалась глюкоза. Кислотный гидролиз целлюлозы имеет важное промышленное значение. Брожением полученной глюкозы получают этиловый спирт.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, фарфоровая ступка с пестиком.
Техника безопасности. Соблюдать правила работы с концентрированными кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление глюкозы кислородом воздуха в присутствии метиленового голубого
Окисление глюкозы до глюконовой кислоты особенно легко протекает в щелочной среде в присутствии индикатора метиленового голубого. В колбе с водой растворим гидроксид натрия. Добавим туда глюкозу и затем немного раствора метиленового голубого. Через некоторое время раствор становится бесцветным. Перемешаем раствор. Он вновь окрашивается в голубой цвет.такие изменения окраски можно наблюдать много раз подряд. Под действием щелочи в водной среде глюкоза дегидрируется, превращаясь в глюконовую кислоту.
В отсутствии метиленового голубого отщепляющийся при дегидрировании водород окисляется кислородом воздуха очень медленно и реакция практически не идет. Метиленовый голубой присоединяет водород, превращаясь в бесцветное соединение. Это бесцветное соединение окисляется кислородом воздуха в метиленовый голубой, и вновь появляется голубая окраска. В процессе реакции индикатор практически не расходуется. Он является типичным катализатором окисления глюкозы до глюконовой кислоты.
Оборудование: шпатель, плоскодонная колба с пробкой.
Техника безопасности.
Соблюдать правила работы со щелочами и их растворами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Определение глюкозы в виноградном соке
Многие фрукты и ягоды содержат глюкозу. Определить наличие глюкозы можно с помощью гидроксида меди (II). Из ягоды винограда выжмем сок. Прильем к соку несколько капель раствора сульфата меди (II) и раствор щелочи. Нагреем раствор. Цвет раствора начинает изменяться. При кипячении раствора образуется желтый осадок Cu2O, который постепенно превращается в красный осадок CuO. Это доказывает наличие глюкозы в виноградном соке.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Отсутствие восстанавливающей способности сахарозы
Экспериментально проверим отсутствие альдегидной группы у сахарозы. Приготовим сахарат меди (II). В пробирку с раствором сахарозы добавим раствор сульфата меди (II), воду и раствор щелочи. Образуется ярко синий сахарат меди (II). Раствор сахарата меди (II) нагреваем до кипения. Красного осадка оксида меди (I) не образуется. Следовательно, сахароза не имеет в своем составе свободную альдегидную группу и не обладает восстанавливающими свойствами.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение и свойства нитроцеллюлозы
Целлюлоза с азотной кислотой образует азотнокислые эфиры. Эфиры получают действием на целлюлозу смесью безводной азотной кислоты и концентрированной серной кислоты. Целлюлоза в нашем опыте — хлопковая вата.
Приготовим такую смесь и опустим в нее кусочек ваты. Через 15 минут процесс нитрования целлюлозы заканчивается. Промоем полученную нитроцеллюлозу водой. Высушим. Нитроцеллюлоза при поджигании быстро сгорает. Нитроцеллюлоза используется для приготовления бездымного пороха.
Оборудование: стакан, палочка, фильтровальная бумага, мерная пробирка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила работы с концентрированными кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Растворение целлюлозы в аммиачном растворе гидроксида меди (II)
Целлюлоза нерастворима в воде и в большинстве растворителей. Однако в аммиачном растворе гидроксида меди (II) целлюлоза растворяется хорошо. Продемонстрируем это. В концентрированный аммиачный раствор опускаем небольшие порции ваты. Вата хорошо растворяется в данном растворе. Получается густой вязкий раствор целлюлозы в аммиачном растворе гидроксида меди (II). Раствор целлюлозы используют в промышленности для получения медноаммиачного шелка.
Оборудование: пробирка или стакан, стеклянная палочка.
Техника безопасности. Соблюдать правила работы с концентрированным раствором аммиака.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Реакция крахмала с иодом
Крахмал дает с иодом характерное синее окрашивание. С помощью иода можно открыть самые незначительные количества крахмала. К разбавленному раствору крахмала добавляем немного раствора иода (используем раствор Люголя: 1 часть иода, 2 части иодида калия, 17 частей дистиллированной воды). Появляется синее окрашивание. Нагреваем синий раствор. Окраска постепенно исчезает, так как образующееся соединение неустойчиво. При охлаждении раствора окраска вновь появляется. Данная реакция иллюстрирует обратимость химических процессов и их зависимость от температуры.
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Опыт безопасен.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Работа 27. Доказательство наличия гидроксильных групп в глюкозе
Выполнение работы:к 0,5 мл 1%-ного раствора глюкозы прибавляют 3 мл 10%-ного раствора гидроксида натрия и 3 — 4 капли 1%-ного раствора сульфата меди (II). Образующийся вначале осадок гидроксида меди (II) растворяется и образуется прозрачный раствор глюкозата меди (II) темно — синего цвета.
| Cu |
Н-С-ОН Н-С-О
глюкоза глюкозат меди
Аналогичный результат дают другие моносахариды. Образуются соответствующие сахараты меди (II), которые по структуре являются хелатными соединениями.
Работа 28. Реакция окисления глюкозы гидроксидом меди (II)
(реакция Троммера)
Выполнение работы: в пробирку наливают 1 мл 1%-ного раствора глюкозы, добавляют 1 мл 10%-ного раствора гидроксида натрия и 5 капель 1%-ного раствора сульфата меди (II) до появления исчезающей при встряхивании мути. Смесь взбалтывают и нагревают верхний слой до кипения, но не кипятят. Наблюдается появление желтого осадка гидроксида меди (I), переходящего в осадок оранжево – красного цвета оксида меди (I).
Необходимо помнить, что избыток гидроксида меди (II) при длительном кипячении дает оксид меди(II) черного цвета, а при недостатке Cu(OH)2 — из глюкозы образуются продукты осмоления. Все это маскирует истинный оранжевый цвет осадка оксида меди (I).
глюкоза глюконовая кислота
Все альдозы дают положительную реакцию Троммера, при этом образуются соответствующие гликоновые кислоты.
Заметим, что реакция окисления с Cu(OH)2 характерна как для альдоз, так и для кетоз, так как в щелочной среде в присутствии окислителя углеродные цепи молекул кетоз могут расщепиться с образованием веществ, которые тоже окисляются и дают осадок характерного цвета.
Дата добавления: 2014-12-16 ; просмотров: 1707 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://www.yoursystemeducation.com/opyty-po-ximii-uglevody/
http://helpiks.org/1-84382.html