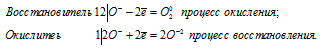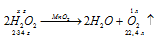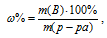Допишите уравнение реакции разложения пероксида водорода и расставьте необходимые коэффициенты: H2O2 = … + …
Пероксид водорода разлагается на воду и кислород:
H2O2 → H2O + O2↑
В правой части схемы у нас 3 атома кислорода: один в молекуле воды и два в молекуле кислорода. В левой части – два атома кислорода в молекуле перекиси. Казалось бы, наименьшее кратное – шесть. Но! В правой части 3 атома кислорода не в одной молекуле, а в двух разных (1+2). Поэтому у молекулы перекиси мы поставим коэффициент два:
2H2O2 → H2O + O2↑
Теперь очевидно, что уравнять схему можно добавив коэффициент два перед молекулой воды:
Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н + , а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н + + 2 
На аноде: 2HSО4 — — 2 
или 2H2SO4 = H2S2O8 + 2H + + 2
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 
На аноде: 2HSО4 — — 2 
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
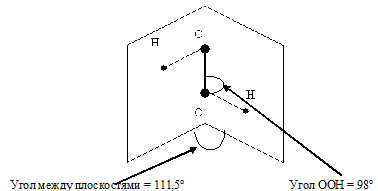
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
4О — = О2 0 + 2О 2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10 -3 м 3 . Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Опыт 5 ПОЛУЧЕНИЕ КИСЛОРОДА ИЗ ПЕРОКСИДА ВОДОРОДА. Химия 10 класс Гузей Л.С., Суровцева Р.П. ГДЗ.
Опыт 5
ПОЛУЧЕНИЕ КИСЛОРОДА
ИЗ ПЕРОКСИДА ВОДОРОДА
Задания.
1. Для получения кислорода из пероксида во-
дорода проведите реакцию его каталитического разложения.
2. Напишите уравнение проведенной реакции, объяс-
ните наблюдаемые явления.
Опыт 5
Получение кислорода из пероксида водорода
Результат: 1) уравнение реакции: 2Н2O2 → 2Н2O + O2↓.
2) При внесении порошка МnO2 происходит бурное выделение газа.
Тлеющая лучина загорается при ее поднесении к раствору. Оксид мар-
ганца является в данной реакции катализатором, т.е. он резко увели-
чивает скорость реакции разложения пероксида водорода.
http://buzani.ru/zadachi/khimiya-glinka/1264-peroksid-vodoroda-zadachi-797-801
http://class.rambler.ru/temy-gdz/opyt-5-poluchenie-kisloroda-iz-peroksida-vodoroda-himiya-10-klass-guzey-l-s-surovceva-r-p-gdz-39273.htm