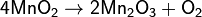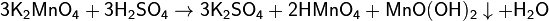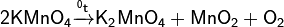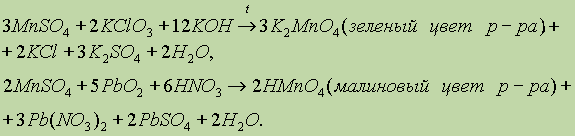Оксиды и гидроксиды марганца
Получение марганца
Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
Химические свойства
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Оксиды и гидроксида марганца
| Оксиды | MnO | Mn2O3 | MnO2 | (MnO3) | Mn2O7 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | Сильно кислотные |
| Гидроксиды | Mn(OH)2 | Mn(OH)3 | Mn(OH)4 H2MnO3 | H2MnO4 | HMnO4 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | сильно кислотные |
| Названия | гидроксид марганца (II); солиMn(II) | гидроксид марганца (III); солиMn(III) | гидроксид марганца (IV); манганаты(IV) | Марганцевая (VI) кислота; манганаты(VI) | марганцевая (VII)кислота;перманганаты |
Оксиды и гидроксиды марганца
Соединения марганца (II).Оксид и гидроксид марганца (II) проявляют только основные свойства. Они нерастворимы в воде, но легко растворяются в кислотах с образованием солей двухвалентного марганца.
Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат.
В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны.
Гидроксид двухвалентного марганца образуется косвенным путём – действием щёлочи на растворы солей. В момент образования образуется белый осадок (чаще наблюдаемый как телесный), который на воздухе постепенно буреет под действием кислорода воздуха:
Оксид марганца (II) MnO — твердое вещество зеленого цвета — можно получить восстановлением оксида марганца (IV) в токе водорода:
MnO2+Н2=MnO+Н2О
MnO — типичный основной оксид, с водой в реакцию не вступает. Ему соответствует гидроксид марганца (II), Mn(ОН)2, представляющий собой слабое основание. В виде осадка телесного цвета выпадает при взаимодействии щелочей с солями марганца (II):
MnСl2+2NaOH=Mn(OH)2¯+2NaCl
Mn(OH)2+2HCl=MnСl2+2H2O
Соли марганца (II), как правило, хорошо растворимы в воде, кроме Mn3(PO4)2, MnS, MnCO3.
Соединения марганца (III).Соли трёхвалентного марганца окрашены в тёмный цвет и склонны к образованию комплексных солей (ацидокомплексов). Все соли марганца (III) малоустойчивы. В кислом растворе они легко восстанавливаются до солей марганца (II). В нейтральном растворе простые соли легко гидролизуются с образованием гидроксида Mn(III), который быстро переходит на воздухе в гидроксид марганца (IV). Гидроксид марганца (III) –Mn2O3 ּН2О или MnО(OH) встречается в природе в виде минерала манганита(бурая марганцевая руда).
• В природе встречаются минералы браунит, курнакит и биксбиит — оксид марганца с различными примесями.
• Окисление оксида марганца(II):
• Восстановление оксида марганца(IV):
Соединения марганца (IV).Оксид Mn(IV) наиболее устойчивое при обычных условиях кислородное соединение марганца.MnO2 и соответствующий ему гидроксид практически нерастворимы в воде.
Получение оксида марганца 4:
· В лабораторных условиях получают термическим разложением перманганата калия.
· но реакция, в действительности, следует по уравнению:
· Также можно получить реакцией перманганата калия с пероксидом водорода.
· При температуре выше 100 °C перманганат калия восстанавливается водородом:
Химические свойства
1)При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2) Хлорид марганца(II) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (по этой реакции в лабораториях получают хлор)
3) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (реакция идет при сплавлении)
Гидроксид марганца (IV) проявляет амфотерный характер– кислотный и основной в равн Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:
Соединения марганца (VI).Оксид шестивалентного марганца в свободном виде не выделен. Гидроксид марганца (VI) проявляет кислотный характер. свободная марганцевая (VI) кислота неустойчива и диспропорционирует в водном растворе по схеме:
Манганаты (VI) образуются при сплавлении диоксида марганца со щёлочью в присутствии окислителей и имеют изумрудно-зелёную окраску. В сильно щелочной среде манганаты (VI) довольно устойчивы. При разбавлении щелочных растворов происходит гидролиз, сопровождающийся диспропорционированием:
Манганаты (VI) – сильные окислители, восстанавливающиеся в кислой среде доMn(II), а в нейтральной и щелочной средах – доMnO2. Под действием сильных окислителей манганаты (VI) могут быть окислены доMn(VII):
При нагревании выше 500 о С манганат (VI) распадается на продукты:
манганат (IV) и кислород:
Соединения марганца (VII).Оксид марганца (VII) – Mn2O7 выделяется в виде темно-зеленой маслянистой жидкости при действии концентрированной серной кислоты на перманганат калия:
Оксид марганца (VII) устойчив до 10 о С и разлагается со взрывом по схеме:
При взаимодействии Mn2O7с водой образуется марганцовая кислотаHMnO4, которая имеет фиолетово-красную окраску:
Безводную марганцовую кислоту получить не удалось, в растворе она устойчива до концентрации 20 %. Это очень сильная кислота, кажущаяся степень диссоциации в растворе концентрации 0,1 моль/дм 3 равна 93 %.
Марганцовая кислота – сильный окислитель.Еще энергичнее взаимодействуетMn2O7, горючие вещества при соприкосновении с ним воспламеняются. Оксид марганца(VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия:
1)Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
2) При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
3) Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :

4) Перманганат калия применяется как антисептическое средство. Водные растворы его различной концентрации от 0,01 до 0,5% применяются для дезинфекции ран, полоскания горла и других антивоспалительных процедурах. Успешно 2 – 5% растворы перманганата калия употребляются при ожогах кожи (кожа подсушивается, и пузырь не образуется). Для живых организмов перманганаты являются ядами (вызывают коагуляцию белков). Их обезвреживание производят 3 %-ным раствором Н2О2, подкисленным уксусной кислотой:
5)Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
7) Все соли марганца (II) в ОВР, протекающих в растворах, являются восстановителями:
8) Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
9) Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия
Применение цветов:
Химия, 8 класс, параграф 32, 8 вопрос. Рудзитис и Фельдман — какие из этих реакций могут быть?
Привет, вот эти уравнения и само задание
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным ( Подробнее. )
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). ( Подробнее. )
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). ( Подробнее. )
Задание 36 Окислительно-восстановительные реакции (стр. 2 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
в нейтральной среде Mn+4
в щелочной среде Mn+6
(соль той кислоты, которая участвует в реакции) MnSO4, MnCl2
Манганат (K2MnO4 или KNaMnO4, Na2MnO4) —
Окислительно-восстановительные свойства соединений марганца в различных средах
Марганец – элемент 4 периода VII группы подгруппы В. Электронная формула атома марганца:
В соединениях марганец способен проявлять степени окисления от +2 до +7. Наиболее устойчивыми являются соединения, в которых степень окисления марганца равна +2, +4, +7.
Соединения марганца (II)
MnO — оксид марганца (II), Mn(OH)2 – гидроксид марганца (II).
MnO – кристаллы зеленовато – серого цвета.
Эти соединения проявляют окислительно – восстановительную двойственность, но у них восстановительные свойства преобладают.
На воздухе гидроксид марганца (II) быстро темнеет, окисляясь в гидроксид марганца (IV):

2 Mn+2 — 2е → Mn+4 — окисление
1 O20 + 4е → 2O-2 — восстановление
Под действием более сильных окислителей соли марганца (II) превращаются в соединения марганца (VII):
2Mn+2SO4 + 5Pb+4O2 + 6HNO3 = 2HMn+7O4 + 2PbSO4 + 3Pb+2(NO3)2 + H2O

5 Pb+4 + 2e → Pb+2 — восстановление
В сильнощелочной среде соли марганца (II) превращаются в соединения марганца (VI):
Mn+2SO4 + 2KN+5O3 + 4KOH = K2Mn+6O4 + 2 KN+3O2 + K2SO4 + 2H2O

2 N+5 + 2е → N+3 — восстановление
С сильными восстановителями соединения марганца (II) проявляют окислительные свойства:
Mn+2Cl2 + Mg0 = Mn0 + Mg+2Cl2

1 Mg0 — 2е → Mg+2 — окисление
Соединения марганца (IV)
MnO2 —диоксид марганца (IV), Mn(OH)4 — гидроксид марганца (IV).
MnO2 – твердое вещество серо — черного цвета, в природе минерал пиролюзит.
Амфотерные соединения, обладают окислительно – восстановительной двойственностью.
При взаимодействии соединений марганца (IV) с сильными окислителями образуются производные Mn(VI) и Mn(VII).
Например, в щелочной среде образуются манганат ионы MnO4 2-:
3Mn+4O2 + KCl+5O3 + 6 KOH = 3K2Mn+6O4 + KCl-1 + 3H2O

1 Cl+5 + 6e → Cl-1 — восстановление
В кислой среде – продуктами окисления являются перманганат ионы MnO4-:
2Mn+4O2 + 3Pb+4O2 + 6HNO3 = 2HMn+7O4 + 3Pb+2(NO3)2 + 2H2O

3 Pb+4 + 2e → Pb+2 — восстановление
4Mn+4O2 + 3Cl20+ 8KOH → 2KMn+7O4 + 6KCl-+ 4H2O

3 Cl20 +2e → 2Cl — — восстановление
При растворении MnO2 в концентрированной соляной кислоте образуется хлорид марганца (II) и выделяется хлор:
Mn+4O2 + 4HCl-(конц) = Mn+2Cl2 + Cl20↑ + 2H2O
 |
1 Mn+4 +2e → Mn+2 — восстановление
1 2Cl — -2e → Cl20 — окисление
При нагревании в концентрированной серной кислоте MnO2 образует сульфат марганца (II) c выделением кислорода:
2Mn+4O2 -2 + 2H2SO4(конц) = 2Mn+2SO4 + O20↑ + 2H2O
 |
2 Mn+4 +2e → Mn+2 — восстановление
1 2O-2 — 4e → O20 — окисление
В кислой среде MnO2 проявляет сильные окислительные свойства:
2Mn+4O2 + 2Fe+2SO4 + 2H2SO4 = Mn+2SO4 + Fe2+3(SO4)3 + 2H2O
1 Mn+4 +2e → Mn+2 — восстановление
1 2Fe+2 — 2e → 2Fe+3 — окисление
Соединения марганца (VII)
Mn2O7 — неустойчивое соединение, зеленовато – черная маслянистая жидкость, при слабом нагревании оно разлагается со взрывом на оксид марганца(IV) и кислород:

4 Mn+7 + 3e → Mn+4 — восстановление
3 2O-2 — 4e → O20 — окисление
Mn2O7 – cильнейший окислитель, он поджигает любые горючие вещества, при контакте с ним они воспламеняются:
2Mn2+7O7 + C2-2H5OH = 4Mn+4O2 + 2C+4O2 + 3H2O

1 C2-2 — 6e → C+4 — окисление
Mn2O7 — кислотный оксид, который взаимодействует с основаниями, основными оксидами, водой соответственно с образованием солей и марганцoвой кислоты:
Mn2O7 + 2KOH = 2KMnO4 + H2O
KMnO4 — наиболее важная соль марганцовой кислоты, представляет собой темно – фиолетовые кристаллы. KMnO4 является очень сильным окислителем, причем в зависимости от рН среды образуются разные продукты восстановления KMnO4.
Степень восстановления перманганат – ионов в различных средах можно представить схематично:




2KMn+7O4 + 16HCl-(конц) = 2Mn+2Cl2 + 2KCl + 5Cl20 + 8H2O

2 Mn+7 + 5e → Mn+2 — восстановление
5 2Cl — -2e → Cl20 — окисление
2KMn+7O4 + Н2О + 3К2S+4O3 = 2Mn+4O2↓ + 3K2S+6O4 + 2KOH

2 Mn+7 + 3e → Mn+4 — восстановление
3 S+4 — 2e → S+6 — окисление
2KMn+7O4 + 3К2S+4O3 + KOH = K2Mn+6O4 + K2S+6O4 + H2O

1 S+4 — 2e → S+6 — окисление
Соли тех кислот, которые участвуют в реакции: CrCl3, Cr2(SO4)3
K3[Cr(OH)6] в растворе, K3CrO3 или KCrO2 в рас-плаве
ПОВЫШЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ХРОМА И МАРГАНЦА
Cr2O3, Cr(OH)3, со-ли, гидроксоком-плексы
+ очень сильные окислители: а)KNO3, кислородсодержащие соли хлора (в щелочном рас-плаве)
б) Cl2, Br2, H2O2 (в щелочном растворе)
Щелочная среда: образуется ХРОМАТ K2CrO4
+ очень сильные окислители в кислой среде (HNO3 или CH3COOH): PbO2, KBiO3
Кислая среда: образуется ДИХРОМАТ K2Cr2O7 или ДИХРОМОВАЯ КИСЛО-ТА H2Cr2O7
Mn+2,+4 – оксид, гид-роксид, соли
+ очень сильные окислители: KNO3, кислородсодержащие соли хлора (в расплаве)
+ очень сильные окислители в кислой среде (HNO3 или CH3COOH): PbO2, KBiO3
Кислая среда: Mn+7 KMnO4- перманганат HMnO4 — марганцевая ки-слота
Окислительно – восстановительные свойства соединений хрома в различных средах
http://class.rambler.ru/temy-gdz/himiya-8-klass-paragraf-32-8-vopros-rudzitis-i-feldman-kakie-iz-etih-reakciy-mogut-byt-11360.htm
http://pandia.ru/text/80/305/66281-2.php