Допишите возможные уравнения реакций c6h6 kmno4
Опубликовано 11.06.2017 по предмету Химия от Гость >>
Ответ оставил Гость
Считаю, что окис-я кумол (изопропилбензол) C6H5-CH(CH3)2:
5C6H5-CH(CH3)2 + 18KMnO4 + 27H2SO4 = 5C6H5-COOH + 10CO2 + 9K2SO4 + 18MnSO4 + 42H2O, электронный баланс:
C-1 -4e- = C+3
2C-3 -14e- = 2C+4 | 18 | 90 | 5 |
Mn+7 +5e- = Mn2+ | 5 | | 18 |;
C6H5-CH(CH3)2 -18e- + 6H2O = C6H5-COOH + 2CO2 + 18H+
(MnO4)- +5e- + 8H+ = Mn2+ + 4H2O;
5C6H5-CH(CH3)2 + 18(MnO4)- + 54H+ = 5C6H5-COOH + 10CO2 + 18Mn2+ + 42H2O.
Задания для самостоятельного решения.
Допишите уравнения реакций, расставьте коэффициенты.
2. Полное окисление и горение. В качестве окислителей используются кислород (другие вещества, поддерживающие горение, например оксиды азота), концентрированные азотная и серная кислота, можно использовать твердые соли, при нагревании которых выделяется кислород (хлораты, нитраты, перманганаты и т.п.), другие окислители (например, оксид меди (II)). В этих реакциях наблюдается разрушение всех химических связей в органическом веществе. Продуктами окисления органического вещества являются углекислый газ и вода.
2.Мягкое окисление.В этом случае не происходит разрыва углеродной цепи. К мягкому окислению относится окисление спиртов до альдегидов и кетонов, окисление альдегидов до карбоновых кислот, окисление алкенов до двухатомных спиртов (Реакция Вагнера), окисление ацетилена до оксалата калия, толуола – до бензойной кислоты и т.д. В качестве окислителей в этих случаях используются разбавленные растворы перманганата калия, дихромата калия, азотной кислоты, аммиачный раствор оксида серебра, оксид меди (II),гидроксид меди (II).
3.Деструктивное окисление. Происходит в более жестких условиях, чем мягкое окисление, сопровождается разрывом некоторых углерод-углеродных связей. В качестве окислителей используются более концентрированные растворы перманганата калия, дихромата калия при нагревании. Среда этих реакций может быть кислой, нейтральной и щелочной. От этого будут зависеть продукты реакций.
Деструкция (разрыв углеродной цепи)происходит у алкенов и алкинов – по кратной связи, у производных бензола – между первым и вторым атомами углерода, если считать от кольца, у третичных спиртов – у атома, содержащего гидроксильную группу, у кетонов – у атома при карбонильной группе.
Если при деструкцииоторвался фрагмент, содержащий 1 атом углерода, то он окисляется до углекислого газа (в кислой среде), гидрокарбоната и (или) карбоната (в нейтральной среде), карбоната (в щелочной среде). Все более длинные фрагменты превращаются в кислоты (в кислой среде) и соли этих кислот (в нейтральной и щелочной среде). В некоторых случаях получаются не кислоты, а кетоны (при окислении третичных спиртов, разветвленных радикалов у гомологов бензола, у кетонов, алкенов).
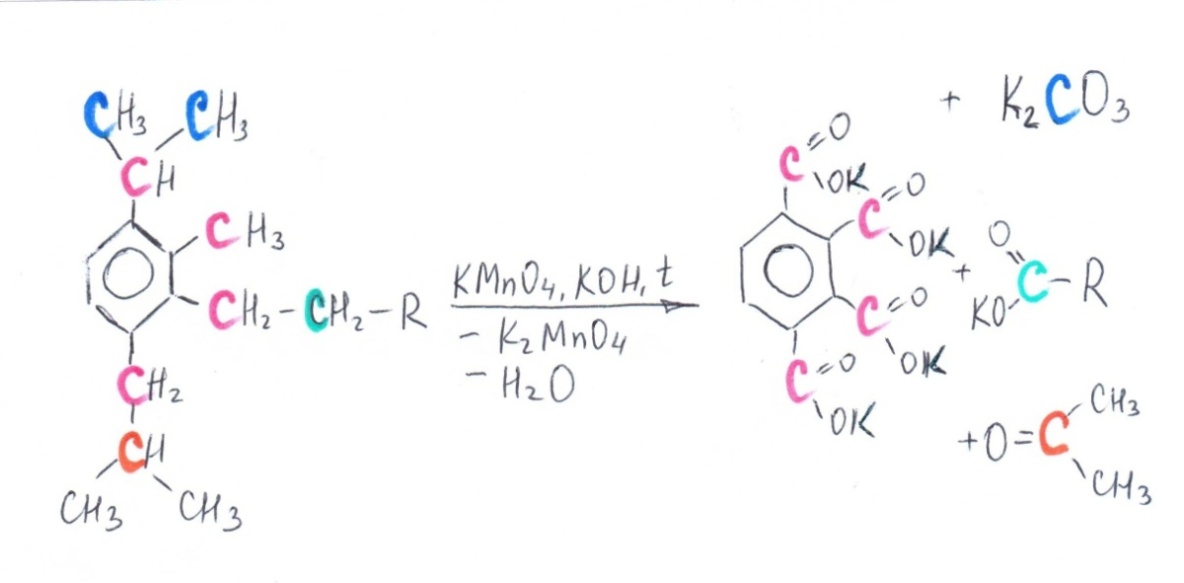
Ниже в схемах представлены возможные варианты окисления производных бензола в кислой и щелочной среде. Разными цветами выделены атомы углерода, участвующие в окислительно-восстановительном процессе. Выделение цветом позволяет проследить «судьбу» каждого атома углерода.
Окисление производных бензола в кислой среде
Схема 2. Окисление производных бензола в щелочной среде
Несколько сложнее составить уравнение реакции окисления в нейтральной среде. Точно определить, какие продукты получатся, можно только при расстановке коэффициентов. Рассмотрим последовательно такой случай.
Пример 4. Окисление фенилацетилена водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по тройной связи, образуется бензоат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3. Кстати, при расстановке коэффициентов может выясниться, что воду нужно перенести в правую часть уравнения:
С6Н5—С≡СН + KMnO4 + H2O®С6Н5—СООК + MnO2 + KOH+ КНСО3
С 0 –3е®С +3
С -1 –5е®С +4 83 восстановитель
Mn +7 + 3е ®Mn +4 8 окислитель
Ставим коэффициенты из баланса перед углеродом и марганцем:
3С6Н5—С≡СН + 8KMnO4 + H2O®3С6Н5—СООК + 8MnO2 + KOH+3КНСО3
После этого уравниваем калий:
3С6Н5—С≡СН + 8KMnO4 + H2O®3С6Н5—СООК + 8MnO2 + 2KOH+3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
2KOH+3КНСО3®2К2СО3 + КНСО3+ 2H2O, изменим продукты реакции:
3С6Н5—С≡СН + 8KMnO4 + H2O®3С6Н5—СООК + 8MnO2 + 2К2СО3 + КНСО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 18 без учета воды, следовательно, воду нужно перенести в правую часть:
3С6Н5—С≡СН + 8KMnO4 ®3С6Н5—СООК + 8MnO2 + 2К2СО3+ КНСО3+ H2O
Пример 5. Окисление бутена-1 водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по двойной связи, образуется пропионат калия, оксид марганца (IV), остальные продукты пока не ясны, запишем КОН и КНСО3.
CH3-CH2—CH=CH2 + KMnO4 + H2O®С2Н5—СООК + MnO2 + KOH+ КНСО3
С -1 –4е®С +3
С -2 –6е®С +4 103 восстановитель
Mn +7 + 3е ®Mn +4 10 окислитель
Ставим коэффициенты из баланса перед углеродом и марганцем:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O®3С2Н5—СООК + 10MnO2 + KOH+ 3КНСО3
После этого уравниваем калий:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O®3С2Н5—СООК + 10MnO2 + 4KOH+ 3КНСО3
Учитывая то, что кислая соль нейтрализуется щелочью:
4KOH+3КНСО3®3К2СО3 + КOH+ 3H2O, изменим продукты реакции:
3CH3-CH2—CH=CH2 + 10KMnO4 + H2O®3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 24 без учета воды, следовательно, воду нужно перенести в правую часть:
3CH3-CH2—CH=CH2 + 10KMnO4 ®3С2Н5—СООК + 10MnO2 + KOH+ 3К2СО3 + 4H2O
Задание 36 Окислительно-восстановительные реакции (стр. 6 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
a. Окисление метилбензола перманганатом калия:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5С6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O

6 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5C7H8 + 10H2O + 6MnO4- + 48H+ → 5 C7H6O2 + 30H+ + 6Mn2+ +24H2O
б. Окисление этилбензола перманганатом калия:
5C6H5CH2-СН3 +12KMnO4 +18H2SO4 → 5С6H5COOH +5СО2 +12MnSO4+6K2SO4+28H2O

12 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5С8Н10 + 20H2O + 12MnO4- + 96H+ → 5С6H5COOH + 5СО2 + 60H+ + 12Mn2+ + 48H2O
в. Окисление стирола перманганатом калия:
С6Н5-СН═СН2 + 2KMnO4 + 3H2SO4 → С6H5COOH + СО2 + 2MnSO4 + K2SO4 + 4H2O

2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
С8Н8 + 4Н2О + 2MnO4- + 16H+ → С6H5COOH + СО2 + 10Н+ + 2Mn2+ + 8H2O
а. Окисление метилбензола перманганатом калия:
C6H5CH3 + 6KMnO4 + 7KOH → С6H5COOK + 5H2O + 6K2MnO4

6 MnO4- + e → MnO42- — восстановление
 |
C7H8 + 7OH — + 6MnO4- → C6H5COO — + 5H2O + 6 MnO42-
C6H5CH2 — СН3 + 12KMnO4 + 15KOH → С6H5COOK + К2СО3 + 12K2MnO4 + 10H2O

12 MnO4- + e → MnO42- — восстановление
 |
С8Н10 + 15OH — + 12MnO4- → C6H5COO — + СО32- + 10H2O + 24MnO42-
в. Окисление стирола перманганатом калия:
С6Н5-СН═СН2 + 10KMnO4 +13КОН →С6H5COOK + К2СО3 + 10K2MnO4 + 8H2O

10 MnO4- + e → MnO42- — восстановление
С8Н8 + 13OH — + 10MnO4- → C6H5COO — + СО32- + 8H2O + 10MnO42-
а. Окисление метилбензола перманганатом калия:
C6H5CH3 + 2KMnO4 → С6H5COOK + 2MnO2 + KOH + H2O

2 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
C7H8 + 7OH — + 2MnO4- + 4H2O → C6H5COO — + 5H2O + 2MnO2 + 8OH-
б. Окисление этилбензола перманганатом калия:
C6H5CH2 — СН3 + 4KMnO4 → С6H5COOK + К2СО3 + 4MnO2 + KOH + 2H2O

4 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
С8Н10 + 15OH — + 4MnO4- + 8H2O → C6H5COO — + СО32- + 10H2O + 4MnO2 + 16OH —
в. Окисление стирола перманганатом калия:


3 С8Н8 + 2OH — — 2е → С8Н8(ОН)2 — окисление
2 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
3С8Н8 + 6OH — + 2MnO4- + 4H2O → 3 С8Н8(ОН)2 + 2MnO2 + 8OH-
Окисление спиртов производят сильными окислителями KMnO4 или K2Cr2O7 в присутствии серной кислоты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
а. Окисление этанола:

H
5 C2H6O — 2e → C2H4O + 2H+ — окисление
2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
5C2H6O + 2MnO4- + 16H+ → 5C2H4O + 10H+ + 2Mn2+ + 8H2O
б. Окисление пропанола – 2:


5 C3H8O — 2e → C3H6 + 2H+ — окисление
2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
5C3H8O + 2MnO4- + 16H+ → 5C3H6 + 10H+ + 2Mn2+ + 8H2O
C избытком окислителя (KMnO4 или K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные — до кетонов. Третичные спирты не окисляются, а метанол окисляется до углекислого газа.
5СН3-СН2-ОН + 4KMnO4 + 6H2SO4 → 5СН3СООН + 4MnSO4 + 2K2SO4 + 11H2O
Двухатомные спирты окисляются до двухосновных карбоновых кислот.
5НО-СН2-СН2-СН2-ОН + 8KMnO4 + 12H2SO4 →
Альдегиды – сильные восстановители, поэтому легко окисляются при нагревании различными окислителями KMnO4 , K2Cr2O7 или [Ag(NH3)2]OH. Формальдегид с избытком окислителя окисляется до углекислого газа.
а. Окисление аммиачным раствором оксида серебра — качественная реакция на альдегиды
СН3С+1ОН + 2[Ag+1(NH3)2]OH → СН3С+3ООNH4 + 2Ag0 ↓ + H2O + 3NH3↑

2 Ag+1 + 1e → Ag0 — восстановление
б. Окисление перманганатом калия в кислой среде:
5СН3-СН2-СОН+2KMnO4 + 3H2SO4→5СН3-СН2-СООН +2MnSO4 + K2SO4 + 3H2O

2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5С3Н6О + 5Н2О + 2MnO4- + 16H+ → 5С3Н6О2 + 10Н+ + 2Mn2+ + 8H2O
в. Окисление перманганатом калия в щелочной среде:
СН3-СН2-СОН + 2KMnO4 + 3КОН → СН3СООК + 2K2MnO4 + 2H2O

2 MnO4- + e → MnO42- — восстановление
C2H4O + 3OH — + 2MnO4- → CH3COO + 2H2O + 2MnO42-
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl2 =CO2 
HCOOH+ Cl2 = CO2 
HOOC-COOH+ Cl2 =2CO2 
Все моносахариды — восстанавливающие сахара. Для них характерна реакция «серебряного зеркала».
а. Окисление глюкозы аммиачным раствором оксида серебра:
СН2ОН-(СНОН)4-С+1ОН + 2[Ag+1 (NH3)2]OH →

2 Ag+1 + 1e → Ag0 — восстановление
б. Окисление глюкозы фелинговой жидкостью:
СН2ОН-(СНОН)4-С+1ОН + Cu+2(OH)2 → СН2ОН-(СНОН)4-С+3ОOН + Cu2+1O + 2H2O

2 Cu+2 + 1e → Cu+1 — восстановление
в. Окисление глюкозы перманганатом калия в кислой среде:
5C6H12O6 + 24KMnO4 + 36H2SO4 → 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O

24 MnO4 — + 8H+ + 5e → Mn2+ + 4H2O — восстановление
C6H12O6 + 6О 2 → 6СО2 + 6Н2О
д. Брожение глюкозы:
Брожение – сложный процесс расщепления моносахаридов под влиянием различных микроорганизмов.
· спиртовое брожение: C6H12O6 → 2С2Н5ОН + 2СО2↑
· молочнокислое брожение: ферменты


· маслянокислое брожение: C6H12O6 → С3Н7СООН + 2СО2 ↑ + 2Н2↑


е. Восстановление глюкозы:
Все моносахариды при восстановлении образуют многоатомные спирты.
СН2ОН-(СНОН)4-С+1ОН + Н20 → СН2ОН-(СНОН)4-С-1 Н2OН+1

1 Н20 — 2е → 2 Н+1 — окисление

http://lektsii.org/15-36712.html
http://pandia.ru/text/80/305/66281-6.php