Расчет электродного потенциала. Уравнение Нернста
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:
1) от природы веществ – участников электродного процесса;
2) от соотношения между концентрациями этих веществ;
3) от температуры системы.
Значения электродных потенциалов рассчитывают по уравнению Нернста:
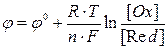
где 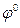
96500 Кл/моль; [Ox] и [Red] – молярные концентрации веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
Для металлического электрода уравнение Нернста принимает вид:
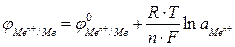
где n – число электронов, теряемых атомом металла при образовании катиона; 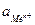
Для обычной при электрохимических измерениях стандартной температуры (Т = 25ºС или 298 К) и при подстановке значений постоянных величин уравнение (2) принимает вид:
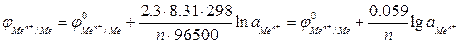
Окислительно — восстановительный потенциал
Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe 2+ = Mg 2+ + Fe
- Mg + 2H + = Mg 2+ + H2
- Mg + Cu 2+ = Mg 2+ + Cu
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
ОCНОВНЫЕ ПОНЯТИЯ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ЗАКОНЫ ФАРАДЕЯ.
Одним из важнейших элементов внутренней цепи является граница раздела электрод-ионный проводник. На этой границе возникает так называемый двойной электрический слой, характеризуемый сложным взаимодействием металла с компонентами раствора, которое приводит к скачку потенциала, который называют электродным потенциалом. Величина этого скачка потенциала зависит от природы электрода, состава электролита и температуры. Абсолютное значение электродного потенциала определить нельзя, но можно измерить разность потенциалов между двумя электродами. Такой электродный потенциал принято обозначать 
Ox + n 

Электродный потенциал в отсутствии тока в цепи при равновесии потенциалопределяющей реакции называется равновесным и обозначается 




В электрохимии общепринятой является водородная шкала потенциалов, в которой за нуль принят потенциал стандартного водородного электрода при 298 К; 


Потенциалопределяющей на таком электроде является реакция
2H + (p) + 2 

Значения стандартных потенциалов электродов в водных растворах при 298 К, определенные по водородной шкале представлены в таблице 1 Приложения.
Значения равновесных потенциалов для условий, отличительных от стандартных, рассчитывают по уравнению Нернста, которое в общем случае для потенциалопределяющей реакции (1.1) имеет вид:

где – R – универсальная газовая постоянная, 8,31Дж/моль . К; n – число электронов, принимающих участие в реакции (равно числу моль эквивалентов в моль вещества); F – число Фарадея, 96500 Кл/моль-экв (26,8А . ч/моль-экв); T – температура, К.
Существует 3 различных типов электродов: 1) металлические (металлы в растворе собственных ионов); 2) газовые (на основе Pt в растворе электролита, через который пропускает соответствующий газ); 3) окислительно-восстановительные (инертный электрод в растворе, содержащей окисленную и восстановленную формы в ионном виде – редокс-электроды).
Для металлических электродов потенциалопределяющей является реакция :
M(р) n + + n 

Уравнение Нернста для расчета потенциала металлического электрода, поскольку активность твердой фазы принимают равной единице, имеет вид:

Для 298 К, переходя к десятичному логарифму, имеем

Для водородного электрода потенциалопределяющая реакция (1.2), уравнение Нернста запишем в виде:

Поскольку, как указано выше, 


Газовый кислородный электрод представляет собой Pt – электрод, на котором осуществляется потенциалопределяющая реакция
О2 + 4 

Уравнение Нернста для такого электрода запишется в виде:

Стандартный потенциал кислородного электрода 





Законы Фарадея. Количественно электрохимические превращения веществ подчиняются двум законам Фарадея:
1) масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо пропорционально количеству прошедшего электричества;
2) при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны молярным массам их эквивалентов. Из этого следует, что для электрохимического превращения 1 моль эквивалента вещества требуется одинаковое количество электричества F, называемое числом Фарадея.
Оба эти закона можно объединить следующими выражениями:
— для массы вещества: 
— для объема газообразных веществ: 
где МЭ – молярнаямасса эквивалента вещества, г/моль, 
VЭ – объем моль-эквивалента газа, л/моль; 
Q – количество электричества, прошедшего через систему, Кл,

( При нормальных условиях (н.у.) 1 моль любого газа занимает объем



Количество моль-эквивалентов веществ, испытавших электрохимические превращения на катоде и аноде, выраженные в моль-эквивалентах, равны между собой
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальваническим элементом (ГЭ) называется электрохимическая система, в которой химическая энергия превращается в электрическую.
Рис. 1.1. Схема гальванического элемента
Представленный на рисунке 1.1. ГЭ состоит из двух электродов 1 (катода К и анода А), погруженных в растворы собственных солей (2) и разделенных диафрагмой (3) проницаемой для ионов. Электроды через внешнюю цепь (4) соединены между собой металлическими проводниками.
При разомкнутой цепи в ГЭ на обоих электродах устанавливается равновесие, характеризуемое величиной соответствующих равновесных электродных потенциалов (ЭП). Разность равновесных ЭП катода и анода называется электродвижущей силой ГЭ:

Разность стандартных ЭПназывается стандартной ЭДС ГЭ:


При замыкании цепи равновесие нарушается, во внешней цепи возникает самопроизвольное направленное движение электронов от анода – электрода с меньшим потенциалом, к катоду – электроду с большим потенциалом.
Электродные реакции, например, для серебряно-цинкового элемента записываются следующим образом:


Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag + → 2Ag + Zn 2+ , (2.3).
Электродвижущая сила элемента связана с энергией Гиббса ТОР 

где п — количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:
bB + dD → lL + mM, (2.5),
протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса 

Таким образом стандартную ЭДС ГЭ можно определить двумя способами:
— первый способ по уравнению 
— второй способ по уравнению (2.1а), используя табличные значения стандартных потенциалов.
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:

где аВ, аD, аL , aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР (2.5). Для твердых веществ активности принимают равными единице.
Максимальная электрическая работа ГЭ определяется соотношением 

В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (DEК) и анода (DЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)

Поляризацией называется изменение потенциала электрода при прохождении электрического тока: 
Зависимость потенциала электрода от тока графически изображается поляризационной кривой. В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U. Поляризационные кривые ГЭ представлены на рисунке 1.2.
Рис. 1.2. Поляризационные кривые ГЭ.
Пример 1.1.Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение.Выпишем из таблицы 1 приложения значения стандартных электродных потенциалов Zn и Ag:


Т.к. 
1 способ: рассчитаем 

2 способ: по уравнению (2.6) рассчитываем

По уравнению 2.4 : 
Значения 
Пример 1.2.Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn 2+ и Ag + равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.1. Рассчитаем величины электродных потенциалов.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов (уравнение 1.4 а):



При одинаковой активности потенциалопределяющих ионов в данном ГЭ согласно уравнению Нернста, изменение анодного потенциала больше, чем катодного, ЭДС элемента меньше, чем стандартная ЭДС.
Пример 1.3.Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.2.
Решение. Анодом ГЭ является цинковый электрод. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:
Максимально вырабатываемая электроэнергия 
Пример 1.4.Рассчитайте ЭДС цинк-хлорного ГЭ, если 


Решение.
Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn 2+ + 2 


Для потенциалопределяющей реакции Cl2(газ) + 2 


Так как 

А — : Zn – 2 
К + : Cl2 + 2 
ТОР: Zn + Cl2 → Zn 2+ + 2Cl –
Вычислим значения ЭДС ГЭ: 
Увеличить ЭДС данного ГЭ можно, если: увеличить температуру; уменьшить активность ионов Zn 2+ ; уменьшить активность ионов Cl – ; увеличить парциальное давление Cl2 .
Пример 1.5. Рассчитайте ЭДС щелочноговодородно-кислородного ГЭ, работающего при одинаковых давлениях 

Решение.Для кислой среды уравнения электродных реакций в концентрационном элементе:
А — : H2 +2ОН — → 2Н2О + 2
К + : 1/2О2 + 2 

Величина равновесного потенциала этих электродов определяется по уравнению:



Для кислотноговодородно-кислородного топливного элемента:
на аноде: H2 — 2 
на катоде: 1/2О2 + 2H + + 2 


Электролизом называются электрохимические процессы прямого (непосредственного) преобразования электрической энергии в химическую, протекающие на электродах под действием постоянного тока. Под действием электрического поля беспорядочное движение ионов в электролите превращается в направленное: положительно заряженные ионы (катионы) перемещаются к отрицательному электроду – катоду, отрицательно заряженные ионы (анионы) движутся к положительному электроду – аноду.
При электролизе катод подсоединяется к отрицательному полюсу внешнего источника тока, а анод – к положительному. На катоде ( К – ) происходят процессы восстановления: положительные ионы или нейтральные молекулы принимают электроны и переходят в восстановленную форму. На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители. На аноде (А + ) могут окисляться анионы, нейтральные молекулы и сам материал анода. Анод может быть растворимым, т.е. окисляться в условиях электролиза, и инертным, нерастворимым, т.е. не участвовать в анодном процессе. К растворимым или частично растворимым анодам относятся Zn, Cu, Fe, Cd, Ag, Ni, Co и т.д., к нерастворимым – Pt, Pd и некоторые другие благородные металлы в определенных условиях, а также графит С. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом.
Для того, чтобы правильно определить процессы электролиза, необходимо рассмотреть ионный состав электролита и определить равновесные потенциалы возможных процессов. Для расчета равновесных потенциалов возможных процессов, используется уравнение Нернста. Если не указаны конкретные условия, то для оценочной характеристики процессов используются стандартные потенциалы материала анода 





При относительно малом отличии равновесных потенциалов (менее 0,8 ¸ 1,0 В) на электродах возможно параллельное протекание нескольких процессов. Если на электроде идут одновременно несколько процессов, то доля количества электричества, пошедшего на каждый из процессов, называется выходом по току (Вj ):

где Qj – количество электричества, пошедшее на конкретный процесс;
Q – общее количество электричества, прошедшее через электрохимическую систему.
Сложные кислородсодержащие ионы, такие как SO4 2- , NO3 — , PO4 3- и др. из водных растворов на аноде не окисляются, т.к. обладают существенно более положительным потенциалом разряда, чем гидроксид-ион OH – .
Ионы элементов (приложение 1, табл. 1), обладающие высоко отрицательным электродным потенциалом (Al 3+ , Na + и др.) из водных растворов на катоде не восстанавливаются. Их разряд на катоде возможен только из расплавов соответствующих солей или из неводных растворов.
Количество вещества, испытавшего электрохимические превращения на электродах, рассчитывается по закону Фарадея.
При электролизе в результате прохождения через систему постоянного электрического тока происходит поляризация электродов (DЕК, DЕА): потенциал анода становится более положительным, а потенциал катода – более отрицательным и возникает омическое падение напряжения на внутреннем сопротивлении электрохимической цепи R (DЕом = R . I). Поэтому напряжение ( U ), которое необходимо подать на электроды от внешнего источника постоянного тока, больше минимальной разности потенциалов (Umin), равной разности равновесных потенциалов процессов :

Ход поляризационных кривых при электролизе показан на рис. 3.1. :
|
|
Рис. 3.1. Поляризационные кривые при электролизе.
Пример 3.1. Рассмотрите электролиз расплава соли хлорида лития LiCl на нерастворимых Pt-электродах. Рассчитайте минимальную разность потенциалов Umin электролиза. Напишите уравнения электродных процессов.
Решение. Запишем ионный состав электролита:
и стандартные потенциалы электродных процессов:
К — : 
A + : 

K — : Li + + 
A + : 2Cl — → Cl2 + 2 
Данный электролиз можно использовать для получения лития и хлора.
Пример 3.2. Определите минимальную разность потенциалов Umin , которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение. Запишем уравнения диссоциации раствора электролита
КОН → К + + ОН — ; H2O 
и определим равновесные потенциалы возможных электродных процессов:
К — : 

А + : 
Так как Е 0 К + /К значительно отрицательнее 
Минимальная разность потенциалов для электролиза данного раствора:

Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):


Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Пример 3.3. Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2 .
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Определим потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
К — : 

т.к. 

A + : 

т.к. 

K — : Cu 2+ + 2 
A + : 2H2O → O2 + 4H + + 4
2Cl — → Cl2 + 2 
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
 |
Рис. 3.2. Поляризационные кривые процесса электролиза водного раствора хлорида меди на нерастворимых электродах.
Определим массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:



По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):


Суммарное количество электричества, прошедшее через анод, равно:

Такое же количество электричества на катоде (QК = QА) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:

Определим выход по току (Bj) для всех процессов электролиза:



Пример 3.4. Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного в примере 3.3.?
Решение. Ионный состав раствора электролита таков же, как в примере 3.3., поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди.
Потенциалы возможных процессов на аноде:





K — : Cu 2+ + 2 
A + : Cu → Cu 2+ + 2 
При больших напряжениях электролизера U , могут быть достигнуты 


Благодаря растворению под действием тока медного анода запас ионов Cu 2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (пр. 3.3.).
Рис. 3.3. Поляризационные кривые процесса электролиза водного раствора хлорида меди на медных электродах.
Пример 3.5. Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
H2O 
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н + , раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Определим равновесные потенциалы возможных процессов на аноде и катоде:
К — : 


т.к. 


Таким образом, на электродах протекают следующие процессы:
K — : Pb 2+ + 2e → Pb
A + : H2O → O2 + 4H + + 4 
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде:



По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):



Суммарное количество электричества, прошедшее через катод:

Определим выход по току (Bj) для всех процессов электролиза:





Рис. 3.4. Поляризационные кривые процесса электролиза водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах.
Пример 3.6. Рассмотрите процесс рафинирования никеля, содержащего примеси цинка и меди в водном растворе H2SO4. Какие процессы будут протекать на аноде и катоде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение. Рафинирование – очистка металла от примесей с помощью электролиза. На аноде растворяются основной металл и примеси, потенциал которых отрицательнее основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал.
Анод – очищаемый металл Ni с примесями Zn и Cu. Ионный состав раствора электролита: H + , SO4 2- , OH — . Запишем равновесные потенциалы возможных электродных процессов при рН = 2:





Так как 

Запишем уравнения электродных процессов:
А + : Zn → Zn 2+ + 2e
K — : 2H + + 2e → H2
Время, необходимое для рафинирования, рассчитаем по закону Фарадея ( 

4. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называют самопроизвольное разрушение металлических материалов под действием компонентов окружающей среды. В результате коррозии протекает суммарная окислительно-восстановительная реакция взаимодействия металла с окислителем:
При этом происходит окисление металла и разрушение металлоконструкций.
Для металла именно окисленное состояние является те
http://zadachi-po-khimii.ru/obshaya-himiya/okislitelno-vosstanovitelnyj-potencial.html
http://poisk-ru.ru/s43388t8.html








