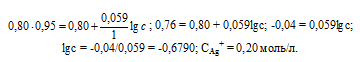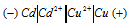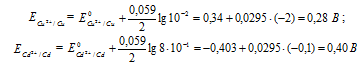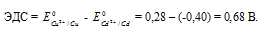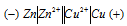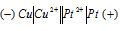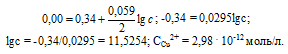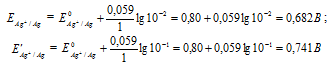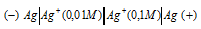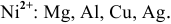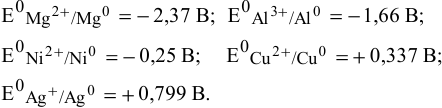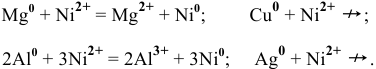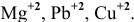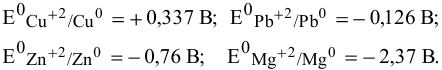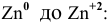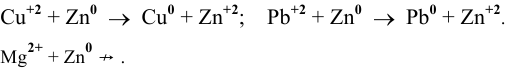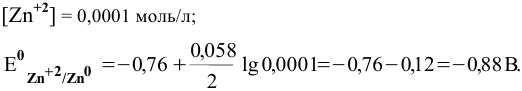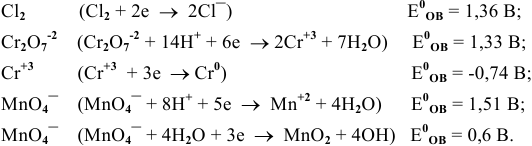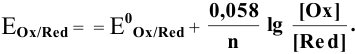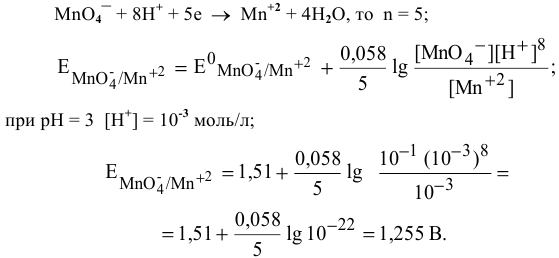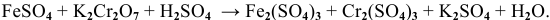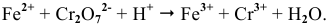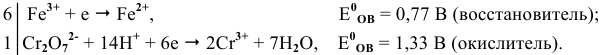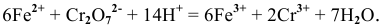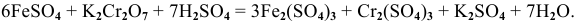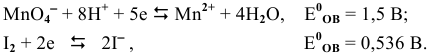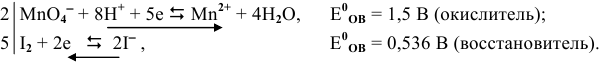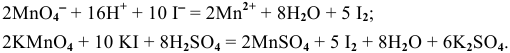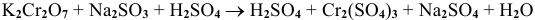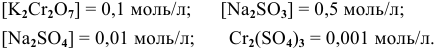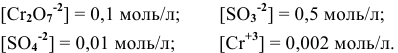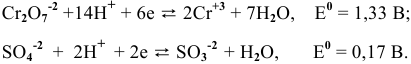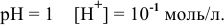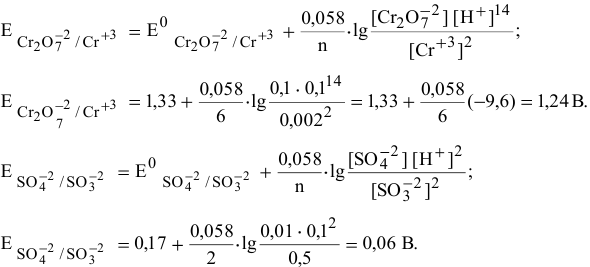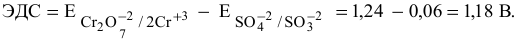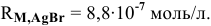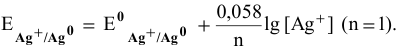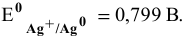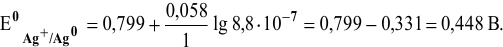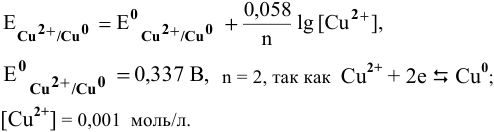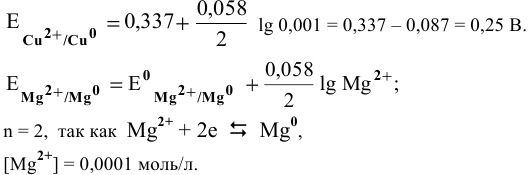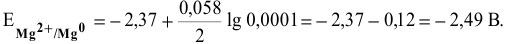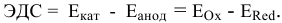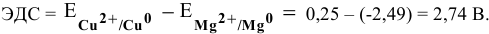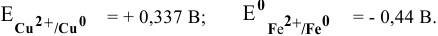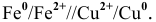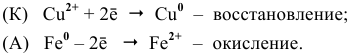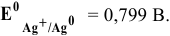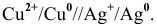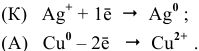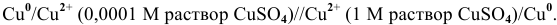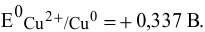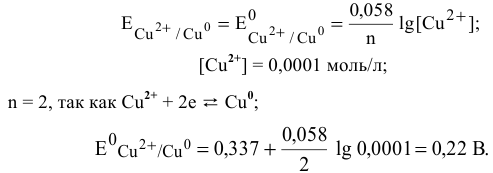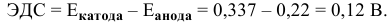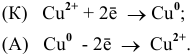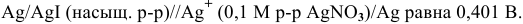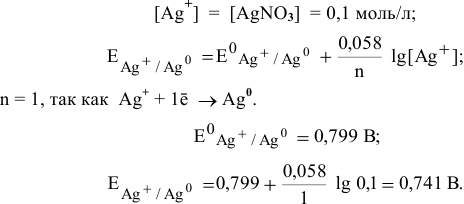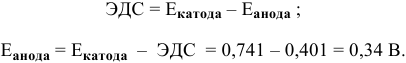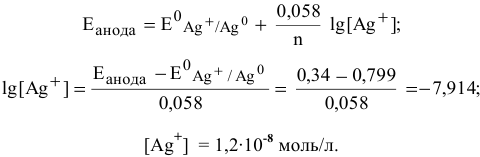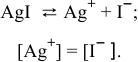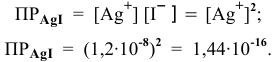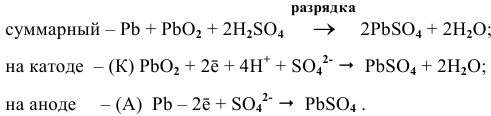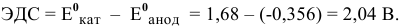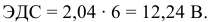Решение задач с использованием уравнения Нернста (Nernst)
Решение задач по химии с использованием уравнениея Нернста
Задание 246.
Потенциал серебряного электрода в растворе АgNO3 составил 95% от значения его стандартного электронного потенциала. Чему равна концентрация ионов Аg+ (моль/л). Ответ: 0,20 моль/л.
Решение:
Электродный потенциал металла (Е)зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Используя уравнение Нернста, получим выражение для расчета концентрации ионов Ag + в растворе:
Ответ: 0,20 моль/л.
Задание 247.
Составьте схему, напишите электронные уравнения электродных процессов, и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Сd 2+ ] = 0,8 моль/л, а [Сu 2+ ] = 0,01 моль/л. Ответ: 0,68 В.
Решение:
Схема данного гальванического элемента:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Кадмий имеет меньший потенциал (—0,403 В) и является анодом, на котором протекает окислительный процесс:
Cd 0 — 2 
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Cd 0 + Cu 2+ = Cd 2+ + Cu 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 молы/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
Ответ: 0,68 В.
Задание 248.
Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором медь является катодом:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Zn 0 + Cu 2+ = Zn 2+ + Cu 0
б) Схема гальванического элемента, в котором медь является анодом:
Медь имеет меньший потенциал (+0,34 В) и является анодом, на котором протекает окислительный процесс:
Cu 0 — 2 
Платина, потенциал которой +1,19 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Pt 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Сu 0 + Pt 2+ = Cu 2+ + Pt 0
Задание 249.
При какой концентрации ионов Сu 2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 2,98 . 10 -12 моль/л..
Решение:
Определим концентрацию ионов Cu 2+ , при которой потенциал медного электрода равен 0,00 В, получим:
Ответ: 2,98 . 10 -12 моль/л.
Задание 250.
Какой гальванический элемент называют концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
Решение:
Гальванический элемент, работа которого основана на различных концентрациях ионов металла у катода и у анода, называется концентрационным. Обычно катод и анод сделаны из одного и того же металла, опущенных в растворы своей соли разной концентрации. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы серебряных электродов при разных концентрациях ионов серебра Ag+, получим:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Задачи с решениями на электрохимические расчеты
Химические источники постоянного тока. электрохимические расчеты
Пример 92
Среди перечисленных ниже металлов найти те, которые могут восстановить катион никеля
Решение:
Выпишем значения стандартных электродных потенциалов данных металлов:
Так как 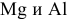
Пример 93
Среди перечисленных ниже катионов металлов найти те, которые могут окислить цинк:
Решение:
Согласно ряду напряжений металлов
Свинец и медь имеют стандартные электродные потенциалы выше, чем цинк.
Таким образом, катион меди и катион свинца являются окислителями более сильными, чем катион цинка, и будут окислять
Пример 94
Как изменится восстановительная активность цинка, если его погрузить (при Т = 298 К) в раствор нитрата цинка с концентрацией 0,0001 моль/л ?
Решение:
Воспользуемся формулой Нернста:
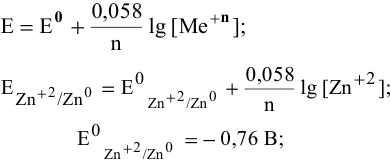
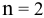
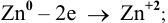
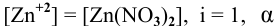
Вывод. С разбавлением раствора восстановительная активность возрастает, так как электродный потенциал понижается.
Пример 95
Среди приведенных ниже частиц укажите наиболее сильный окислитель. Эти частицы участвуют в следующих полуреакциях:
Решение:
Самый сильный окислитель тот, который обладает наибольшим значением редокс-потенциала 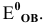
Пример 96
Рассчитать редокс-потенциал полуреакции:
если стандартный 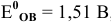
Решение:
Воспользуемся формулой Нернста для расчета редокс-потенциалов:
Так как уравнение электродной полуреакции —
Вывод. В условиях, отличающихся от стандартных, окислительная способность аниона 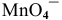
Пример 97
Определить, можно ли окислить 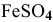
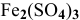
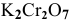
Решение:
Записываем сокращенное ионное уравнение данной реакции:
Составляем уравнения полуреакций, записывая в левой части окисленные формы каждого из изменяющихся веществ, а в правой — восстановленные формы, и находим по таблице стандартные 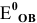
По величине 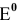
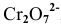
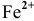
Записываем ионное уравнение реакции с учетом множителей:
Составляем молекулярное уравнение:
Пример 98
По данным полуреакциям составить ионное и молекулярное уравнение ОВ реакции:
Решение:
Роль окислителя будет выполнять окисленная форма I полуреакции, а роль восстановителя — восстановленная форма II полуреакции.
Составляем ионное и молекулярное уравнение, подобрав противоионы:
Пример 99
Определить возможность протекания окислительно-восстановительной реакции
в кислой среде, pH которой равен 1, а концентрации:
Решение:
Для упрощения расчетов предполагаем, что диссоциация всех веществ полная, тогда:
Изучаемая реакция состоит из двух полуреакций, стандартные редокс-потенциалы которых находим в таблице:
Определяем редокс-потенциалы каждой полуреакции по формуле Нернста для соответствующих концентраций:
при
По формуле 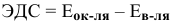
В роли окислителя выступит бихромат — ион 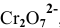
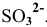
Так как 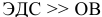
Задача 68
Рассчитать электродный потенциал гальванической пары: раствор 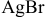
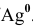
Решение:
Определяем концентрацию ионов 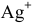
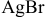
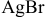
Таким образом, 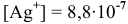
Для расчета электродного потенциала гальванической пары 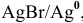
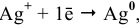
В справочнике находим:
Задача 69
Рассчитать электродвижущую силу гальванического элемента, состоящего из медной пластины, погруженной в 0,001 М раствор 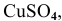
Решение:
Прежде всего, рассчитаем электродные потенциалы медного и магниевого электродов по уравнению Нернста:
Предположив, что диссоциация разбавленного раствора соли полная (а = = 1,0), вычислим электродный потенциал меди:
Предположив, что диссоциация разбавленного раствора соли полная, вычислим электродный потенциал магния:
Рассчитаем электродвижущую силу гальванического элемента по формуле
Роль катода выполняет электрод, имеющий более высокий электродный потенциал, в данном случае — это медный электрод. Тогда находим:
Задача 70
Составить два гальванических элемента: медный электрод играет роль катода; медный электрод играет роль анода. Составить схемы этих гальванических элементов и написать процессы, происходящие на катоде и на аноде.
Решение:
1. Медный электрод играет роль катода, если электродный потенциал гальванической пары 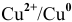
Таким образом, подбираем для этой цели любую гальваническую пару, электродный потенциал которой ниже электродного потенциала медного электрода, например 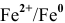
Железный электрод играет по отношению к медному электроду роль анода.
Схема полученного гальванического элемента следующая:
Процессы, происходящие на электродах:
2. Медный электрод играет роль анода, если в качестве катода подобрана такая гальваническая пара, электродный потенциал которой выше электродного потенциала пары 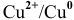
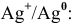
Схема полученного гальванического элемента следующая:
Процессы, происходящие на электродах:
Задача 71
Рассчитать электродвижущую силу концентрационного элемента, схема которого следующая:
Написать процессы, происходящие на электродах.
Решение:
Определяем, прежде всего, электродные потенциалы каждого электрода.
Электрод с концентрацией 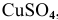
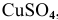
Для электрода с концентрацией 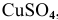
Второй электрод с более низкой концентрацией катионов 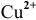
Процессы, протекающие на электродах, следующие:
Задача 72
Рассчитать произведение растворимости 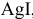
Решение:
Прежде всего, рассчитаем электродный потенциал катода, предположив, что 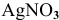
Зная величину электродного потенциала катода и величину ЭДС, рассчитаем величину электродного потенциала анода:
Рассчитаем концентрацию ионов 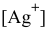
В насыщенном растворе 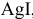
Рассчитаем произведение растворимости 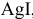
Задача 73
Рассчитать ЭДС свинцового аккумулятора, состоящего из шести банок, соединенных последовательно.
Решение:
Рассчитаем ЭДС одной банки свинцового аккумулятора. При разрядке аккумулятора происходят следующие процессы:
Для каждой из электродных полуреакций находим в справочнике значения стандартных электродных потенциалов:
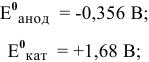
Электродвижущая сила шести последовательно соединенных банок будет равна:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://lfirmal.com/zadachi-s-resheniyami-na-elektrohimicheskie-raschetyi/