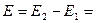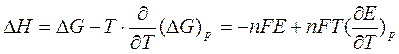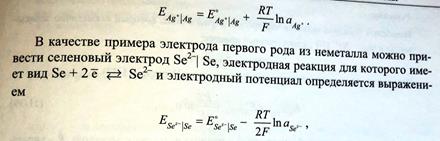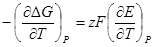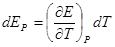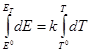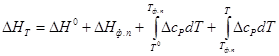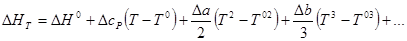Правило знаков ЭДС элементов и электродных потенциалов
1. Основополагающее правило – ЭДС положительна, если внутри гальванического элемента положительное электричество (катионы) перемещается слева направо (Стокгольм, международная конференция 1953г.)
2. Выводы. При разряде ионов на правом электроде — процесс восстановления (электрод заряжается положительно), а сам электрод – положительный полюс г.э. (катод); на левом электроде – процесс окисления (отрицательный полюс, анод).
3. Соответствие знака ЭДС системе знаков теории хим. сродства а)
б) 

53. Электрохимическая форма уравнения Гиббса-Гельмгольца. Зависимость ЭДС гальванического элемента от температуры. Температурный коэффициент ЭДС и его связь с энтропией химической реакции в гальваническом элементе.
Уравнение Гиббса-Гельмгольца применительно к электрохимической цепи:

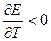

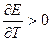
n — число электронов участвующих в электрохимической реакции;
ΔG – изменение энергии Гиббса для химической реакции, протекающей в гальваническом элементе.
Производная ΔG по температуре дает значения энтропии ΔS:
где ΔS — изменение энтропии для химической реакции, протекающей в гальваническом элементе;

Измерив э.д.с. элемента и ее температурный коэффициент, можно найти ΔG и ΔS для суммарного процесса, протекающего в элементе.
Изменение энтальпии для химической реакции в элементе вычисляют, используя уравнение Гиббса-Гельмгольца:
Классификация электродов. Окислительно-восстановительные электроды, потенциал которых не зависит от концентрации ионов водорода. Приведите пример, электродную реакцию и уравнение Нернста для расчёта потенциала электрода указанного типа.
1) Электроды 1-го рода
2) Электроды 2-го рода
3) Электроды 3-го рода
4) Газовые электроды
5) Ионоселективные электроды
6) Окислительно-восстановительные электроды
Про окислительно-восстановительные электроды см. 60.
Электроды первого рода. Примеры. Вывод и анализ уравнения, связывающего потенциал электрода с активностями потенциалопределяющих ионов.
См. п.56
Электроды первого рода, обратимые по катиону: определение, примеры, уравнение, связывающее потенциал электрода с активностями веществ, участников электродной полуреакции (уравнение Нернста). Амальгамные электроды.
Электрод первого рода – это металл (или неметалл), погруженный в раствор, содержащий ионы этого же металла (неметалла).
Таким образом, потенциал электрода первого рода определяется активностью катионов металла в растворе или активностью анионов неметалла. Ионы, от активности которых непосредственно зависит потенциал электрода, называются потенциалопределяющими.
Примерами электродов первого рода, обратимых по катиону, могут служить металлы в растворах их растворимых солей (Ag в растворе AgNO3, Cu в растворе CuSO4).
Так, для серебряного электрода Ag + |Ag электродная реакция имеет вид: Ag + +е =Ag
Электродный потенциал определяется выражением:
Приведите пример электрода второго рода. Запишите электродную реакцию и уравнение Нернста для выбранного электрода. Влияние концентрации потенциалопределяющих ионов на потенциал электрода.
Электрод второго рода – металл, покрытый слоем его малорастворимого соединения (соли/оксида/гидроксида) и погруженный в раствор электролита, который содержит тот же анион, что и малорастворимое соединение.
Таким образом, потенциал электрода второго рода определяется активностью анионов: такие электроды обратимы по аниону.
Электрод, представляющий собой ртуть, покрытую пастой из смеси каломели Hg2Cl2 cо ртутью, находящуюся в контакте с раствором хлорида калия: Cl — | Hg2Cl2|Hg, называют каломельным электродом.
Ввиду низкой растворимости каломели в воде активность хлорид-ионов считают практически равной активности хлорид-ионов, образуемых при диссоциации хлорида калия, поэтому концентрация хлорида калия в растворе должна быть точно известна. Наиболее часто используют каломельные электроды, в которых концентрация KCl отвечает насыщению (насыщенный) или равна 0,1 или 1,0 моль/л. Каломельные электроды (особенно насыщенный) удобны тем, что диффузионный потенциал, возникающий в электрохимической цепи на границе насыщенный раствор хлорида калия – данный раствор, незначителен и во многих случаях (не требующих большой точности) им можно пренебречь.
Потенциалы электродов зависят, в первую очередь, от соотношения активностей (концентраций) потенциалопределяющих ионов в растворе. Увеличение концентрации окисленной формы (или уменьшение концентрации восстановленной формы) приводит к возрастанию потенциала электрода. Вместе с тем, ионы (вещества), не участвующие в электродных реакциях (индифферентные), изменяют ионную силу раствора, а, следовательно, и коэффициент активности и активность потенциалопределяющих ионов. Это опять же приводит к изменению потенциала электрода. Те вещества, которые вступают в химическое взаимодействие с потенциалопределяющими ионами, также влияют на потенциалы электродов.
ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМ
При обратимом протекании в системе какого-нибудь процесса в изотермических условиях и при постоянном давлении связь между изменением энергии Гиббса (ΔG), энтальпии (ΔН) и энтропии (ΔS) дается уравнением
в котором TΔS есть изменение связанной энергии системы. При этом система представляется настолько большой, что переход ее от начального состояния к конечному не вызовет заметного изменения параметров. Например, в системе с химической реакцией начальные и конечные концентрации участников реакции можно считать одними и теми же. Если в системе идет процесс перехода вещества от большей концентрации к меньшей, то эти изменения происходят на бесконечно малую величину и т. д. Из термодинамики известно, что
Это уравнение принято называть уравнением Гиббса — Гельм-гольца. Убыль энергии Гиббса электрохимической системы равна максимальной работе ΔА, которую может совершить система, а эта максимальная электрическая работа равна произведению напряжения системы на количество прошедшего электричества, т. е. zFE. Таким образом:
Продифференцируем это выражение по температуре:
Следовательно, изменение энтропии можно определить из температурного коэффициента напряжения системы.
Подставив в уравнение Гиббса — Гельмгольца выражение убыли энергии Гиббса, получим
Так как изотермическая и обратимая электрическая работа является полным дифференциалом параметров Р, Т, то
и если Р = const, то
и полученное уравнение переписываем в виде:
В этом уравнении ΔН относится к количеству вещества, вступившему в реакцию при прохождении zF количества электричества, т. е. к одному молю.
Совершенно аналогичное выражение получается, если процесс идет изотермически и обратимо, но не при постоянном давлении, а при постоянном объеме. Тогда

Электрическая работа, совершаемая системой, может быть больше, меньше или равна изменению энтальпии в зависимости от знака температурного коэффициента напряжения. Если (dE/dT)P = 0, то
и электрическая работа точно равна изменению энтальпии. Это уравнение называется уравнением Томсона. Его иногда применяют для ориентировочных расчетов напряжения.
Если (dE/dT)P > 0, то электрическая работа больше изменения энтальпии и электрохимическая система в обратимом изотермическом режиме превращает в электрическую работу не только энергию, выделяющуюся при уменьшении энтальпии процесса, но и часть энергии окружающей среды. В адиабатическом режиме система, следовательно, будет охлаждаться.
В качестве примеров рассмотрим несколько электрохимических систем с водными и расплавленными электролитами (табл. 6.4).
Таблица 6.4. Проверка уравнения Гиббса — Гельмгольца
| № по пор. | Электрохимическая система | Химическая реакция в системе |
| 1. 2. 3. 4. 5. | (–) Zn | ZnCl2 (aq), AgCl (тв.) | Ag (+) 0,535 кмоль/м 3 (–) Pb | (CH3COO)2Pb (aq) || || (CH3COO)2Cu (aq) | Cu (+) (–) Hg | HgO, KOH || KCl, Hg2Cl2 | Hg (+) 0,01 кмоль/м 3 0,01 кмоль/м 3 (–) Pb | PbBr2 (расплав) | Br2 (C) (+) (–) Ag | AgCl (расплав) | Cl2 (C) (+) | Zn + 2AgCl (тв.) = = ZnCl2 + 2Ag Pb + (CH3COO)2Cu = = (CH3COO)2Pb + Cu Hg2Cl2 + 2KOH = = Hg2O + H2O + 2KCl Pb + Br2 = PbBr2 Ag + ½ Cl2 = AgCl |
Система 1 обладает отрицательным температурным коэффициентом, и реакция в ней протекает с уменьшением энтальпии (экзотермическая реакция), которая из термохимических данных в условиях протекания реакции равна — 218,0 кДж/моль. Электрическая работа, которую может совершить система, меньше, чем ΔН. Расчет по формуле дает значение изменения энтальпии системы, очень близкое к определенному из термохимических измерений. В рассматриваемой электрохимической системе 90% выделяемой теплоты расходуется на совершение электрической работы, а 10% рассеивается или нагревает систему. Аналогичные соотношения имеем и для систем 4, 5. Рассчитанные из электрохимических измерений значения энтальпии совпадают с термохимическими данными в пределах ошибок опыта, а в электрическую работу превращается соответственно 73 и 82% от выделяющейся теплоты.
Температурный коэффициент напряжения системы 2 положителен. В соответствии с этим в электрическую работу превращается не только вся теплота, выделяющаяся при протекании реакции, но и часть теплоты (примерно 33%), поглощенной из окружающей среды. Значения энтальпии, определенные из электрохимических и термохимических измерений, хорошо согласуются друг с другом.
Наконец, в электрохимической системе 3 положителен не только температурный коэффициент напряжения, но и изменение энтальпии. Следовательно, эта система отбирает тепловую энергию от внешней среды не только для совершения электрической работы, но и на химическую реакцию.
Данные, приведенные в табл. 6.4, относятся к реакциям, протекающим не при стандартной температуре (298,15 К или 25°С). Для стандартных условий уравнение Гиббса — Гельмгольца должно быть записано в виде:
| Т, К | z | E, B |  , В/град , В/град | ΔG,  | 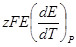 , ,  | ΔН, кДж/моль |
| из изме-рения напря-жения | из тер-мохи-мичес-ких данных | |||||
| 1,015 0,476 0,164 1,100 0,913 | – 4,02∙10 –4 3,85∙10 –4 0,84∙10 –3 – 0,67∙10 –3 – 0,29∙10 –3 | – 196,0 – 92,0 – 31,6 – 212,6 – 88,1 | – 21,0 21,8 46,7 – 79,0 – 20,4 | – 217,0 – 70,2 15,1 – 291,6 – 108,5 | – 218,0 – 69,1 15,7 – 289,1 – 106,8 |
Здесь Е°, ΔН°, Т°, dE°/dT — величины, относящиеся к стандартным условиям.
Если же необходимо провести расчеты при каких-нибудь условиях, отличных от стандартных, то нужно знать ΔН и dE/dTдля этих условий. Рассмотрим сперва зависимости этих величин от температуры, считая, что активности участников реакции при всех температурах равны единице,
Вообще говоря, температурный коэффициент напряжения может изменяться с температурой, а также оставаться постоянным в значительном температурном интервале. Характер его изменения будет определяться изменением напряжения с температурой.
Продифференцируем уравнение Гиббса — Гельмгольца по температуре:
Из этого выражения следует, что
и если напряжение системы не зависит от температуры или линейно зависит от нее, то (∂ 2 Е/∂∂Т 2 )Р =0 и тогда
Но в соответствии с уравнением Кирхгоффа
где 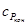

Следовательно, для соблюдения условий независимости или линейного хода Е с температурой нужно, чтобы при протеканиипроцесса не происходило бы изменения теплоемкости системы, т. е. чтобы ΔсР = 0. Тогда изменение напряжения с температурой будет происходить только вследствие изменения энтропии системы.
В рассматриваемом случае, поскольку изменение энтальпии не зависит от температуры, можно легко определить значение Е для любой температуры (Ет), если только линейный ход Е с температурой соблюдается вплоть до этой температуры. Из выражения
Ет = Е 0 + k (Т – Т 0 )
где k — положительное или отрицательное значение температурного коэффициента.
Если же температурный ход напряжения системы не линейный, то напряжение системы определяется следующим образом. Определим изменение энтальпии при температуре Т(ΔНТ) интегрированием уравнения Кирхгоффа:
В случае какого-либо фазового превращения в системе в данном интервале температур нужно учесть также изменение энтальпии при этом превращении (ΔНф. п), т. е.
Теперь задача определения ΔНТ может быть решена, если известен температурный ход теплоемкости каждого из участников реакции. В ряде случаев ход теплоемкости с температурой может быть выражен в виде ряда:
Тогда для ΔсР аналогично
ΔсР = ΔсРº + ΔаТ + ΔbT 2 + ΔcT 3 + …
Подставив это выражение в уравнение для ΔНТ и проинтегрировав его в пределах от T 0 до Т, получим:
При наличии в системе фазовых превращений ход рассуждений остается тем же, нужно только воспользоваться формулой для ΔНТ, где учтено изменение энтальпии при фазовых превращениях.
Определение температурного коэффициента напряжения при температуре Т можно провести, воспользовавшись соотношением
из которого следует, что
Подставив вместо ΔсР степенную зависимость и проведя интегрирование, окончательно получим изменение энтропии системы при интересующей нас температуре:
Разделив теперь ΔST на zF, получим температурный коэффициент и с помощью формулы Гиббса — Гельмгольца определим напряжение системы ЕT. Следует помнить, что ЕT относится к температуре Т и активностям участников реакции, равным единице.
Когда в реакции, протекающей в электрохимической системе, имеются газообразные участники, напряжение системы оказывается зависящим от давления. Для определения напряжения как функции давления (ЕР) следует воспользоваться термодинамическим соотношением
где V — изменение мольного объема при реакции.
Так как ΔGV = – zFE, то
Интегрирование этого выражения дает:
Если изменение объема подчиняется уравнению состояния идеального газа, то
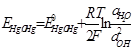
Здесь ЕP — напряжение системы при давлении Р, стандартной температуре и активностях всех конденсированных участников реакции, равных единице.
Если конденсированные участники реакции находятся не в стандартных состояниях, то это обстоятельство должно быть учтено при расчетах, но такие расчеты выходят за рамки книги.
Рассмотрим теперь формулу Гиббса — Гельмгольца применительно к системам без химической реакции.
В системах с электродами из разных модификаций одного и того же металла, например в системе
Sn (белое) | SnSO4 | Sn (серое)
ΔH – изменение энтальпии при аллотропном переходе серого олова в белое. При температуре, отвечающей равновесию обеих модификаций, ΔG = 0 и, следовательно, Е = 0, откуда
т. е. все изменение энтальпии эквивалентно изменению связанной энергии системы.
Аналогичные рассуждения можно применить и к системам типа
М (жидкий) | Расплавленная соль | М (твердый)
(где М — металл), например
при температуре плавления. Поскольку при плавлении энтальпия изменяется, то, на первый взгляд, можно было ожидать, что при замыкании такой системы потечет ток и произойдут процессы растворения жидкого металла и восстановления ионов металла на твердом электроде. Однако такое заключение ошибочно, ибо при температуре плавления ΔG = 0 и вся теплота, затрачиваемая на плавление, идет на увеличение связанной энергии системы. Следовательно, в этом случае напряжение системы равно нулю и она не может совершить работы.
В остальных типах систем без химической реакции никаких превращений не происходит, а электрическая работа совершается в результате переноса энергии от более высокого уровня к менее высокому уровню. Поскольку в случае идеальных систем внутренняя энергия U не зависит от объема, то ΔH = 0 и
Следовательно, электрическая работа в таких системах совершается только вследствие изменения связанной энергии. Преобразовав это уравнение
откуда после интегрирования имеем
ln E = ln Т + const и E = k’T
В идеальных электрохимических системах данного типа напряжение, таким образом, прямо пропорционально абсолютной температуре.
В реальных же системах (∂U/∂V)P ≠ 0 и ΔH в формуле Гиббса — Гельмгольца будет равно энтальпии перехода моля вещества от уровня с большей энергией на уровень с меньшей энергией. Например, в системах типа
ΔH — изменение энтальпии при переходе моля растворенного электролита от активности а2 к активности а1, т. е. энтальпия разведения в данных пределах (а2 > a1).
В указанного типа электрохимической системе не всегда удается достаточно полно элиминировать скачок потенциала на границе двух жидких фаз. Поэтому удобнее воспользоваться двумя одинаковыми электрохимическими системами с химическими реакциями, в одной из которых активность электролита равна а1, а в другой — a2, и включить их в измерительную цепь напротив друг другу таким образом, чтобы слева находилась система с большим напряжением:
(–) (Pt) H2 | HCl, AgCl (тв.) | Ag — Ag | AgCl (тв.), НС1 | H2 (Pt) (+)
Измеренное напряжение Ep = E1 – E2 и, следовательно,
При небольших разностях концентраций разность температурных коэффициентов очень невелика, и таким путем из измерений напряжения можно прямо рассчитать энтальпию разведения от активности а2 до а1.
Определение термодинамических характеристик электрохимических цепей
Лабораторная работа № 1
Определение термодинамических характеристик электрохимических цепей.
Система, состоящая из двух электродов, помещенных в раствор электролита, которая при соединении электродов вне электролита каким-либо металлическим проводником создает во внешней цепи электрический ток, называется гальваническим (или электрохимическим) элементом.
Условная запись (схема) гальванического элемента
Для описания гальванических элементов применяется условная запись, в соответствии с которой сначала указывается материал одного из электродов, далее – раствор, в который помещен этот электрод, затем раствор, в который погружен второй электрод, и, наконец, материал другого электрода. Электроды отделяются от раствора сплошной вертикальной линией, а растворы разделяются либо двумя вертикальными линиями, когда считают, что на границе растворов нет скачка потенциала, либо пунктирной линией, когда таким скачком пренебречь нельзя. Так, медно-цинковый элемент может быть записан следующим образом:
где знаки + и – указывают полярность электродов; c1 и c2 – концентрации растворов.
При большой разнице между c1 и c2, когда нельзя пренебречь скачком потенциала на границе двух растворов, этот элемент записывают в другом виде:
(-)Zn½ZnSO4
В тех же случаях, когда хотят указать только участвующие в электродных реакциях ионы, запись упрощают:
Для обратимо работающего гальванического элемента ток всегда должен идти слева направо, а на концах быть один и тот же металл.
Устройство медно-цинкового гальванического элемента (элемента Даниэля-Якоби) показано на рисунке.
Рисунок — Медно-цинковый элемент (элемент Даниэля-Якоби):
1 – пористая диафрагма; 2 – цилиндрический электрод из листового цинка; 3 – медный электрод.
При замыкании электродов через внешнюю цепь на медном электроде пойдет процесс восстановления меди:
а на цинковом электроде – процесс окисления цинка:
Электроны, остающиеся на электроде при реакции окисления, будут перетекать во внешней цепи от цинка к меди, где будут участвовать в процессе восстановления меди. В растворе при работе гальванического элемента ток будет переноситься ионами меди и цинка, движущимися к цинковому электроду, и сульфат-ионами, движущимися к медному электроду.
Равновесные потенциалы медного и цинкового электродов связаны с активностями ионов меди и цинка в растворе уравнением Нернста:
Электродвижущая сила (ЭДС) гальванического элемента. Стандартная ЭДС
Разность равновесных потенциалов электродов гальванического элемента называется электродвижущей силой этого элемента. Для элемента Даниэля-Якоби это можно выразить:

где 
Стандартная ЭДС обратимо работающего гальванического элемента равна разности стандартных потенциалов отдельных электродов гальванического элемента, причем, так как ЭДС всегда положительная величина, от положительного потенциала отнимается отрицательный потенциал.
Вывод уравнения Нернста для гальванического элемента
Если в электрохимической системе обратимо и изотермически протекает следующая реакция:

при 
и обратимая ЭДС ( ЕP, T) системы определяется как:
В то же время изменение энергия Гиббса реакции определяется формулой:
и так как 
где 
В состоянии равновесия при данных давлении и температуре 
Если активности всех компонентов равны единице (аi=1), то 


где Ка — константа равновесия реакции. Из этого следует, что:
Если аi = 1, то 
где Е0 — стандартная ЭДС. Полученное после подстановки уравнение называется уравнением Нернста:


Обратимые и необратимые гальванические элементы
Гальванические элементы могут быть обратимыми и необратимыми. Гальванический элемент является обратимым, если токообразующая реакция в элементе может быть обращена в противоположном направлении при приложении к нему извне ЭДС, превышающей собственную ЭДС элемента на бесконечно малую величину. Примером обратимых гальванических элементов может служить элемент Даниэля-Якоби (если пренебречь переходом ионов через границу растворов):
В этом элементе при его работе будет иметь место реакция:
Zn + CuSO4 ® Cu + ZnSO4
Если к элементу приложить внешнюю ЭДС, противоположно направленную относительно ЭДС элемента, то в нем будет идти реакция:
Cu + ZnSO4 ® CuSO4+ Zn,
т. е. в отличие от токообразующей реакции в элементе медь начнет растворяться, а цинк – выделяться из раствора.
Примером необратимого элемента может служить цепь:
В этом элементе при его работе будет идти процесс:
Zn + CuSO4 ® ZnSO4+Cu
Если приложить к нему внешнюю противоположно направленную ЭДС, то будет происходить процесс растворения меди на медном электроде и ее выделение на цинковом, т. е. этот процесс не будет обратным процессу при работе такого гальванического элемента.
Термодинамические характеристики гальванического элемента
Работа какого-либо обратимого процесса при определенных ограничениях, налагаемых на условия осуществления процесса, например при постоянстве температуры и давления, будет максимальной полезной работой, поэтому термодинамический расчет ЭДС возможен только в случае обратимых гальванических элементов. Зависимость максимальной полезной работы химической реакции в гальваническом элементе от температуры можно связать с уравнениями Гиббса-Гельмгольца:
Максимальная полезная работа электрохимической реакции равна
Подставляя в уравнения Гиббса-Гельмгольца вместо DG и DF их значения, выраженные через ЭДС, можно получить эти уравнения в форме, связывающей ЭДС с тепловым эффектом реакции и температурой:
где ¶Е/¶T – температурный коэффициент, который показывает во сколько раз изменяется ЭДС при увеличении температуры на 1 К.
Или, учитывая, что — DН=Qp – тепловой эффект реакции при постоянном давлении, а — DU=Qv — тепловой эффект реакции при постоянном объеме, можно получить уравнения Томсона, являющиеся частным случаем уравнений Гиббса-Гельмгольца:
В том случае, когда ЭДС гальванического элемента не зависит от температуры, т. е. (¶Е/¶T)р=0 или (¶Е/¶T)v=0, эти уравнения переходят в:
Если ¶Е/¶T > 0, то 
http://lektsii.org/8-40282.html
http://pandia.ru/text/80/353/3320.php