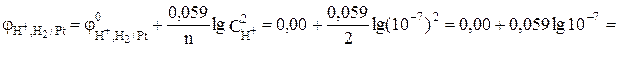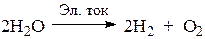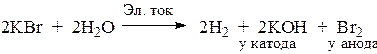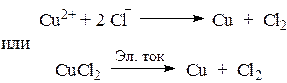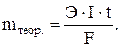Составление схем электродных процессов на электродах при электролизе солей
Электролиз водного раствора соли хлорида железа (ⅠⅠ)
Задача 152.
Составьте схему электролиза водного раствора FeCl2. Вычислите время, в течение которого должен быть пропущен ток силой I A через раствор, чтобы на катоде выделилось m (г) металла.(восстановление воды не учитывать)
Раствор FeCl2 , катод-угольный, анод-угольный. I = 4 А , m = 2.9 г
Решение:
Е(Fe 2+ /Fe) = 0,44 В;
M(FeCl2) = 126,751 г/моль
Э(FeCl2) = 63,3755 г/?моль.
В водном растворе соль FeCl2 диссоциирует по схеме: FeCl2 = Fe 2+ + 2Cl – . Стандартный электродный потенциал системы
Fe 2+ + 2электрона = Fe 0 (-0,44 В) незначительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В). Поэтому на катоде будет происходить электрохимическое восстановление ионов Fe 2+ и Н2О:
Fe 2+ + 2ē = Fe 0
2Н2О + 2ē = Н2 + 2ОН –
На аноде будет происходить электролитическое окисление ионов хлора с образованием свободных атомов хлора, которые, соединяясь друг с другом, образуют молекулу хлора:
2Cl – — 2ē = 2Cl*
Cl* + Cl* = Cl2
Сложим уравнение катодного и анодного процессов, получим суммарное ионно-молекулярное уравнение:
Fe 2+ + 2Н2О + 2Cl – = 2Fe 0 + Н2↑ + 2ОН – + Cl2↑
На аноде ионы Fe 2+ соединяются с двумя ионами ОН – , образуя нерастворимый гидроксид железа (ⅠⅠ) Fe(OH)2:
Тогда молекулярная форма процесса будет иметь вид:
При гидролизе FeCl2 в водном растворе с инертными электродами образуются металлическое железо, и выделяются газообразный водород и хлор. На катоде будет выделяться металлическое железо и газообразный водород, а на аноде — хлор.
Рассчитаем время электролиза FeCl2, получим:
m = (Э . I . t)/F;
t = (m . F)/(Э . I) = (2,9 . 96500)/(63,3755 . 4) = 48250/324,96 = 1104 c.
Электролиз водного раствора нитрата кадмия
Задача 153.
Электролиз раствора нитрата кадмия с графитовыми электродами и кадмиевым анодом. Опишите электродные процессы на электродах.
Решение:
В водном растворе соль нитрата кадмия диссоциирует по схеме:
1. Электролиз раствор нитрата кадмия с графитовыми электродами
Стандартный электродный потенциал системы Cd 2+ + 2ē = Cd0 (-0,402 В) незначительно отличается от потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, поэтому на катоде протекают одновременно две реакции – образование водорода и выделение кадмия:
Уравнение электролиза будет иметь вид:
2Cd 2+ + 2Н2О = 2Cd 0 + H2↑ + O2↑ + 4Н +
Таким образом, в катодном пространстве будут разряжаться ионы кадмия и молекулы воды при этом на графитовом электроде откладываеся металлический кадмий и выделяется газообразный водород, а в анодном пространстве будет у графитового электрода будет выделяться газообразный водород и будут накапливаться ионы NO3 – и H + . Среда у анода в процессе электролиза Cd(NO3)2 становится кислой.
Суммарная реакция электролиза в молекулярной форме:
2. Электролиз раствора нитрата кадмия с кадмиевым анодом
Так как кадмиевый анод растворим в условиях электролиза соли Cd(NO3)2, то на аноде происходит окисление материала анода. Поэтому при электролизе Cd(NO3)2 с использованием кадмиевого анода на катоде будет выделяться чистый кадмий и водород, а на аноде ионы кадмия не будут разряжаться, и, следовательно, выделение кислорода не наблюдается. В данном случае происходит растворение самого кадмиевого анода, т.е. с анода кадмий в виде ионов Cd 2+ переходит в раствор.
Электродные процессы на электродах:
1|Катод(-): Cd 2+ + 2ē = Cd 0 ;
2H2O + 2ē = H2↑ + 2OH – ;
2|Анод(+): Сd 0 – 2ē = Cd 2+
Уравнение электролиза в ионно-молекулярном виде:
Сd 2+ + 2H2O + 2Cd 0 = Cd 0 + 2Cd 2+ + H2↑ + 2OH –
После приведения членов в обеих частях равенства получим:
Ионы кадмия Cd 2+ у анода будут соединяться с ионами ОН-, образуя малорастворимое основание Cd(OH)2:
Суммарная реакция электролиза в молекулярной форме:
Электролиз водного раствора соли хлорида меди (Ⅰ)
Задача 154.
Составить схему электролиза соли CuCl. Рассчитать массу меди, выделившейся при электролизе соли CuCl, если в течении 40 минут пропущен ток силой 3 А.
Решение:
Mэ(CuCl) = 98,999 г/моль;
I = 3 A;
t = 40 мин = 2400 с.
1. Электродные процессы
Медь находятся в ряду активности металлов «после водорода», значит на катоде будет протекать реакция восстановления только меди:
Стандартный электродный потенциал системы Cu + + 1ē = Cu 0 (+0,52 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
Так как стандартный электродный потенциал системы 2H2O — 4ē = O2↑ + 4OH – и 2Cl – + 2ē = Cl2, соответственно, равны 1,23В и 1,36 B, то на
аноде будет: 2Cl – + 2ē = Cl2.
Схема электролиза соли CuCl с использованием графитовых электродов:
2|Катод: Cu + + 1ē = Cu 0
1|Анод: 2Cl – + 2ē = Cl2.
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu + + 2Cl – = 2Cu 0 + Cl2
катод анод
Таким образом, при электролизе водного раствора CuCl с использованием графитовых электродов на катоде выделяется металлическая медь, а на аноде — газзобразный хлор.
2. Вычисление количества полученной меди
Для вычисления массы меди используем выражение из первого закона электролиза Фарадея:
m(B) = [M(Э)•I•t]/F = M(Э)•q, где
m(B) — масса выделяемого веществав; M(Э) — электрохимический эквивалент (молярная масса эквивыалента вещества); I – сила тока; t – время; F — число Фарадея (96500 Кл/моль); q — количество электричества.
Тогда
m(CuCl) = [Mэ(CuCl)•I•t]/F = (98,999•3•2400)/96500 = 7,4 г.
Ответ: m(CuCl) = 7,4 г.
Примеры составления условий задач и их решения. Разобрать процессы, протекающие у электродов при электролизе водных растворов: Na2SO4, Cd(NO3)2, KBr
Задача 472
Разобрать процессы, протекающие у электродов при электролизе водных растворов: Na2SO4, Cd(NO3)2, KBr, CuCl2; для каждого из них составить общее уравнение реакции.
Вода может быть как окислителем, так и восстановителем, поэтому при электролизе водных растворов у электродов могут восстанавливаться и окислиться не ионы электролита, а вода. Это зависит от сравнительной величины окислительно-восстановительных потенциалов воды и ионов электролита.
I. Электролиз водного раствора Na2SO4.
Стандартный электродный потенциал системы
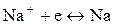
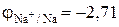
значительно отрицательнее потенциала водородного электрода в нейтральной водной среде
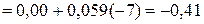
Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода:
а ионы Na + , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O – 4e → O2 + 4H + ; 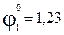
поскольку отвечающий этой системе стандартный электродный потенциал значительно ниже, чем стандартный электродный потенциал, характеризующий систему: 2SO4 2– – 2e = S2O8 2– , 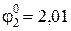
Ионы SO4 2– , движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Умножая уравнение катодного процесса на два и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза:
у катода у анода
Приняв во внимание, что одновременно происходит накопление ионов Na + в катодном пространстве и ионов SO4 2– в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
у катода у анода
Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве).
В случае, когда растворы катодного и анодного пространств перемешиваются, образующиеся в результате электролиза щелочь и кислота нейтрализуются и дают вновь соль (Na2SO4):
В итоге электролиз сводится к электрохимическому разложению воды:
2. Электролиз водного раствора Cd(NO3)2.
При электролизе водных растворов солей цинка, железа, кадмия и некоторых других металлов, стоящих в ряду напряжения, хотя и левее водорода, но близко к нему, на катоде выделяются эти металлы. Объясняется это тем, что процесс разрядки ионов Н + осложняется адсорбцией атомов и молекул водорода на поверхности электродов. Для того чтобы десорбировать водород и получить его в газообразном состоянии, необходимо приложить избыточную э.д.с. Увеличение э.д.с. приводит к тому, что на катоде происходит выделение металла, стоящего в ряду напряжения левее водорода:
Cd 2+ + 2e ↔ Cd, 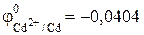
Нитрат-ионы скапливаются вблизи анода, но окислению легче подвергается вода:
2H2O – 4e → O2 + 4H + , 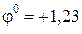
В целом процесс выражается уравнением
у катода у анода
При электролезе солей, состоящих из ионов малоактивных металлов (стоящих в ряду напряжения после водорода) и кислородсодержащих анионов, также набдюдается выделение металла на катоде. На аноде выделяется кислород в результате окисления воды с изменением pH среды за счет вторичного процесса – образования кислоты.
3. Электролиз водного раствора КВr.
Ионы калия обладают меньшей окислительной способностью, чем вода. Поэтому на катоде происходит восстановление воды, а на аноде – окисление брома, которые обладают большей восстановительной способностью, чем вода.
катод K + , HOH; 2H2O + 2e → H2 + 2OH – в-е, о-ль PH > 7
анод Br – , HOH; 2Br – – 2e = Br2 о-е, в-ль
катионы активного металла калия, которые не восстанавливаются на катоде, накап- ливаются в прикатодном пространстве.
В целом процесс выражается уравнением
4. Электролиз водного раствора СuCl2.
В растворе хлорид меди (II) диссоциирует на ионы:
Значение стандартного электродного потенциала меди (0,34 В) положительно, следовательно, ионы меди(II) будут легко восстанавливаться в водных растворах: катод (-) Сu 2+ + 2e ® Сu .
Хлорид -анионы, как и многие анионы бескислородных кислот, окисляются в водных растворах: анод (+) 2 СI – -2e® С12
Суммарное уравнение процесса:

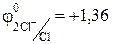
1 Cu 2+ + 2е ® Cu в-е, о-ль; 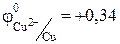
Задача 503
Вычислить массу серебра, выделившуюся на катоде при пропускании тока силой 6А через раствор нитрата серебра в течение 30 мин.
Соотношения между количеством прошедшего электричества и количеством вещества, выделившегося при электролизе, были открыты английским физиком М. Фарадеем в 30-х годах XIX века.
Первый закон. Количества веществ, превращенных при электролизе, пропорциональны количеству электричества, прошедшего через электролит.
Второй закон. При прохождении одного и того же количества электричества через различные электролиты количества различных веществ, испытывающие превращение у электродов, пропорциональны химическим эквивалентам этих веществ.
Для выделения или превращения с помощью тока 1г-экв любого вещества необходимо всегда одно и то же количество электричества, называемое числом Фарадея.
Выразим законы Фарадея общим уравнением:
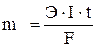
где m – масса продукта электролиза, г; I – сила тока, А; t – время, с; F – число Фарадея – 96500 к/г-экв; Э – химический эквивалент, г/г-экв.
Вычисляем массу, выделившуюся на катоде, серебра:
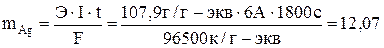
Задача 509
Найти объем кислорода (условия нормальные), который выделится при пропускании тока силой 6А в течение 30 мин через водный раствор KOH.
При вычислении объемов выделившихся газов представим уравнение Фарадея в следующей форме:
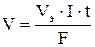
где V – объем выделившегося газа, л; Vэ – его эквивалентный объем, л/моль.
Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода — 5,6 л/моль, то получим
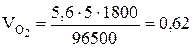
Задача 515
При электролизе водного раствора АgNO3 с нерастворимым анодом в течение 50 мин при силе тока в 3,0 А на катоде выделилось 9,6 г серебра. Вычислить выход по току.
При практическом проведении электролиза действительный расход тока, вследствие протекания тех или иных побочных процессов, обычно превышает количество его, рассчитанное согласно закону Фарадея. Поэтому на практике часто приходится иметь дело с коэффициентом использования тока, или с так называемым выходом по току (η – эта).
Выходом по току называется отношение количества практически выделенного при электролизе вещества к тому количеству его, которое должно было бы выделиться согласно закону Фарадея.
Выход по току находим как 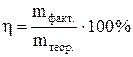
Отсюда 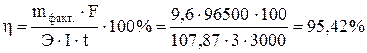
Задача 532
Сколько времени нужно пропускать ток силой 2,0 А через раствор сульфата никеля, чтобы покрыть металлическую пластинку 200 см 2 слоем никеля, толщиной 0,01 мм, если плотность никеля 8,9 г/см 3 . Выход по току составляет 90 %.
Объем покрытия V=S×h = 200× 0,001= 0.2 см 3
Масса будет равна mфакт = V × r = 0,2 ×8,9 = 1,78 г.
Эквивалентная масса никеля Э = 29,345 г/моль.
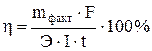
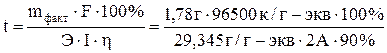
Итак, при практическом осуществлении электролиза часто наблюдаются кажущиеся отклонения от закона Фарадея. Чаще всего они проявляются при катодном восстановлении электроотрицательных металлов, когда часть электрического тока расходуется на разряд ионов водорода.
Законы электролиза относятся к электролизу растворов, расплавов и твердых электролитов с чисто ионной проводимостью.
Задача 533
Определить толщину слоя металла – Pt ( в миллиметрах), нанесенного на другой металл гальваническим методом. Исходный электролит H2[PtCl6]. Площадь поверхности металлической пластинки 250 см 2 , плотность пластины 21,47 г/см 2 . Время электролиза 45 мин, ток силой 0,2 А, выход по току составляет 90%.
Зная выход по току, определяем количество выделенного при электролизе вещества:
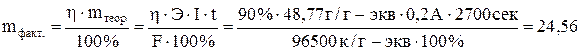
Тогда объем покрытия: 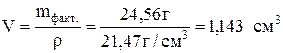
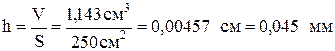
При выполнении задания рекомендуется использовать методические указания [6].
В задачах (472–502) разобрать процессы, протекающие у электродов при электролизе водных растворов веществ, для каждого из них составить общее уравнение реакции
| № задачи | Вещества |
| Na2SO4, Cd(NO3)2, KBr, CuCl2 ZnSO4, NaCl, SnCl2, KNO3 BaCl2, FeSO4, K3PO4, ZnJ2 Sr(NO3)2, Cr2(SO4)3, AuCl3, RbCl Ca(NO3)2, PdCl2, CoSO4, LiCl FeCl3, MgSO4, Cd(NO3)2, CaJ2 Na2CrO4, SnSO4, HgCl2, BaBr2 K2SO3, NiSO4, CuJ2, MgCl2 Pb(NO3)2 , H2SO4 , HgCI2, KBr KOH, CuSO4, МgJ2, SnCl4 Ba(OH)2, SrCI2, SnBr2, Zn(NO3)2 HNO3, РЬ(СН3СOO)2, RbCI, ZnBr2 Sr(ОH)2, BaCl2, СuJ2 , Fe2(SO4)3 H3PO4 , TlNO3, CaJ2, ZnBr2 NaOH, Ni(NO3)2, KCl, PtCl2 Co(NO3)2, RbOH, MgCl2, AuCl3 LiCl, H2SO4, ZnBr2, Ag3PO4 NiSO3, FeS, RbOH, CdCrO4 Cu(OH)2, H4PtO4, KJ, CaSO4 LiF, KNO3, TlCl, BaSO4 PbSO4, CuS, Hg2(NO3)2, AgJ Zn(OH)2, CuF2, , KClO4, H2CrO4 CsOH, HMnO4 , AICI3 , Pd(NO3)2 NiCI2, К2SO4, Ве(OН)2 , CH3COOH MgCl2 , RbClO4, NaNO3 , HgS BiCl3, HBr , Mg(OH)2 , BaCO3 ZnS, MgCO3, Sn(NO3)2 , TiCl4 CaSO4, H2CO3, Sr(OH)2, СоBr2 KMnО4, Bi(NO3)3, PbS , FeSO3 Cr(ClО4)3, Na2S , НСl, KVO3 Ag3PO4, NaNO3, CaCl2, PbJ2 |
В задачах 503–508 вычислить массу вещества, выделившуюся при пропускании тока через раствор в течение времени:
| № задачи | Процесс | Ток, А | Время, мин |
| Осаждение серебра из раствора AgNO3 Осаждение меди из раствора СuSО4 Осаждение золота из раствора АuС13 Осаждение олова из раствора SnSO4 Осаждение меди из раствора CuCI2 Осаждение меди из раствора Сu(NО3)2 | 6,0 1,5 1,5 |
В задачах 509–514 найти объем газа (условия нормальные), который выделится при пропускании тока в течение определенного времени через водный раствор соли
| № задачи | Процесс | Ток, А | Время, мин |
| Выделение кислорода из водного раствора КОН Выделение водорода из водного раствора КОН Выделение водорода из H2SO4 Выделение кислорода из раствора NаОН Выделение водорода из раствора HNO3 Выделение хлора из раствора NaCI | 1,5 |
В задачах 515–524 вычислить выход по току при электролизе по следующим данным:
| № задачи | Процесс | Ток, А | Время, мин | Изменение массы электрода, г |
| Осаждение серебра из раствора AgNO3 | 3,0 | +9,6 | ||
| Осаждение меди из раствора CuSO4 | 2,5 | +0,72 | ||
| Осаждение никеля из раствора NiSO4 | 10,0 | +53,21 | ||
| Осаждение цинка из раствора ZnSO4 | 3,0 | +0,46 | ||
| Осаждение меди из раствора Na[Cu(CN)2] | 10,0 | +58,2 | ||
| Растворение меди на аноде | 2,0 | -16,0 | ||
| Растворение серебра на аноде | 3,0 | -8,3 | ||
| Растворение никеля на аноде | 5,0 | -0,90 | ||
| Выделение хлора на аноде | 1,05 | 1,25 | ||
| Осаждение магния из расплава MgCl2 | 0,034 | 0,1869 |
В задачах 525–532 определить время, необходимое для нанесения слоя одного металла на другой гальваническим способом
| № задачи | Осажденный металл | Плотность металла, г/см 3 | Толщина слоя, мм | Площадь поверхности, см 2 | Ток, А | Выход по току, % | Электролит |
| Ni | 8.90 | 0.01 | 2.0 | NiSO4 | |||
| Cu | 8.93 | 0.05 | 5.0 | CuSO4 | |||
| Zn | 7.14 | 0.25 | ZnSO4 | ||||
| Ag | 10.49 | 0.02 | 0.5 | Na[Ag(CN)2] | |||
| Au | 19.32 | 0.001 | 0.25 | K[Au(CN)2] | |||
| Cd | 8.64 | 0.05 | CdSO4 | ||||
| Pt | 21.47 | 0.001 | 0.2 | H2[PtCl6] | |||
| Pb | 11.30 | 0.01 | 2.0 | Pb[BF4]2 |
В задачах 533–540 определить толщину слоя металла (в миллиметрах), нанесенного на другой металл гальваническим методом
Для водного раствора Cd(NO3)2 напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1 А в течение времени 1,5 час.
| 🎓 Заказ №: 22214 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Для водного раствора Cd(NO3)2 напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1 А в течение времени 1,5 час.
Решение: В водном растворе нитрат кадмия диссоциирует: 3 2 Cd(NO3 ) 2 Cd 2NO Уравнения электродных процессов: 2 2 4 4 2 A: H O e H O K Cd e Cd : 2 2 На аноде выделяется кислород, на катоде выделяется металлический кадмий. Согласно закону Фарадея масса вещества, выделившегося на электроде, находится по формуле F M I m экв где: Mэкв (Ag) молярная масса эквивалентов вещества, г/моль; I сила тока, А; время электролиза, с; F – постоянная Фарадея, моль Кл F 96500
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://helpiks.org/8-49274.html
http://lfirmal.com/%D0%94%D0%BB%D1%8F-%D0%B2%D0%BE%D0%B4%D0%BD%D0%BE%D0%B3%D0%BE-%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B0-cdno32-%D0%BD%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD/