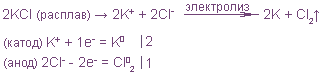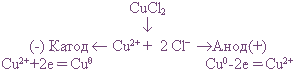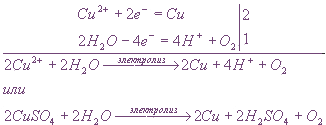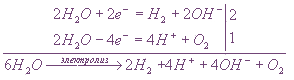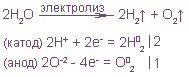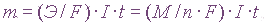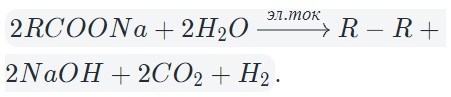1. Электролиз расплава хлорида меди (II).
Электродные процессы могут быть выражены полуреакциями:
на катоде K(-): Сu 2+ + 2e = Cu 0
на аноде A(+): 2Cl – — 2e = Cl2
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением:
Cu 2+ + 2 Cl – = Cu + Cl2
При электролизе щелочей и солей оксокислот на аноде выделяется кислород:
2. Электролиз расплава хлорида калия:
Электролиз растворов
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем».
происходит отдача электронов анионами, поэтому анод является «окислителем».
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого)
анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
— окисление анионов и гидроксид-ионов,
— восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого)
анода процесс усложняется и конкурирующими реакциями на электродах являются:
— окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
— восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих в своем составе анионы SO4 2- , NО — 3, РО4 3- , а также растворов щелочей на аноде окисляется вода и
б) при окислении анионов Сl — , Вr — , I — выделяются соответственно
А + Cl — +e — = Cl 0
2. На катоде могут образовываться следующие продукты:
а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl 3+ , на катоде восстанавливается вода и
б) если ион металла расположен в ряду напряжений правее водорода, то на катоде
К — Me n+ + ne — = Me 0
в) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al + и Н + , на катоде могут протекать конкурирующие процессы как
восстановления катионов, так и выделения водорода
Пример: Электролиз водного раствора нитрата серебра на инертных электродах
Диссоциация нитрата серебра:
При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg + , а на аноде — окисление молекул воды:
Катод: Аg + + е = А g
Составьте схемы электролиза водных растворов: а) сульфата меди; б) хлорида магния; в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
Пример: Электролиз водного раствора хлорида меди на инертных электродах
Диссоциация хлорида меди:
В растворе находятся ионы Си 2+ и 2Сl — , которые под действием электрического тока направляются к соответствующим электродам:
Катод — Cu 2+ + 2e = Cu 0
Анод + 2Cl — — 2e = Cl2
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl 0 и выделения хлора протекает окисление анода (меди).
В этом случае происходит растворение самого анода, и в виде ионов Сu 2+ он переходит в раствор.
Электролиз CuCl2 с растворимым анодом можно записать так:
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Пример: Электролиз водного раствора хлорида магния на инертных электродах
Диссоциация хлорида магния в водном растворе:
Ионы магния не могут восстанавливаться в водном растворе
(идет восстановление воды)
Пример: Электролиз водного раствора сульфата меди на инертных электродах
В растворе сульфат меди диссоциирует на ионы:
Ионы меди могут восстанавливаться на катоде в водном растворе.
Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды.
Электролиз водного раствора соли активного металла и кислородсодержащей кислоты (К2SО4) на инертных электродах
Пример: Диссоциация сульфата калия в водном растворе:
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно,
на катоде будет протекать восстановление
аноде — окисление воды.
или, учитывая, что
(осуществляется при перемешивании),
H2O 
Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются.
На катоде выделяется водород, а на аноде — кислород, и электролиз сводится к электролитическому разложению воды.
Электролиз расплава гидроксида натрия
проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита — воды):
Закон Фарадея
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
— масса образовавшегося при электролизе вещества (г);
— эквивалентная масса вещества (г/моль);
— молярная масса вещества (г/моль);
— количество отдаваемых или принимаемых электронов;
— продолжительность процесса (с);
— константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества
(F = 96 500 Кл/моль = 26,8 Ач/моль).
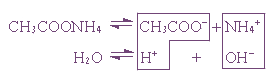
Гидролиз неорганических соединений
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
1. Соль, образованная сильным основанием и сильной кислотой KBr, NaCl, NaNO3)
, гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
2. В соли, образованной слабым основанием и сильной кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4)
гидролизу подвергается катион:
FeCl2 + HOH → Fe(OH)Cl + HCl
Fe 2+ + 2Cl — + H + + OH — → FeOH + + 2Cl — + Н +
В результате гидролиза образуется слабый электролит, ион H + и другие ионы. рН раствора
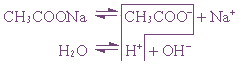
3. Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa)
подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
2K + +SiO3 2- + Н + + ОH — → НSiO3 — + 2K + + ОН —
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания.
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Пример 1. Гидролиз ацетата натрия.
или CH3COO – + Na + + H2O ↔ CH3COOH + Na + + OH –
Так как уксусная кислота слабо диссоциирует, ацетат-ион связывает ион H + , и равновесие диссоциации воды смещается вправо согласно принципу Ле Шателье.
В растворе накапливаются ионы OH — ( pH >7)
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Например, гидролиз карбоната:
Практическое значение обычно имеет только процесс, идущий по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей.
Равновесие гидролиза по второй ступени значительно смешено влево по сравнению с равновесием первой ступени, поскольку на первой ступени образуется более слабый электролит (HCO3 – ), чем на второй (H2CO3)
Пример 2 . Гидролиз ортофосфата рубидия.
1. Определяем тип гидролиза:
Рубидий – щелочной металл, его гидроксид — сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, — слабая кислота.
Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Продукты — гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Получили кислую соль – гидрофосфат рубидия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
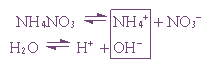
2. Гидролиз соли сильной кислоты и слабого основания:
Пример 1. Гидролиз нитрата аммония.
В случае многозарядного катиона гидролиз протекает ступенчато, например:
I ступень : Cu 2+ + HOH ↔ CuOH + + H +
II ступень : CuOH + + HOH ↔ Cu(OH)2 + H +
При этом концентрация ионов водорода и pH среды в растворе также определяются главным образом первой ступенью гидролиза.
Пример 2. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза.
На этом этапе необходимо написать уравнение диссоциации соли:
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты.
Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu 2+ + H-OH ↔ CuOH + + H + .
Образуется катион гидроксомеди(II) и ион водорода,
3. Составляем молекулярное уравнение.
Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два.
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль назовем «сульфат гидроксомеди(II)».
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
3. Гидролиз соли слабой кислоты и слабого основания:
Пример 1. Гидролиз ацетата аммония.
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Если продукты гидролиза могут удаляться из раствора, например, в виде осадка или газообразного вещества, то гидролиз протекает до конца.
Пример 2. Гидролиз сульфида алюминия.
2А l 3+ + 3 S 2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S (газ)
Пример 3. Гидролиз ацетата алюминия
1. Определяем тип гидролиза:
Соль образована катионом слабого основания и анионами слабой кислоты.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al 3+ + H–OH ↔ AlOH 2+ + H + ,
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону.
Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3 . Составляем молекулярное уравнение:
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
4. Соли, образованные сильной кислотой и сильным основанием
, гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O.
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот).
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na + направятся к отрицательно заряженному электроду – катоду. В результате этого и катионы Na + и анионы Cl − разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na + и потери электронов в случае ионов Cl − . То есть на катоде протекает процесс:
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
То есть мы имеем:
Катод: Na + + 1e − = Na 0
Анод: 2Cl − − 2e − = Cl2
Подведем электронный баланс:
Na + + 1e − = Na 0 |∙2
2Cl − − 2e − = Cl2 |∙1 + + 2e − + 2Cl − − 2e − = 2Na 0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na + + 2Cl − = 2Na 0 + Cl2
далее, объединив ионы Na + и Cl − получим, уравнение электролиза расплава хлорида натрия:
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na + , ни у анионов Cl − не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
Это касается металлов, находящихся в начале ряда активности по Al включительно.
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н + + 2е − = Н2 – в случае кислоты
Me n + + ne = Me 0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F − ), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F − ) на аноде идет процесс окисления молекул воды:
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO − − 2e − = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
При расплавлении хлорида цинка происходит его диссоциация:
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn 2+ + 2e − = Zn 0 |∙1
Анод: 2Cl − − 2e − = Cl2 |∙1
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
Zn 2+ + 2e − = Zn 0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Cu 2+ + 2e − = Cu 0
Нитрат-ион NO3 − — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Катод: Cu 2+ + 2e − = Cu 0 |∙2
2Cu 2+ + 2H2O = 2Cu 0 + O2 + 4H +
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e − = 2OH − + H2 |∙1
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
На катоде будет происходить восстановление катионов водорода H + , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н + + 2e − = H2 |∙2
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e − = 2OH − + H2 |∙2
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
Электролиз расплавов и растворов
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:
Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
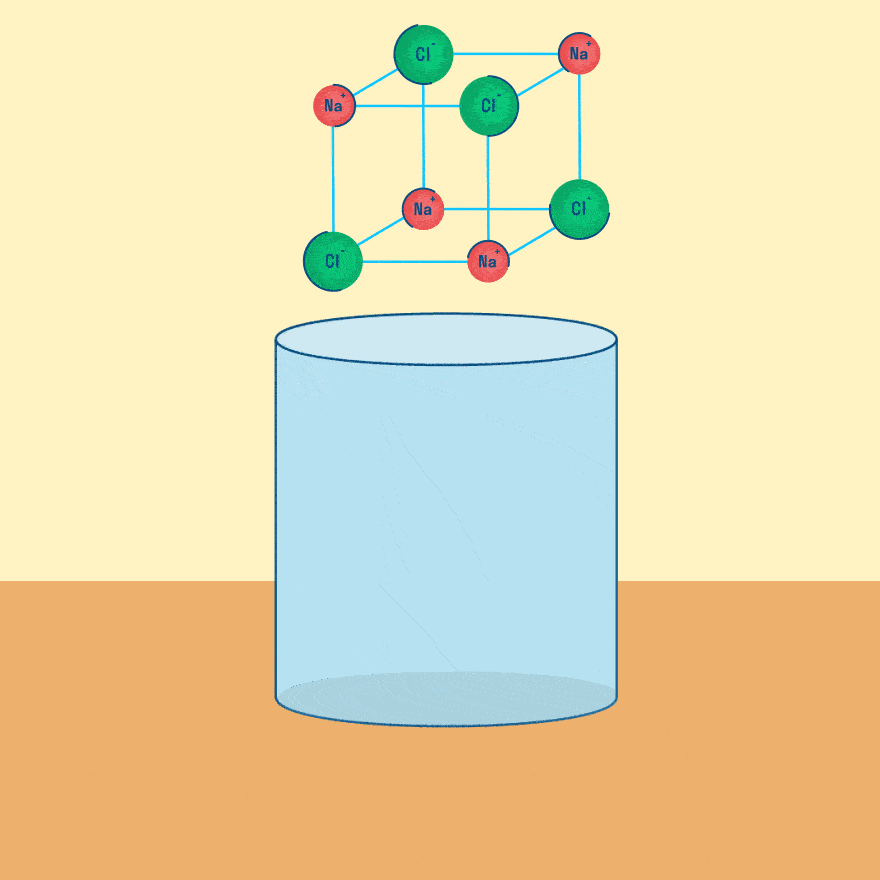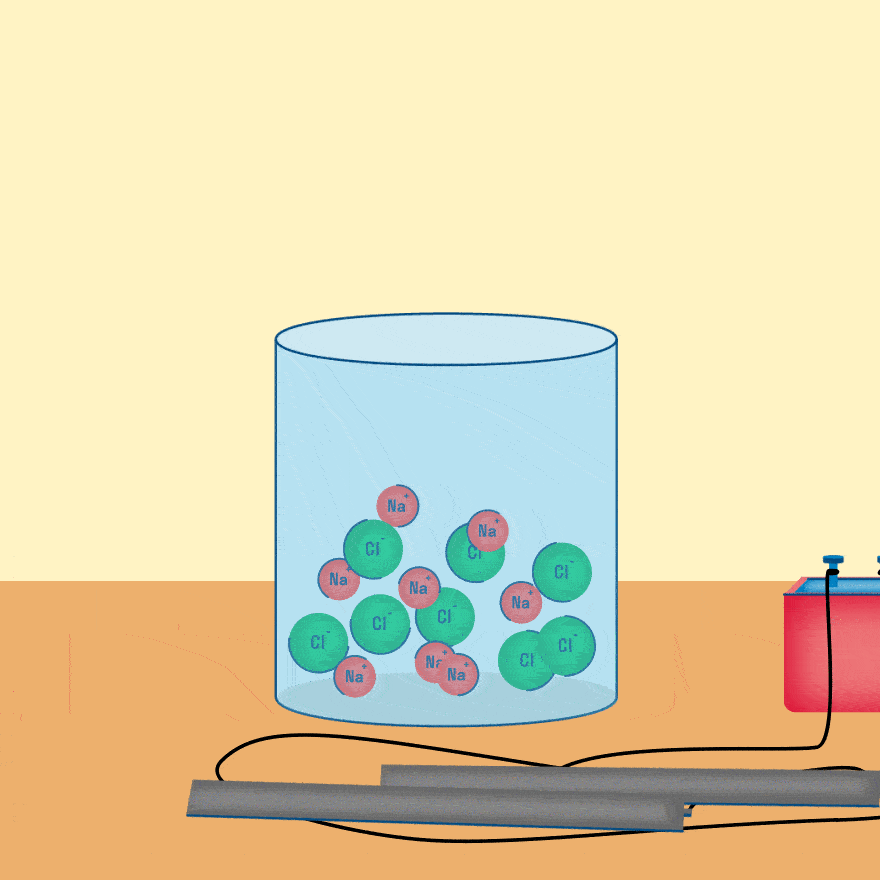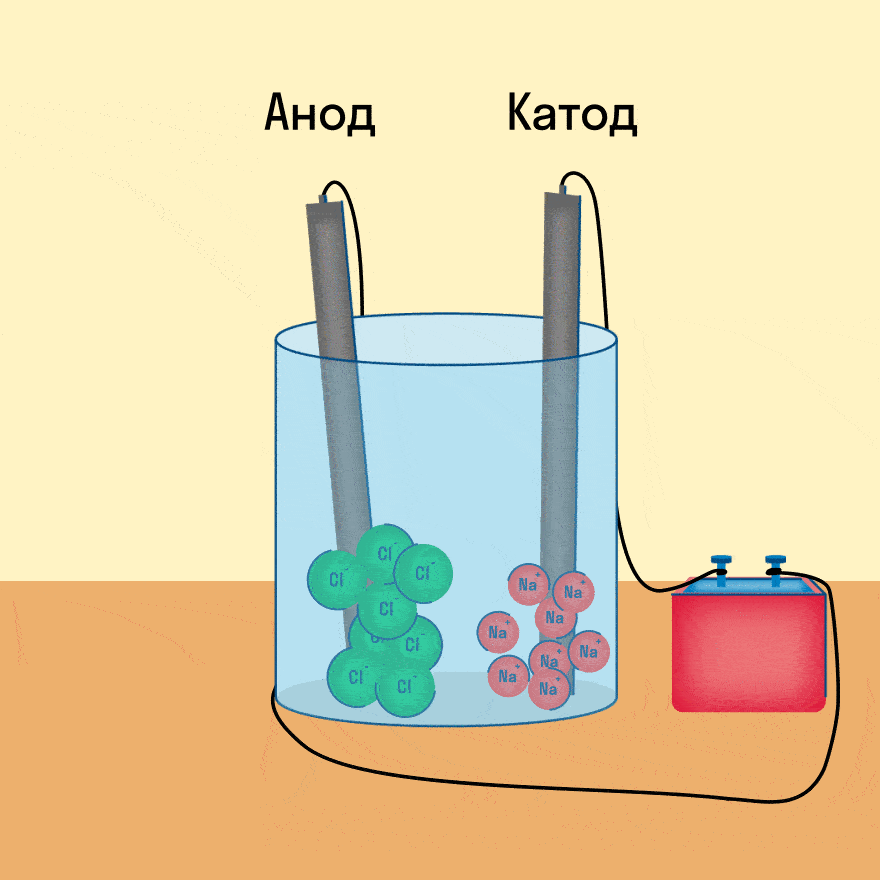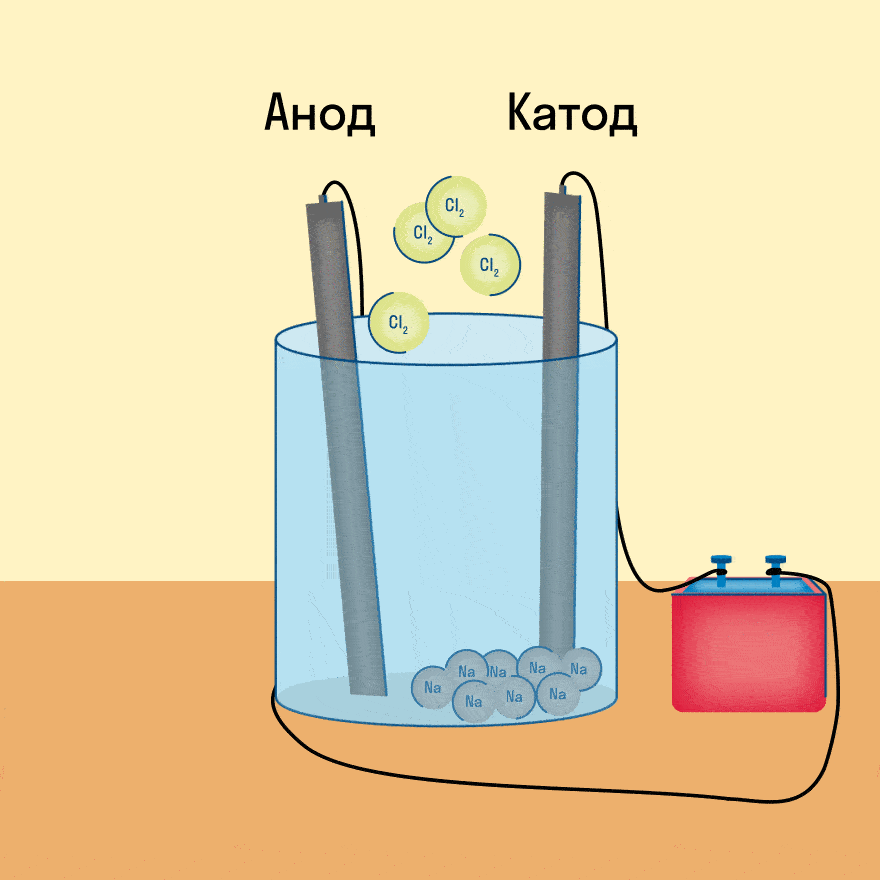
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
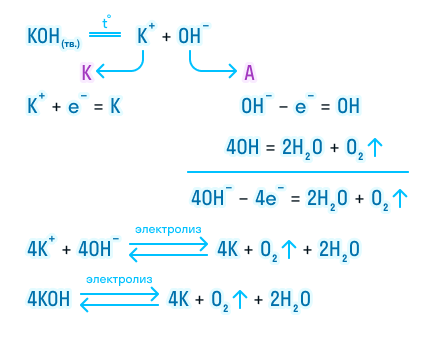
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH — как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Металл и водород.
При электролиза водного раствора фторида лития что на аноде выделится?
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/jelektroliz-rasplavov-i-rastvorov
http://skysmart.ru/articles/chemistry/elektroliz-rasplavov-i-rastvorov