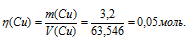Дополнительно о реакциях электролиза
В том случае, когда металл расположен в средней части ряда напряжения (от цинка до водорода) на катоде одновременно протекают два процесса: восстановление катиона металла и восстановление молекул воды. Рассмотрим электролиз водного раствора сульфата никеля с инертными электродами.
В растворе: NiSO4 = Ni 2+ + SO4 2– ;
Эти реакции никак не связаны между собой и суммировать их нельзя! Никакого простого соотношения между количеством никеля и водорода нет, оно зависит от концентрации, температуры, материала катода и прочих факторов.
А(+) (SO4 2– – не окисляются )
Общих уравнений (катод + анод) в этом случае тоже будет два. Чтобы получить общее уравнение основной реакции, мы должны сложить уравнение основного процесса на катоде и уравнение анодного процесса, с учетом коэффициентов электронного баланса:
K(-) Ni 2+ + 2ē = Ni |2
2Ni 2+ + 2H2O = 2Ni + O2 + 4H + – ионное,
2NiSO4 + 2H2O = 2Ni + O2 + 2H2SO4 – молекулярное уравнение основной реакции.
Аналогично получаем общее уравнение побочной реакции:
Опять же, суммировать общие уравнения основной и побочной реакций нельзя! (а это встречается в некоторых пособиях).
В заданиях ЕГЭ вряд ли потребуется составлять общие уравнения реакций для таких случаев, как правило, требуется только написать уравнения отдельных процессов на электродах. Остальное скорее пригодится на олимпиадах.
Немного о расчетах. Если в некоторой задаче дано количество вещества никеля, полученного при электролизе, можно рассчитать, сколько соли подверглось электролизу, сколько серной кислоты образовалось. Нельзя рассчитать, сколько всего выделилось кислорода (он образуется и во второй реакции!). Или этой реакцией придется пренебречь. Тем более (без дополнительных данных), нельзя рассчитать, сколько выделилось водорода.
Если сказано, сколько выделилось кислорода – нельзя рассчитать ничего, кроме общего количества вступившей в реакцию воды.
Вот если сказано, сколько выделилось никеля и сколько кислорода – тогда можно рассчитать все.
Г.М. Можаев
старший преподаватель
ТюмГУ, химический факультет;
ТОГИРРО
Какие процессы протекают на электродах при электролизе солей серной кислоты
Задача 711.
При электролизе водного раствора сульфата никеля (II) на аноде протекает процесс: 2H2O → O2 + 4H + + 2
Решение:
Стандартный электродный потенциал электрохимической системы Ni → Ni 2+ + 2 
Ni 2+ + 2 
Так как на аноде протекает процесс: 2H2O → O2 + 4H + + 2
Ответ: в).
Задача 712.
При электролизе водного раствора сульфата калия значение рН раствора в приэлектродном пространстве возросло. К какому полюсу источника тока присоединен электрод: а) к положительному; б) к отрицательному?
Решение:
Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов OH — , что приводит к повышению рН раствора. У анода будет идти выделение кислорода и накопление ионов H + , что способствует понижению рН раствора. В то же время в катодное пространство будут приходить ионы К + , а в анодное – ионы SO4 2- . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щёлочь, а в анодном – кислота. Поэтому электрод присоединён к отрицательному полюсу источника тока, т.е. является катодом, на котором протекает восстановление воды:
Ответ: б)
Задача 713.
При электролизе водного раствора соли значение рН в приэлектродном пространстве одного из электродов возросло. Раствор какой соли подвергся электролизу: а) КСI; б) СuCl2; в) Сu(NO3)2?
Решение:
Стандартные электродные потенциалы систем K → K + + 1 

Уравнения электродных процессов:
К(+): 2|4| 2H2O + 2 
А(-): 1|2|2Н2О — 4ē = О2↑ + 4Н +
В случае электролиза солей СuCl2 и Сu(NO3)2, на катоде будет происходить электрохимическое восстановление ионов меди:
Cu 2+ + 2 
Поэтому при электролизе солей малоактивного металла – меди рН раствора в приэлектродном пространстве не будет повышаться.
Ответ: а).
Задача 714.
При электролизе водного раствора NaOН на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде: а) 2,8 л; б) 5,6 л; в) 11,2 л; г) 22,4 л?
Решение:
При электролизе раствора едкого натра на электродах выделяется: водород (катод) и кислород (анод). Электрохимические процессы на электродах при электролизе NaOH:
катодный процесс: 2H2O + 2 
анодный процесс: 4OH — — 4 
Умножив, уравнение катодного процесса на два и сложив его с уравнением анодного процесса, получим суммарное уравнение процесса:
Из суммарного уравнения электролиза NaOH вытекает, что при электролизе щёлочи выделяется в два раза большее количество водорода, чем кислорода. Поэтому, если на аноде выделилось 2,8 л кислород, то на катоде в два раза больше выделится водорода: 2,8 . 2 = 5,6 л.
Ответ: б).
Задача 715.
При электролизе раствора CuCl2 масса катода увеличилась на 3,2 г. Что произошло при этом на медном аноде: а) выделилось 0,112 л С12 б) выделилось 0,56 л О2; в) перешло в раствор 0,1 моля Сu 2+ ; г) перешло в раствор 0,05
моля Cu 2+ ?
Решение:
При электролизе раствора соли CuCl2 с медным анодом, последний будет окисляться в ходе электролиза, переходить в раствор в виде катионов Cu 2+ и «переосаждаться» на катоде. Следовательно, будет наблюдаться перенос меди с анода на катод. Таким образом, если масса катода увеличилась на 3,2 г, то на аноде такое же количество меди перешло в раствор.
Рассчитаем количество меди:
Электролиз раствора сульфата никеля с никелевым анодом
В соответствии с последовательностью разрядки на аноде и катоде будут протекать следующие процессы:
(–) Анод: Ni 0 – 2ē = Ni 2+ ;
(+) Катод: Ni 2+ + 2ē = Ni 0 .
Весь процесс сводится к выделению никеля на катоде и постепенному растворению никелевого анода. Количество сульфата никеля в растворе остается неизменным.
Практическая часть
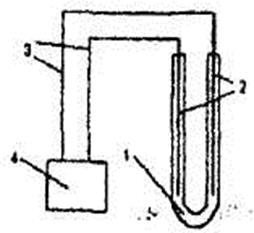
Электролиз водных растворов проводится в приборе, представленном на рис. 9.1. В качестве инертных электродов используются графитовые стержни карандашей.
Рис. 9.1. Прибор для проведения электролиза:
1 – U-образный сосуд с раствором электролита; 2 – электроды; 3 – токопроводящие проволоки;
4 – источник постоянного тока
Опыт №1.Электролиз с нерастворимыми электродами
Электролизер (U-образную трубку) наполните, не доходя до краев
1см, раствором соли, указанном в задании. Опустите в оба колена трубки электроды, включите прибор, отметьте все видимые изменения. Напишите уравнения катодного и анодного процессов, суммарное уравнение в ионно-молекулярном и молекулярном виде.
Идентификация продуктов, образующихся при электролизе солей,
на аноде:
1. Хлор (газ) определяется по резкому запаху, при появлении первых признаков которого прибор следует выключить.
2. Йод определяется по появлению коричневой окраски, характерному запаху, с помощью йодкрахмальной индикаторной бумаги.
3. Кислород – газ без запаха;
на катоде:
1. Водород – газ без запаха.
2. Если на катоде не выделяется водород, то осаждается металл в виде красноватого налета (медь), блестящих игольчатых кристаллов (цинк, свинец) и т. д.
Опыт №2. Электролиз с активным анодом
Опыт выполняется аналогично опыту №1. Один графитовый электрод заменяетсяметаллическим (железо, алюминий, цинк, медь), который подключается к положительному полюсу внешнего источника. Раствор соли для электролиза взять из опыта №1 по указанию преподавателя.
http://buzani.ru/zadachi/khimiya-glinka/1244-okislenie-sulfata-zheleza-ii-v-kisloj-srede-zadachi-646-649
http://mydocx.ru/7-39357.html