Электролиз раствора сульфата натрия
Сульфат натрия в водном растворе диссоциирует
Na2SO4 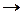
Так как натрий относится к первой группе металлов, то на катоде будет восстанавливаться водород из молекулы воды. На катоде выделяется водород, в прикатодном пространстве образуется гидроксид натрия.
На катоде (-): 4Н2О + 4е 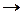
SO4 2- — анион кислородсодержащий, следовательно на аноде будет окисляться кислород из молекулы воды. На аноде выделяется кислород, в прианодном пространстве образуется серная кислота.
На аноде (+): 2Н2О – 4е 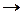
Таким образом, электролиз водного раствора сульфата натрия сводится к разложению воды на водород и кислород. В приведённых примерах используется инертный нерастворимый анод. В этом случае он выполняет единственную функцию – является передатчиком электронов.
Однако металлические аноды могут быть растворимыми. Растворимые аноды в растворах соответствующих солей под влиянием внешнего источника тока отдают свои собственные электроны и превращаются в положительно заряженные ионы, которые переходят в раствор
Кристаллическая решётка при этом разрушается. Такой процесс называется анодным растворением металла
Электролиз сульфата натрия уравнение реакции

webkonspect.com — сайт, с элементами социальной сети, создан в помощь студентам в их непростой учебной жизни.
Здесь вы сможете создать свой конспект который поможет вам в учёбе.
Чем может быть полезен webkonspect.com:
- простота создания и редактирования конспекта (200 вопросов в 3 клика).
- просмотр конспекта без выхода в интернет.
- удобный текстовый редактор позволит Вам форматировать текст, рисовать таблицы, вставлять математические формулы и фотографии.
- конструирование одного конспекта совместно с другом, одногрупником.
- webkonspect.com — надёжное место для хранения небольших файлов.
Опыт 3. Электролиз сульфата натрия с нерастворимыми электродами
Модуль 2. Основные процессы химии и свойства веществ
Лабораторная работа № 7
Тема: Электролиз водных растворов солей
Электролизомназывается окислительно-восстановительный процесс, протекающий на электродах при прохождении, электрического тока через раствор или расплав электролита.
При пропускании постоянного электрического тока через раствор электролита или расплав катионы движутся к катоду, а анионы — к аноду. На электродах протекают окислительнo- восстановительные процессы;. Катод, является восстановителем, так как он отдает электроны катионам, а анод — окислителем, так как ой принимает электроны у анионов. Реакции, протекающие на электродах, зависят от состава электролита, природы растворителя, материала электродов, режима работы электролизера.
Химизм процесса электролиза расплава хлорида кальция:
на катоде Са 2+ + 2e→ Са°
на аноде 2Сl — — 2е→ 2С1° → С12
Электролиз раствора сульфата калия на нерастворимом аноде схематически выглядит так:
на катоде 2Н + + 2е→2Н°→ Н2 2
на аноде 4ОН — 4е→ О2 + 4Н + 1
K2SO4+ 4Н2О 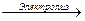
Цель работы:ознакомление с электролизом растворов солей.
Приборы и оборудование:выпрямитель электрического тока, электролизер, угольные электроды, наждачная бумага, стаканчики, промывалка.
Рис. 1. Прибор для проведения
3-токопроводящие проволоки; источник постоянного тока.
Реактивы и растворы:5% растворы хлорида меди СuС12, иодида калия КI, гидросульфата калия KHSO4, сульфата натрия Na2SO4, сульфата меди CuSO4, сульфата цинка ZnSO4, 20% раствор 
Опыт 1. Электролиз хлорида меди с нерастворимыми электродами
Электролизер наполните до половины объема 5% раствором хлорида меди. Опустите в оба колена электролизера по графитовому стержню, закрепите их неплотно отрезкам и каучуковой трубки. Концы электродов соедините проводниками с источниками постоянного тока. При незначительном запахе хлора электролизер немедленно отключите от источника тока. Что происходит на катоде ? Составьте уравнения электродных реакций.
Опыт 2. Электролиз иодида калия с нерастворимыми электродами
Наполните электролизер 5% раствором иодида калия, . прибавьте в каждое колено по 2 капли фенолфталеина. Вставьте вкаждое колено электролизера графитовые электроды и соедините их с источником постоянного тока.
В каком колене и почему окрасился раствор? В каждое колено добавьте по 1 капле крахмального клейстера. Где и почему выделяется иод? Составьте уравнения электродных реакций. Что образовалось в катодном пространстве?
Опыт 3. Электролиз сульфата натрия с нерастворимыми электродами
Половину объема электролизера наполните 5% раствором сульфата натрия и добавьте в каждое колено по 2 капли метилоранжа.или лакмуса. Вставьте в оба колена электроды и соедините их с источником постоянного тока. Запишите ваши наблюдения. Почему растворы электролита у разных электродов окрасились в разные цвета? Составьте уравнения электродных реакций. Какие газы и почему выделяются на электродах? В чем заключается сущность процесса электролиза водного раствора сульфата натрия
http://webkonspect.com/?room=profile&id=18592&labelid=176867
http://poisk-ru.ru/s4268t8.html


