Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df62aee7b8d717e • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Бор (B)
Первыми бор получили французы Гей-Люссак и Тенар в 1808 году.
В природе элементарный бор не встречается. Почит во всех минералах бор связан с кислородом, он встречается в небольших концентрациях во многих природных соединениях, в виде боратов и боросиликатов, в изверженных и осадочных породах, в водах морей, соляных озер, горячих гейзеров, грязевых вулканов.
Электронная конфигурация бора — 1s 2 2s 2 2p 1 (см. Электронная структура атомов).
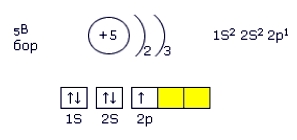
Рис. Электронная конфигурация атома бора.
На внешнем электронном слое бора находятся три электрона, которые он может либо отдавать, либо принимать еще 3, проявляя кислотность +3 или -3.
Бор, как простое вещество
Бор является инертным (при н. у.) неметаллом, образует ряд аллотропных модификаций, отличающихся строением кристаллической решетки — это самое твердное (после алмаза) природное вещество, обладающее малой электропроводностью. Свойства бора во многом зависят от его модификации и чистоты.
Химические свойства бора:
- при комнатной температуре бор вступает в реакцию только со фтором;
- при t=500-700°C реагирует с кислородом, серой, хлором: 4B + 3O2 = 2B2O3;
- при t=1200°C реагинует с кремнием (силицид бора) и азотом (нитрид бора): 3B + Si = B3Si;
- при t=2000°C реагинует с углеродом: 3C + 12B = B12C3;
- в сплавах с металлами бор образует бориды различного состава (в зависимости от условий сплавления и концентрации бора): Ni + 2B = NiB2; 2Ni + B = Ni2B;
- с парами воды бор вступает в реакцию при температуре красного каления: 6H2O + 2B = 2H3BO3 + 3H2.
- взаимодействует с горячими концентрированными азотной и серной кислотой, а также царской водкой: 3HNO3 + B = 3NO2 + H3BO3.
- с кислотами неокислителями бор не реагирует.
Соединения бора
Борная кислота (H3BO3) — это слабая одноосновная кислота, представляет собой растворимое в воде бесцветное кристаллическое вещество.
Борную кислоту получают из минерала сассолина.
Кислотные свойства борной кислоты обусловлены образованием протона при ее взаимодействии с водой:
При нагревании борная кислота, теряя воду, превращается в метаборную кислоту:
Борная кислота применяется как дезинфицирующее и антисептическое средство, для изготовления эмалей, специальных стекол, цементов, косметики, средств гигиены.
Борный ангидрид (B2O3) — диэлектрическое бесцветное кристаллическое вещество, легко переходящее в стеклообразное состояние.
Энергично вступает в реакцию с водой, образуя борную кислоту: B2O3 + 3H2O = 2H3BO3.
Получение борного ангидрида:
Борный ангидрид нашел применение в производстве специальных стекол и для получения бора.
Получение бора:
- металлотермией получают аморфный «грязый» бор (магний и натрий выступают в роли восстановителей): B2O3 + 3Mg = 2B + 3MgO;
- кристаллический бор высокой частоты получают при температуре 800°C восстановлением галогенидов бора водородом: 2BBr3 + 3H2 = 6HBr + 2B;
- промышленным способом бор получают электролизом расплава K[BF4] и B2O3 (t=800-1000°C).
Применение бора:
- в изготовлении полупроводников (бор — полупроводник p-типа с дырочной проводимостью);
- для изготовления огнеупорных, кислотостойких материалов (силициды устойчивы к действию воды, щелочей, кислот, высокой температуры);
- в качестве металлургических добавок при изготовлении жаропрочной, механически и коррозионноустойчивой стали;
- для изготовления деталей реактивных двигателей, газовых турбин, работающих в тяжелых условиях высоких температур;
- в ядерной энергетике для изготовления замедлителей быстрых нейтронов и для биологической защиты.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Электронное уравнение бора с концентрированной кислотой
Среди элементов IIIa группы один лишь бор относится к неметаллам. Представляет собой аморфное кристаллическое вещество красного или темного цвета, может быть бесцветным.
Общая характеристика элементов IIIa группы
От B к Tl (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Оксид бора проявляется кислотные свойства, алюминий и галлий — типичные амфотерные элементы, у соединений индий и таллия преобладают основные свойства.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 1 :
- B — 2s 2 2p 1
- Al — 3s 2 3p 1
- Ga — 4s 2 4p 1
- In — 5s 2 5p 1
- Tl — 6s 2 6p 1
Природные соединения
Получение
Бор получают путем пиролиза бороводородов, методом металлотермии (вытеснением активным металлом) и термическим разложением бромида бора в присутствии катализатора
BBr3 + H2 → (вольфрам, t = 1000-1200 С°) B + HBr
Химические свойства
- Реакции с фтором
Необходимо заметить, что бор довольно инертный неметалл. При комнатной температуре без нагревания он реагирует только со фтором:
Реакции с неметаллами
При нагревании бор реагирует с другими галогенами, азотом, фосфором, углеродом и кислородом.
При сильном нагревании бор способен восстановить кремний из его оксида:
Ионы бора окрашивают пламя в оттенки зеленого цвета.
Оксид и гидроксид бора
Оксид и гидроксид бора (борная кислота) проявляют кислотные свойства.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://prosto-o-slognom.ru/chimia/508_bor_B.html
http://studarium.ru/article/164






