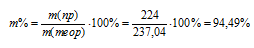Электронное уравнение при электролизе nai
Электролиз раствора NaI проводили при силе тока 6А в течении 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах и вычислите массу веществ, выделившихся на катоде и аноде.
Решение
Реакции на электродах:
Малярная масса эквивалента натрия и йода равна малярной массе вещества так как фактор эквивалентности равен 1.
Используем формулу Фарадея:
m = М(Na) ? I ? t / 96500 = 23 ? 6 ? 9000 / 96500 = 12,87 г
m = М(I) ? I ? t / 96500 = 127 ? 6 ? 9000 / 96500 = 71,07 г
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e30a806baa57b3b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составьте электронные уравнения процессов, происходящих на электродах
Решение задач на электролиз растворов солей
Задание 268.
Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5,74 А.
Решение:
Стандартный электродный потенциал системы Zn 2+ + 2 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 
Силу тока вычисляем из уравнения Фарадея относительно выделившегося объёма газа, имея в виду, что 5 ч = 18000 с и VЭ(О2) = 5,6 лг/моль, получим:
I = V . F/ VЭ . t = 6 . 96500/5,6 . 18000 = 5,74 A.
Здесь V – объём выделившегося газа, л; VЭ – эквивалентный объём газа, л/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: I = 5,74 А.
Задание 269.
Электролиз раствора СuSO4 проводили с медным анодом в течение 4 ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анодов. Ответ: 94,48%.
Решение:
Массу теоретического выхода меди вычислим из уравнения Фарадея, имея в виду, что 4 ч = 14400 с и МЭ(Cu) = 31,77 г/моль, получим:
m(Cu) = МЭ(В) . I . t/F = 31,77 . 50 . 14400/96500 = 237,04 г.
Здесь m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Выход по току (отношение массы выделившегося вещества к теоретически возможной) равен:
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 
При электролизе соли медного купороса на медном аноде на катоде будет электрохимическое восстановление меди Cu 2+ . На аноде будет происходить электрохимическое окисление меди, приводящее к выделению в анодное пространство ионов Cu 2+ , поскольку отвечающий этой системе стандартный электродный потенциал (+0,34 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О — 4 
т. е. в данном случае при электролизе будет происходить растворение медного анода и отложение меди на катоде. Электрохимические процессы при данном типе электролиза:
Катод: Cu 2+ + 2 
Анод: Cu 0 — 2 
Ответ: m% = 94,49%.
Задание 270.
Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вsчислите массу вещества, выделившегося на катоде и аноде? Ответ: 0,56 г; 71,0 г.
Решение:
Стандартный электродный потенциал системы Na + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление ионов I-, приводящее к выделению йода:
2I — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О — 4 
Массу веществ, выделившихся на электродах находим из уравнения Фарадея, имея в виду, что 2,5 ч = 9000 с и МЭ(Н2) = 1 г/моль, МЭ(I2) = 126,9 г/моль получим:
m(B) = МЭ(B) . I . t/F
m(H2) = МЭ(H2) . I . t/F = 1 . 6 . 9000/96500 = 0,56 г;
m(I2) = МЭ(I2) . I . t/F = 126,9 . 6 . 9000/96500 = 71,00 г.
m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Ответ: m(I2) = 0,56 г; 71,0 г.
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/270.html
http://buzani.ru/zadachi/khimiya-shimanovich/944-elektroliz-electrolysis-uravnenie-faradeya-zadaniya-268-270